缺铁孕鼠子代肝脏EPO及EPOR的mRNA表达及意义
邱智枫 ,桑璐 ,李佳斯 ,王维 ,刘稳 ,马雅静 *
(1石河子大学医学院,新疆 石河子 832000;2北京怀柔医院检验科,北京 101400;3涟水县人民医院检验科,江苏 淮安223400;4石河子大学医学院第一附属医院检验科,新疆 石河子 832000)
缺铁被认为是全球范围内最流行的微量营养素缺乏症之一,是全世界最常见的营养问题。铁缺乏症是指机体对铁的需求与供给失衡,导致体内储存铁耗尽,而红细胞内铁缺乏,最终发生缺铁性贫血。全球估计有3200万孕妇和2.73亿5岁以下儿童处于贫血状态,造成严重的健康和经济负担[1]。研究表明,围产期死亡率和不良出生结局风险增加与妇女在怀孕期间患缺铁性贫血有关,25%的子代出生后发育迟缓可归因于胎儿生长受限,而母亲孕期贫血是导致胎儿生长受限和早产的主要因素[2]。在怀孕期间,胎盘合体滋养层必须将母体铁转运到胎儿循环中以满足胎儿生长和发育的铁要求。孕期缺铁,胎儿未能从母体中获取足够的铁,使得婴儿出生后发生营养性缺铁性贫血及低出生体重、生长发育受限。
促红细胞生成素(erythropoietin,EPO)是一种分子量为34kDa,在胎儿时期由肝脏合成,成年后由肾皮质小管周围成纤维细胞合成分泌的糖蛋白[3],是具有促进哺乳动物红系祖细胞存活、增值、分化的主要激素。在缺铁导致机体低氧条件下,缺氧诱导因子可上调、活化EPO,EPO通过骨髓红系祖细胞上的表面受体 EPOR(erythropoietin receptor,EPOR)介导活性,促进红细胞生成,从而发挥其造血功能,有效缓解贫血。哺乳动物体内80%的铁参与EPO促进红细胞生成的过程。
国内外较少研究EPO及EPOR在缺铁大鼠子代组织中的表达情况,因此,本研究通过实时荧光定量PCR检测缺铁性孕鼠新生子代肝脏中EPO及EPOR的基因表达,观察缺铁性贫血对大鼠子代鼠肝脏中EPO及受体EPOR的mRNA表达水平的影响,并探讨其变化意义。
1 材料与方法
1.1 实验对象
从新疆医科大学动物实验中心[生产许可证号:SCXK(新)2013-0001]购买清洁级Wistar雌性大鼠36只及雄性大鼠18只,体重为60±5 g。适应性喂养后,将36只雌性大鼠分为2组,实验组雌性大鼠18只,对照组雌性大鼠18只。造模干预成功后取其后代仔鼠肝脏组织,置于冻存管中,保存于-80℃冰箱待测。
1.2 仪器设备与试剂
全自动血细胞分析仪(广东迈瑞,型号BC6800)及配套的试剂;铁染色试剂盒(上海太阳);动物组织总RNA提取试剂盒(北京天根);核糖核酸提取液Trizol(美国 Life);反转录试剂盒(日本 TaKaRa,RR037A);QuantiNova SYBR Green PCR试剂盒(德国QIAGEN);实时荧光定量PCR仪(中国泰普,型号TIB-8000)。
1.3 方法
1.3.1 动物饲养及分组
将36只雌性Wistar大鼠与18只雄性Wistar大鼠置于室温控制在18-25℃,相对湿度为40%~60%的动物室中饲养,并保持饲养环境安静、干净、通风干燥。雌雄分开饲养,在每个不锈钢鼠笼中放置3只大鼠。自由采食普通饲料和去离子水。
适应性饲养7 d后将36只雌性大鼠随机分为实验组和对照组,18只/组。实验组饲喂不添加铁元素配制的饲料,对照组饲喂添加铁元素的饲料,喂养至实验组大鼠出现缺铁性贫血。具体配制方法参考呼延武[4]等配方。
4周后将雌雄大鼠以2∶1合笼,通过观察阴栓,确认受孕后雌雄分开饲养。母鼠继续饲养对应的饲料至分娩。
1.3.2 大鼠造模期间血常规测定
内眦静脉采血1~2 mL,全自动血液分析仪检测全血中的血红蛋白(hemoglobin,Hb)、红细胞比容(hematocrit,HCT)、红细胞平均体积(mean corpuscular volume,MCV)、红细胞平均血红蛋白量(mean corpuscular hemoglobin,MCH)、红细胞分布宽度(red blood cell distribution width,RDW)等血液学参数。
1.3.3 新生仔鼠形态观察
比较实验组和对照组两组孕鼠所生每窝仔鼠的个数和外观,包括体型、毛发、色泽、行动力等。
1.3.4 实时荧光定量PCR检测子代组织EPO、EPOR含量
取新生仔鼠肝脏组织,按RNA提取试剂盒说明书,用1 mLTrizol提取液提取50-100 mg组织中RNA。根据日本TaKaRa公司的反转录试剂盒对提取的RNA进行反转录。
检测基因EPO的引物序列参数:上游5‘-CCAGAGCAGGAGAGACTGAGAGA-3’,下游 5‘-CGTCCTTGACTACATAGCGAGTTC-3’,产物大小 101 bp;
EPOR基因的引物序列参数:上游5‘-CACCTACCTGGTATTGGATGAATG-3’,下游 5‘-ATCCATAGTCGCAGGGTCTACAC-3’,产物大小 97bp;
内参基因GAPDH的引物序列参数:上游5‘-CTCTCTGCTCCTCCCTGTTC-3’,下游 5‘-GCCAAATCCGTTCACACCG-3’,产物大小 101 bp。
实时荧光定量PCR反应条件如下:95℃预变性 2 min,95℃变性 5 s,60℃退火延伸 10 s,40个循环。
根据相对定量分析公式2-△△Ct计算样本对应基因表达量。
1.4 统计方法
用统计软件SPSS 17.0统计数据,计量资料用均数±标准差(X±S)表示,若两组数据服从正态分布,用两独立样本t检验,否则使用非参数检验。P<0.05则认为差异有统计学意义。
2 结果
(1)血液参数比较:
造模前,实验组雌性大鼠和对照组雌性大鼠的血液学参数指标(HB、HCT、MCV、MCH、RDW)没有统计学差异(P>0.05)(表 1)。
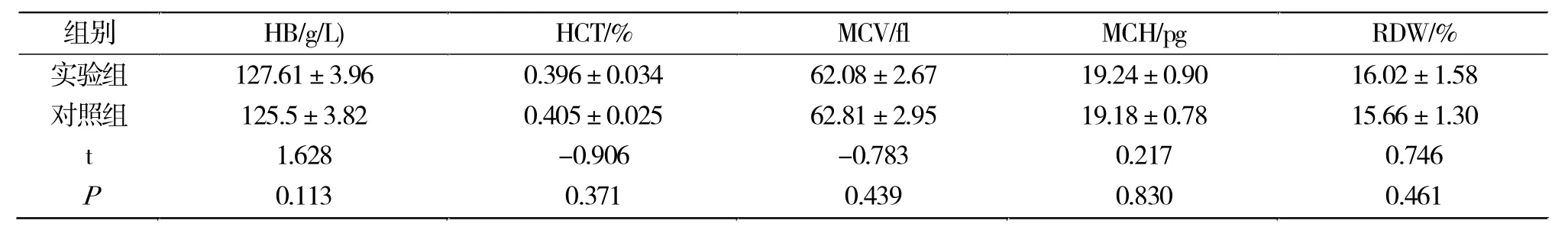
表1 造模前两组雌性大鼠血液学参数比较Tab.1 Comparison of hematological parameters of female rats before modeling
实验组经造模后,实验组雌性大鼠出现缺铁引起的缺铁性贫血,与对照组相比,其血常规中的HB、HCT、MCV、MCH等指标出现不同程度的下降,并明显低于对照组(P< 0.001),RDW则升高(P<0.001)(表 2)。
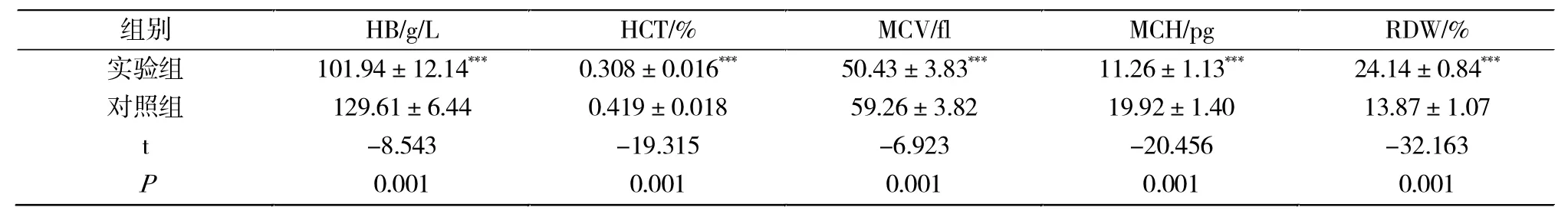
表2 造模后实验组和对照组血液学参数比较Tab.2 Comparison of hematological parameters between experimental group and control group after modeling
(2)新生仔鼠形态观察(图1)
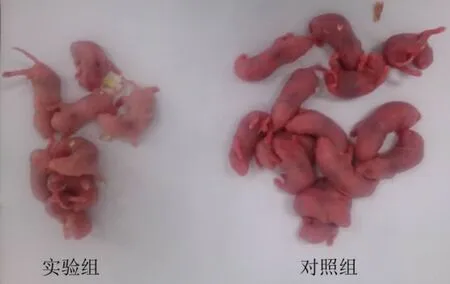
图1 实验组与对照组仔鼠外观比较Fig.1 Comparison of the appearance of newborn rats between the experimental group and control group
实验组孕鼠所生仔鼠窝仔数少,且仔鼠的体型较小,四肢和躯干皮肤苍白,动作迟缓,新生仔鼠出现缺铁性贫血症状。与实验组相比,而对照组大鼠的仔鼠活胎数和存活数量较多,存活的仔鼠体型也较大,皮肤和四肢较红润(表3、图1)。

表3 实验组与对照组每窝仔鼠数量比较Tab.3 Comparison of the number of littermates in the experimental group and control group
(3)实时荧光定量PCR检测EPO、EPOR
如图2和表4示,实时定量PCR检测结果发现,与对照组相比,实验组新生仔鼠肝脏EPO mRNA表达上调,差异有统计学意义(P<0.01),而两组仔鼠肝脏组织EPOR mRNA表达没有差异(P>0.05)。

表4 实时定量 PCR检测新生仔鼠肝脏中EPO、EPOR表达水平Tab.4 Detection of the level of EPO and EPOR expressions in neonatal pups liver by real-time quantitative PCR
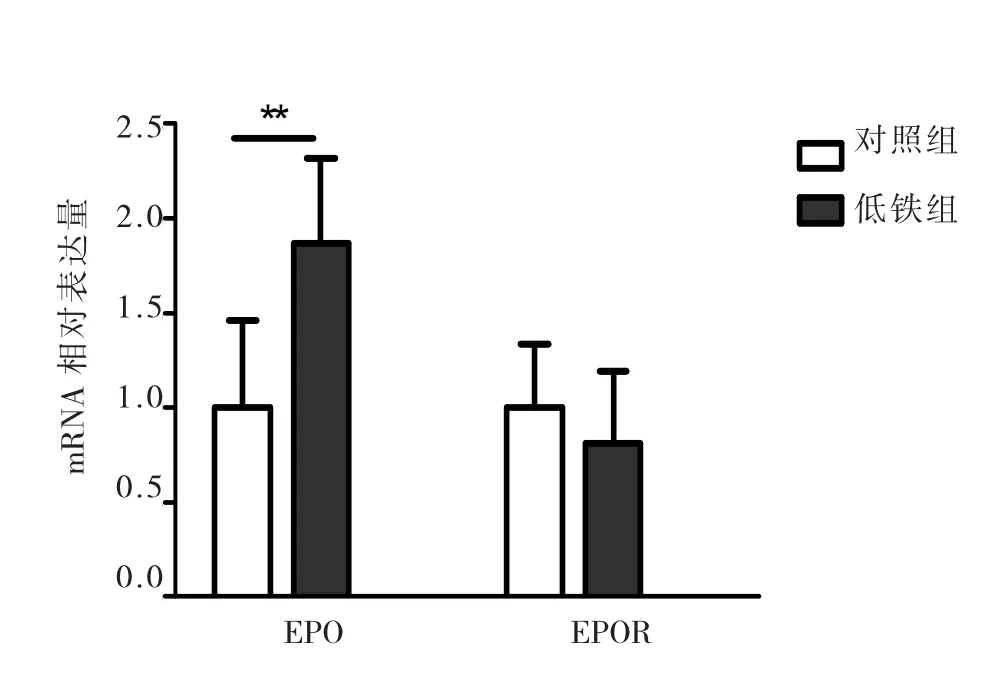
图2 实时定量 PCR检测新生仔鼠肝脏中EPO、EPOR表达Fig.2 Detection of the EPO and EPOR expressions in neonatal pups liver by real-time quantitative PCR
3 讨论
铁是人体必须的营养素,铁和卟啉合成血红素,参与血红蛋白的合成,还在正常细胞功能的各方面中都发挥着重要作用,包括参与线粒体的电子传递,调节很多细胞周期调控分子。铁的耗竭会导致DNA合成障碍,细胞周期从G1期进人S期阻滞,细胞发生凋亡[5]。
妊娠期贫血是重大的公共卫生问题,特别是在亚洲,调查显示,全球孕妇贫血患病率为41.8%,超过5600万妇女受到妊娠期贫血的影响,贫血母亲所生的婴儿即使在出生时并不贫血,他们出现日后贫血的风险依然较高,中、重度贫血的母亲甚至会造成胎儿宫内发育受限、宫内窘迫和早产,这可能是由于胎盘供氧、供血不足导致的[6]。
胎儿铁的储备量依赖于母体铁储备,而且婴儿期和幼儿期对铁的需求量是最大的,但是婴幼儿时期的饮食往往缺乏铁质,导致婴幼儿发生缺铁性贫血。本研究成功制备缺铁性贫血模型,并检测EPO及EPOR在缺铁子代肝脏组织中表达变化,以探讨其在缺铁新生子代造血方面中的意义。
(1)低铁对血液学参数及大鼠生殖机能的影响。
体内的铁供应不足、吸收过少或消耗过多时,可引起铁缺乏,而铁缺乏到了一定的程度,机体无法正常生产红细胞从而出现贫血时,即导致缺铁性贫血,缺铁性贫血属于小细胞低色素性贫血,会表现出红细胞分布宽度增高,而血红蛋白、红细胞平均体积、红细胞平均血红蛋白浓度均减低的表现[7]。
大鼠血红蛋白参数为 148(120~175)g/L,我们通过低铁饲料干预,制造大鼠铁缺乏模型,实验组Hb低于大鼠Hb参考值范围下限,且明显低于对照组(P< 0.001)。HCT、MCV、MCH 等指标出现不同程度的下降,而RDW升高,大鼠缺铁性贫血模型制备成功。孕妇缺铁性贫血可导致早产儿增加、胎儿低出生体重,小儿会生长发育障碍,智力发育障碍[8]。
本实验结果显示:与对照组比较,实验组孕鼠所生仔鼠数量少,且仔鼠体型小,四肢和躯干皮肤苍白,动作迟缓,出现缺铁性贫血症状,与文献报道相符。
(2)EPO在缺铁仔鼠肝脏中的表达及其作用。EPO是在机体缺铁导致缺氧时,胎儿时期由肝脏产生,成人时期由肾脏产生的,在血浆中循环并与红系祖细胞上大量表达的EPO受体结合,从而促进红细胞前体的存活、增殖和终末分化,导致红细胞增加,血液的携氧能力增强,增加组织氧张力,从而完成反馈调节,抑制EPO的进一步表达。
蒋斓[9]研究中,低铁仔鼠肝脏EPO表达呈增加趋势,但无统计学差异,而本研究中缺铁仔鼠肝脏EPO水平显著升高(P<0.01),可能与母鼠缺铁程度有关,本研究低铁干预时间较早,由于母鼠贫血程度较严重,血液中携氧能力下降,子宫肌层缺血、缺氧,氧气供应中断或贫血低氧条件下,未能满足胎儿对营养和氧气的要求,造成宫内缺氧。
缺氧时EPO不能通过胎盘,胎儿体内EPO主要由肝脏合成,因为加速血红蛋白合成需要增加铁量,胎儿铁优先从胎儿组织库转移到红细胞产生中,以增加红细胞的数量,从而增加携氧能力[10],这可能是本研究中新生仔鼠肝脏EPO表达升高的原因。
曾报道EPO在造血系统以外的功能,包括脂肪堆积和葡萄糖稳态的代谢调节。Dey等[11]曾报道,高剂量的EPO在增加红细胞压积的同时,还减轻小鼠体重、脂肪堆积,减少食物摄入量并增加能量消耗,而在非造血组织中敲除EPOR后,小鼠变得肥胖并且能量消耗下降。他们还认为EPO可以通过控制基底细胞内的Ca2+水平来负性调节垂体前叶的ACTH分泌,增加下丘脑POMC,减少食物摄入量和脂肪量积累,从而减轻体重,这表明EPO在下丘脑-垂体轴上的作用可以维持全身代谢稳态。
另外,慢性缺氧会导致胎儿生长下降,国外研究了小鼠高海拔和低海拔状态下,主要营养转运蛋白葡萄糖转运体、EPOR和转铁蛋白受体在合胞体微绒毛和基底膜部分的表达情况,发现孕妇血液合胞体微绒毛中EPO浓度和EPOR密度都增加了,但是在高海拔导致的慢性缺氧孕妇中,合胞体微绒毛中葡萄糖转运蛋白的密度降低了,因此,慢性缺氧可能通过减少氧气和营养物质输送到胎儿来减少胎儿生长[12]。
本研究中,实验组仔鼠的个体较小,体重较轻,可能与升高的EPO调节下丘脑垂体轴以及代谢有关。
(3)EPOR在低铁仔鼠肝脏的表达。
EPOR作为同型二聚体存在于红细胞祖细胞表面,在与EPO结合时,受体发生构象变化,使其胞内结构域紧密贴合,通过信号转导级联的启动,进行交叉磷酸化,从而发挥造血作用[13]。EPO受体在红系祖细胞之外广泛表达,在脑、心脏和肾脏中发挥非造血作用。
本研究通过实时荧光定量PCR检测新生仔鼠肝脏EPOR mRNA的表达情况,证实了EPOR也表达于新生仔鼠肝脏中,这是国内外未见报道的。
张志敏[14]等发现,制造宫内窘迫母鼠模型,其新生大鼠在生后脑组织EPO和EPOR在2h内迅速增加,而且EPOR可持续高表达数天。而本实验中实验组大鼠缺铁后其新生仔鼠肝脏EPOR表达未见增加,这是由于缺血缺氧后,各部位组织中EPOR的表达水平可能存在一定程度的差异,随着妊娠期进展,胎儿肝脏EPOR基因表达水平逐步降低[15]。
机体内哪些细胞表达EPOR,以及EPOR是否随着发育而变化,尚需进一步研究。
4 结语
(1)母亲孕期缺铁性贫血容易导致胎儿宫内发育受限,缺血缺氧,并且胎儿在出生后出现缺铁症状,表现为皮肤苍白,体重较轻,行动迟缓。
(2)缺铁子代新生儿体重减轻可能与胎儿肝脏升高的EPO调控下丘脑激素释放,减少脂肪堆积和增加能量消耗有关。
(3)EPO的代偿性升高可释放到血液从而发挥其造血功能,有效缓解贫血。
(4)本研究证实了新生仔鼠肝脏内存在EPOR,而在缺铁导致缺氧的新生儿个体中,EPO的作用主要与EPO的数量的增加有关,而受体EPOR并未发生显著改变。

