‘冀桑2号’嫁接苗对NaCl胁迫的生理响应
贾漫丽,李 娜,李季生,王 军,杨贵明
‘冀桑2号’嫁接苗对NaCl胁迫的生理响应
贾漫丽1,2,李 娜1,2,李季生1,2,王 军3,杨贵明1,2
(1. 河北省高校特产蚕桑应用技术研发中心,河北 承德 067000;2. 承德医学院蚕业研究所,河北 承德 067000;3. 河北省木兰围场国有林场管理局四合永林场,河北 承德 068450)
2014年4月,在河北省承德市,将‘冀桑2号’‘Jisang 2’嫁接在‘冀桑3号’‘Jisang 3’的砧木上。嫁接苗于次年4月移栽于盆中并置于防雨棚下。2015年6月,分别用质量浓度0.0%(CK),0.2%,0.3%,0.4%的NaCl溶液处理试验苗木28 d,处理后每隔7 d取样一次并检测各项生理指标。结果表明:随着NaCl胁迫时间的增加,‘冀桑2号’叶片中的相对电导率和丙二醛()含量不断上升;超氧化物歧化酶()、过氧化物酶()、过氧化氢酶()的活性先上升后下降,游离脯氨酸和可溶性糖含量先上升后下降;可溶性蛋白呈下降趋势。
‘冀桑2号’;耐盐性;NaCl胁迫;生理特性
土壤盐化是影响和限制植物生长的自然逆境之一,也是世界性的环境问题和生态问题[1-2]。近年来,对耐盐植物品种的选育和栽培技术研究越来越受到关注,在土壤含盐量为0.3%时便会影响大多数植物的正常生长[3-4]。而植物本身在盐胁迫过程中也会产生一定的耐受性及适应机制,如脯氨酸、可溶性糖等渗透调节物质的合成,可以调节细胞内外盐分浓度的平衡;酶保护系统的形成,可以清除细胞在胁迫过程中产生的过多的活性氧,保护细胞和组织免受氧化损伤。桑是桑科Moraceae桑属多年生双子叶木本植物,具有较强的抗逆性。近几年来,随着开展蚕桑资源的多元化利用[5],桑不仅作为家蚕唯一饲料树种,同时也是果叶兼用,以及沙漠化及盐碱化土地生态治理的优良树种。林天宝等[6]对广西4个桑品种的耐盐性进行了比较,根据各项生理生化指标进行隶属函数分析,耐盐高低顺序为:‘桂桑优12’>‘桂桑优62’>‘桑特优2号’>‘桑特优1号’。李卫国等[7]研究表明,桑品种‘农桑14号’、‘昂绿1号’、‘湖桑32号’、‘鲁插1号’叶片中渗透调节物质随盐分胁迫时间长短而变化,且品种间具有显著差异。
‘冀桑2号’‘Jisang 2’是河北省农林科学院特产蚕桑研究所(现承德医学院蚕业研究所)培育而成,1998年通过河北省树木良种审定。丰产性能好,叶质优良,耐寒性强,适宜辽宁以南、黄河中、下游地区,是适宜条桑育、密植型的桑新品种,具有良好的推广种植前景。目前,关于‘冀桑2号’的研究主要集中在不同部位的含水量、物候期以及抗旱性等方面[8-9],而有关盐胁迫方面的系统研究尚未见报道。因此,本研究以‘冀桑2号’嫁接苗为试验材料,胁迫时间为28 d,参考前人研究的桑树品种的耐盐阈值设定3个盐浓度水平(0.2%,0.3%,0.4% NaCl质量分数),通过控制培养实验和仪器检测分析,研究非致死浓度下胁迫时间对‘冀桑2号’生长和生理特性的影响,综合评价其耐盐能力,为桑耐盐性品种的筛选提供依据,同时为盐碱地区引种驯化及抗性研究提供理论指导。
1 材料与方法
1.1 试验地概况
试验在河北省承德医学院蚕业研究所5#试验地进行,40°12′ ~ 42°37′ N,115°54′ ~ 119°15′ E。属暖温带半湿润季风气候,年平均气温9℃,四季分明,昼夜温差较大,年平均降水量380 mm,70%集中在夏季。
1.2 试验材料
供试材料为‘冀桑2号’嫁接苗,接穗选用‘冀桑2号’,以1年生杂交实生桑‘冀桑3号’‘Jisang 3’的根作为砧木,遗传背景清晰,性状表现一致。两者均为承德医学院蚕业研究所培育并审定的品种,亲和力较强。
2014年1月,选剪直立的、冬芽饱满无损、表皮完好的‘冀桑2号’1年生枝条为接穗贮存于地窖,4月20日左右进行苗木嫁接。嫁接选用袋接法,在接穗芽苞膨大、树液开始流动时进行。砧木在青黄交接处剪成50°的斜面,剪口平滑,将接穗4刀削成标准状,插入砧木,插实插牢。嫁接完成后将嫁接苗植于大田,用湿土把接口以上接穗部位挤牢,然后覆盖接穗,覆土厚度为2 cm左右,常规管理1 a。
2015年4月,选取长势一致、无病虫害的苗木进行移栽,种植盆为PP材质,长58 cm,宽38.5 cm,高33.5 cm,每盆6株,盆底部有通气孔并配有托盘,防止盐分流失。盆内基质为培养土和园土以1:1混合,园土为含有养分较少的沙壤土,pH值6.5 ~ 7.0,有机质含量>4.5%。苗木截干高度40 cm左右,发芽后每株保留3个新梢。5月中旬将试验苗木移至防雨棚下。
1.3 试验设计
2015年6月,对试验苗木进行盐胁迫处理。胁迫处理前采取自然干旱的办法控水3 ~ 5 d。设3个处理,T1,T2,T3分别用分析纯NaCl配制成质量分数为0.2%,0.3%,0.4%的NaCl溶液,清水为对照(CK)。每个处理4个重复,每盆6株,共计24株,随机排列。试验开始时用相应浓度的NaCl溶液预先透灌,使盆内土壤的含盐量达到预定梯度,实验开始后每隔1 d监测1次土壤含盐量,并及时补盐补水。在盆土含盐量达到预定梯度后的第0天、第7天、第14天、第21天、第28天的7:00进行取样。随机取新梢第4至第6片正常生长的成熟叶片进行各项生理指标的测定,试验重复3次。
1.4 测定方法
分别于NaCl胁迫第0天和第20天测量已标记好的苗木高度,每个水平测定3株。苗木新梢生长量按下列公式计算:
=20d-0d
式中,为新梢生长量;20d为第20天测定的苗高;0d为第0天测定的苗高。
细胞膜透性采用电导法(DDSJ-308F)测定[10];丙二醛()含量的采用测定硫代巴比妥酸(TBA)比色法[12];超氧化物歧化酶()、过氧化物酶()、过氧化氢酶()活性的测定分别采用氮蓝四唑(NBT)光化还原法、紫外分光光度法[10]和愈创木酚比色法[11];游离脯氨酸、可溶性糖及可溶性蛋白含量测定分别蒽酮比色法、酸性茚三酮法和考马斯亮蓝G-250染色法[12]。
采用SPSS 18.1和Excel进行数据处理和分析。
2 结果与分析
2.1 NaCl胁迫下‘冀桑2号’苗木新梢生长量的变化
由表1可知,随着NaCl浓度的增加,‘冀桑2号’苗木的新梢生长量和新梢生长增长率均呈下降趋势。在NaCl胁迫第20天时,与CK相比,0.2%,0.3%,0.4%水平下的新梢生长增量分别下降了27.78%,30.56%,38.89%。说明‘冀桑2号’的新梢生长受到NaCl胁迫的抑制。

表1 NaCl胁迫对‘冀桑2号’苗木新梢生长量的影响
2.2 NaCl胁迫下‘冀桑2号’叶片相对电导率和MDA含量的变化
‘冀桑2号’叶片的相对电导率随着NaCl胁迫时间的延长总体上呈上升趋势(图1A)。NaCl胁迫前期(7 d),各盐处理的相对电导率变化较小,基本上维持在一个相对稳定的水平,胁迫第14天时,与CK相比,T1,T2,T3各处理组的相对电导率分别增加了15.74%,26.57%和31.54%;长时间的NaCl(14 ~ 21 d)胁迫导致相对电导率迅速增大,胁迫第28天时,各处理分别比CK增加了40.83%,69.92%和78.31%,差异显著(<0.05)。

图1 不同时期NaCl胁迫对‘冀桑2号’叶片相对电导率及MDA含量的影响
Figure 1 Effect of NaCl stress on membrane permeability andcontent in leaf of‘Jisang 2’ seedlings
在T1,T2,T3各处理下,‘冀桑2号’叶片中含量随着NaCl胁迫时间的延长,表现出逐渐上升的趋势(图1B)。在胁迫0 ~ 7 d,T1,T2,T3处理叶片的含量上升缓慢,分别比CK增加了7.63%,17.88%和28.54%,与CK间差异不明显(>0.05)。而在NaCl胁迫14 ~ 21 d时,‘冀桑2号’叶片含量显著增加,T1,T2,T3处理分别比CK增加了17.84%,44.45%,53.19%,到第28天时出现急剧上升,T1,T2,T3处理分别比CK增加了36.16%,51.22%,58.38%,极显著高于CK(<0.01)。
2.3 NaCl胁迫下‘冀桑2号’叶片中抗氧化酶活性的变化
随着NaCl胁迫时间的延长,T1,T2,T3各处理中‘冀桑2号’叶片的活性先升高后降低(图2A),CK中活性在胁迫过程中有较小升高趋势。NaCl胁迫初期(0 ~ 7 d)开始T1和T2,处理下‘冀桑2号’的酶活性迅速升高,并在处理的第21天达到高峰值420.447,396.966 u·g-1·min-1FW,分别比CK提高了93.31%,82.512%,差异达到极显著水平(<0.01),之后酶活性不断降低。而T2处理下,胁迫0 ~ 14 d时‘冀桑2号’的酶活性呈缓慢上升趋势,在处理14 ~ 21 d时酶活性迅速升高,并在第21天时达到高峰值336.576 u·g-1·min-1FW,比CK增加了54.75%,之后酶活性不断降低,但始终高于CK。
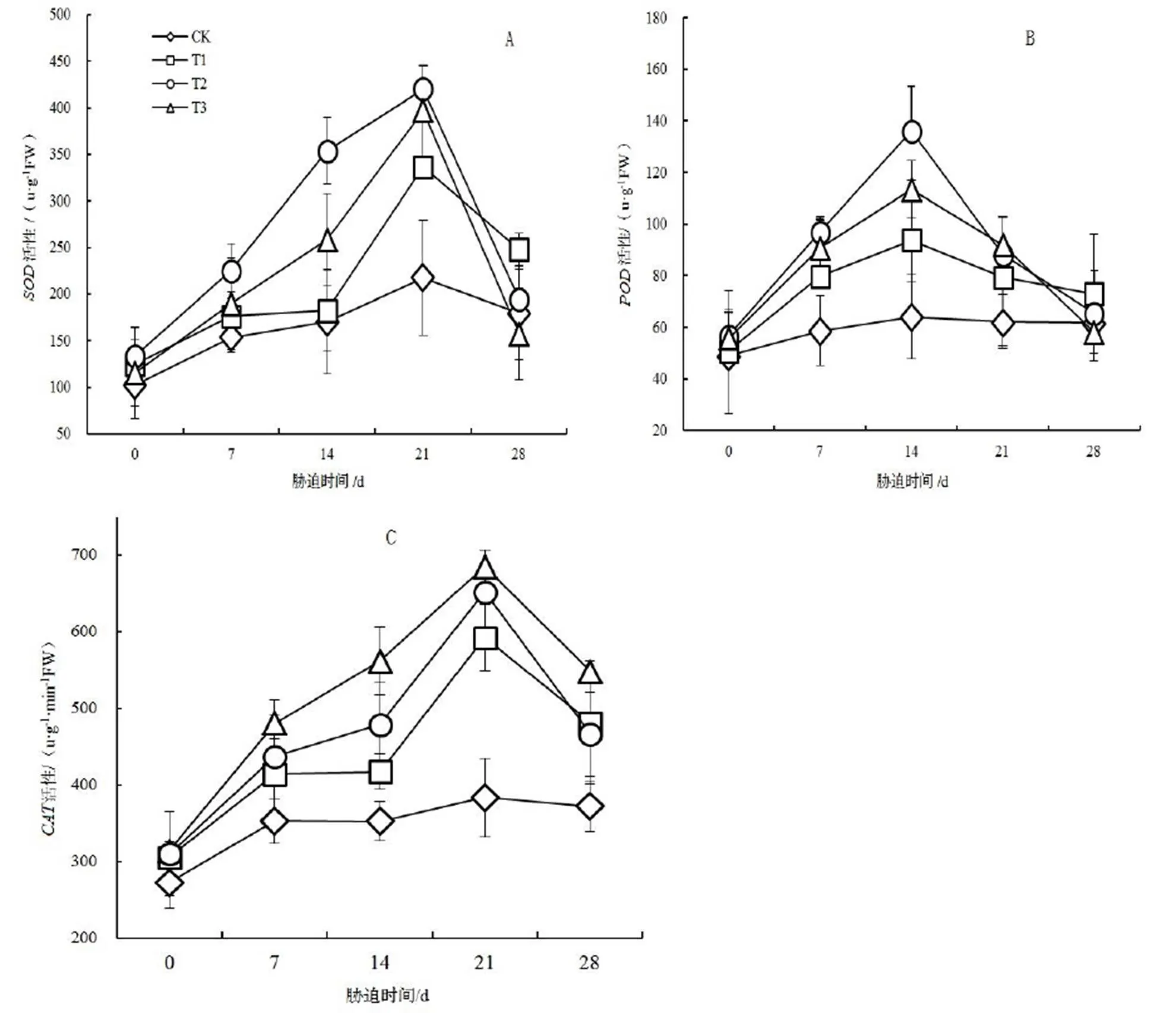
图2 不同时期的NaCl胁迫对‘冀桑2号’叶片SOD,POD和CAT活性的影响
Figure 2 Effect of NaCl stress on the activity of,andin leaf of‘Jisang 2’ seedlings
NaCl胁迫能够提高‘冀桑2号’的酶活性(图2B),各处理下‘冀桑2号’的活性随着NaCl胁迫时间的延长而增加,T1,T2,T3处理在胁迫第14天时分别达到高峰值93.759,136.078,113.396 u∙g-1FW,之后开始持续下降,到达高峰值时各处理分别比CK增加了46.19%,112.17%,76.81%,均显著高于CK(< 0.05)。
随着NaCl处理时间的延长,各处理水平‘冀桑2号’叶片的活性变化呈先上升后下降的趋势(图2 C),并且高峰值出现在胁迫处理后的第21天,到达峰值时各处理的活性分别比CK增加了52.55%,75.57%,67.56%,差异达到极显著水平(<0.01),之后持续下降,但仍高于CK。
2.4 NaCl胁迫下‘冀桑2号’叶片渗透调节物质含量的变化
如图3 A,在T1,T2,T3处理下,胁迫初期(0 ~ 7 d)‘冀桑2号’叶片的可溶性糖含量显著上升,第14天时分别达到高峰值7.878%,7.190%,6.824%,到达峰值时各处理的可溶性糖含量与CK相比增加了21.41%,10.80%,5.16%。T1,T2处理组与CK间差异显著(<0.05),而T3处理组与CK差异不显著(>0.05)。当胁迫持续一定时间(14 d)之后各处理组可溶性糖含量又逐渐下降,胁迫第28 d时迅速下降,达到3.861%,4.048%,3.789%,与CK相比降低了23.13%,17.44%,25.47%,差异显著(<0.05)。
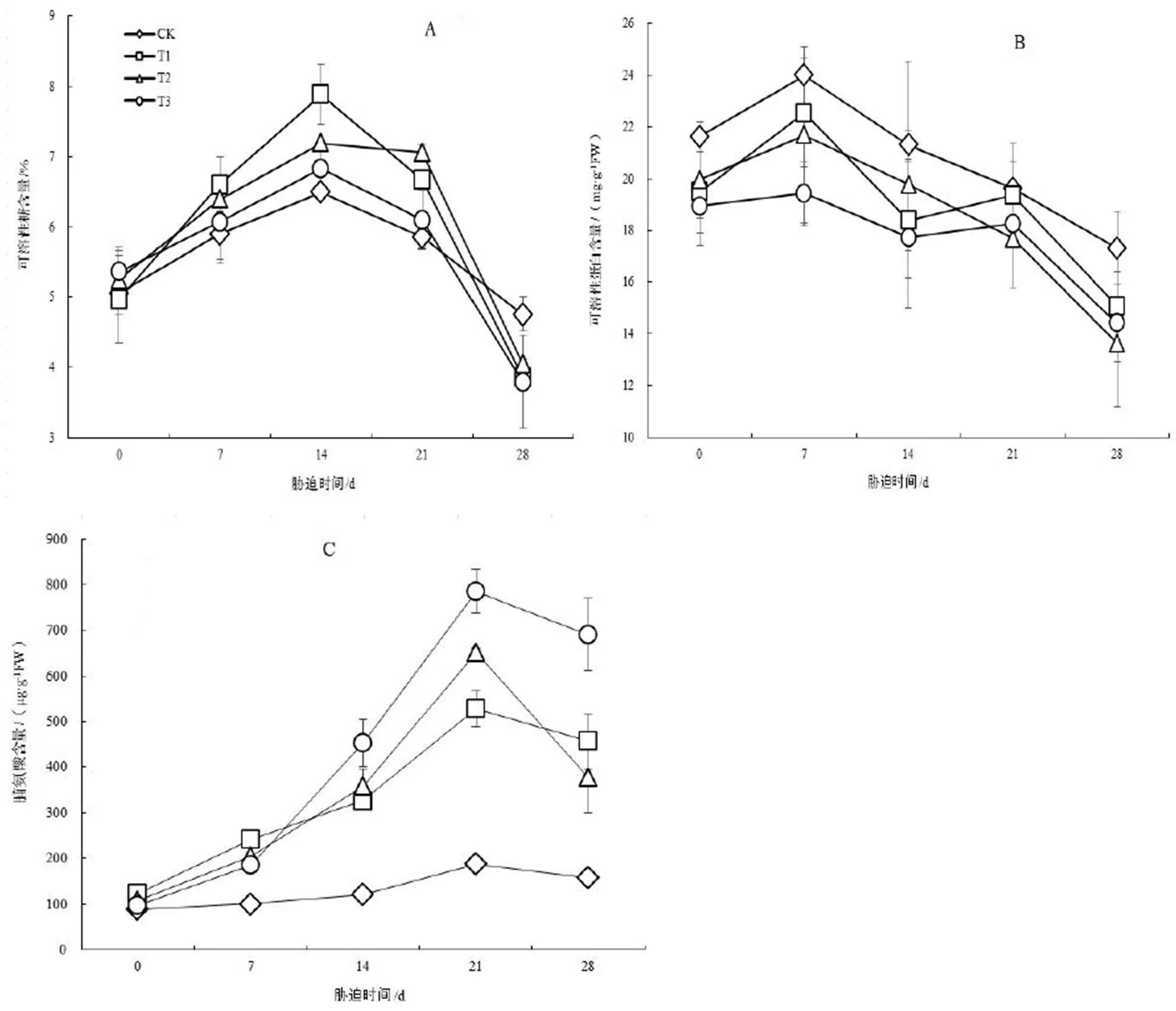
图3 不同时期的NaCl胁迫对‘冀桑2号’叶片可溶性糖、可溶性蛋白、脯氨酸含量的影响
Figure 3 Effect of NaCl stress on the content of soluble sugar, soluble protein and proline in leaf of‘Jisang 2’ seedlings
NaCl胁迫初期(0 ~ 7 d),各处理组‘冀桑2号’叶片可溶性蛋白含量小幅上升,而后随着胁迫时间越长,一直呈下降趋势(图3B),并始终低于CK,且处理间差异较小。在NaCl处理第14天时,T1,T3处理可溶性蛋白含量分别为18.393,17.718 mg∙g-1FW,分别比CK降低了15.85%,20.26%,而T2处理可溶性蛋白含量为19.773 mg∙g-1FW,比CK降低了7.76%。在处理的14 ~ 21 d,T1,T3处理的可溶性蛋白含量先上升后显著下降,而T2处理一直呈下降趋势。胁迫第28天,T1,T2,T3各处理组的可溶性蛋白含量分别为15.090,13.643,14.420 mg∙g-1FW,比CK降低了14.80%,26.97%,20.13%,差异达到显著水平(<0.05)。
在CK处理下,‘冀桑2号’叶片中脯氨酸含量很低,随着NaCl胁迫时间的延长,各处理组叶片中的脯氨酸开始大量积累(图3C)。胁迫第14天时,T1,T2,T3处理组叶片脯氨酸含量分别达到326.698,357.749,451.973 µg·g-1FW,比CK增加了169.42%,195.03%,272.73%。各处理组在胁迫第21天时达到高峰值528.996,651.369,784.954 µg·g-1FW,到达峰值时,分别比CK增加了181.32%,246.40%,317.44%,与CK间差异极显著(<0.01)。当NaCl胁迫持续21 ~ 28 d,叶片中脯氨酸含量开始下降,但仍显著高于CK(<0.05)。
3 结论与讨论
3.1 结论
试验结果表明:各浓度水平下的NaCl胁迫均可显著抑制‘冀桑2号’的新梢生长,浓度越大其新梢生长量受抑制越明显,其中0.4%的NaCl胁迫下叶片颜色有变黄现象。并且随着胁迫时间的延长,‘冀桑2号’叶片的细胞膜透性、膜脂过氧化程度显著增加;保护酶活力显著升高后又降低;其渗透调节物质游离脯氨酸和可溶性糖含量先上升后下降;可溶性蛋白含量显著降低,说明‘冀桑2号’对NaCl胁迫产生了一定的生理响应。
3.2 讨论
在逆境胁迫条件下,植物细胞因为膜脂过氧化作用而产生的,可作为植物细胞膜受损和自由基形成的主要指示物[13]。在本研究中,质量分数0.2%,0.3%,0.4%的NaCl胁迫下,‘冀桑2号’叶片中含量均高于CK。在胁迫初期(0 ~ 7 d),含量虽高于CK,但各个处理之间差异不显著,可见短时间的NaCl胁迫对‘冀桑2号’膜脂过氧化作用的影响较小。随着胁迫时间的延长,在胁迫中后期(14 ~ 28 d)时,含量显著升高,与CK相比达到极显著水平(<0.01),表明在胁迫后期,植物细胞的生理生化调节能力下降,受到膜脂过氧化作用加强,细胞的膜稳定性下降。林天宝等[6]研究不同浓度NaCl胁迫下广西‘桑特优1号’,‘桑特优2号’,‘桂优12’和‘桂优62’叶片中含量的变化呈上升趋势,本研究结果与之相符合。
抗氧化酶系统是决定细胞对胁迫抗性的关键因素[14],在植物遭遇逆境胁迫时,各种保护酶之间可产生协同作用,来降低或清除活性氧的产生,以此降低逆境胁迫对植物造成的伤害[15]。NaCl胁迫初期,‘冀桑2号’叶片细胞中的三种酶活性较高,相对电导率较低,说明细胞自身能够通过提高酶的活性来清除细胞内多余的活性氧自由基,三种保护酶是对NaCl胁迫非常敏感的生理指标。随着NaCl胁迫时间的延长,酶的活性达到高峰值后又迅速下降,而相对电导率则迅速升高,说明长时间的盐胁迫对三种保护酶的活性有较大的影响,活性氧自由基的产生量超过了酶的清除阈值,使得细胞受损,酶的活性受到抑制,‘冀桑2号’调节能力开始下降,细胞膜伤害加剧。与朱金方等[16]对中国柽柳、刘玉艳等[17]对紫花地丁的研究结果相同。
脯氨酸、可溶性糖和可溶性蛋白是植物体内存在的渗透调节物质,当机体遭遇逆境环境时,体内的渗透调节物质进行大量积累[18-19],以此降低细胞渗透势,维持细胞渗透平衡,是植物的一种耐盐生理机制[20]。本试验中,从胁迫初期开始,‘冀桑2号’叶片脯氨酸的含量缓慢增加,可溶性糖含量迅速升高后再降低,到胁迫后期与CK相比无显著差异。说明在等浓度NaCl处理下随着胁迫天数的增加,可溶性糖先于脯氨酸积累,也先于脯氨酸停止积累,两种物质的积累进程不同,在渗透调节方面可能存在着互补作用[21]。‘冀桑2号’叶片可溶性蛋白含量总体下降,因为NaCl胁迫会加速分解植物体内的可溶性蛋白,而胁迫后期(14 ~ 21 d),叶片可溶性蛋白含量又有小幅上升,原因可能是叶片细胞内正常蛋白的解体,而长期的NaCl胁迫诱导产生了一定量的新蛋白。研究结果与李卫国[8]等对NaCl胁迫下4个桑树品种(‘农桑14号’、‘昂绿1号’、‘湖桑32号’、‘鲁插1号’)叶片内渗透调节物质含量的变化结论符合。
植物对盐胁迫的响应是一个十分复杂的生理过程[22],已有的研究表明长期的NaCl胁迫会影响植物正常生长,高浓度NaCl胁迫可致植物叶片变黄、焦枯、落叶甚至死亡[23]。本试验设置的土壤盐分浓度尚未达到桑树盐害的临界浓度,叶片未见脱落,未见单株死亡。在后续研究中可以增加NaCl浓度水平,增大浓度梯度极差,以得到‘冀桑2号’能够正常生长的抗盐阈值及存活阈值。此外,延长胁迫时间,同时进行宏观指标的调查,并进一步到盐碱地大田中进行试验,可以进一步验证本试验结果的准确性,也可为今后开展耐盐性桑树新品种选育以及‘冀桑2号’在滨海盐碱地的推广提供理论依据。
[1] Zhou D,Lin Z L,Liu L M. Regional land salinization assessment and simulation through cellular automaton-Markov modeling and spatial pattern analysis[J]. Sci Total Environ,2012,439(11):260-274.
[2] 孙建昌,王兴盛,杨生龙. 植物耐盐性研究进展[J]. 干旱地区农业研究,2008,26(1):226-230.
[3] 徐恒刚. 中国盐生植被及盐渍化生态治理[M]. 北京:中国农业科学技术出版社,2004:131-135.
[4] 王东明,贾媛,崔继哲. 盐胁迫对植物的影响及植物盐适应性研究进展[J]. 中国农学通报,2009,25(4):124-128.
[5] 秦俭,何宁佳,黄先智,等. 桑树生态产业与蚕丝业的发展[J]. 蚕业科学,2010,36(6):984-989.
[6] 林天宝,刘岩,张薇. NaCl胁迫对桑苗生理生化指标的影响[J]. 浙江农业科学,2013,(12):1667-1672.
[7] 李卫国,宋尚文,孙明高,等. 盐分胁迫对桑树叶片中渗透调节物质含量的影响[J]. 蚕业科学,2010,36(2):313-318.
[8] 高妍夏,高德满,杨贵明,等.‘冀桑2号’不同部位及不同时期叶片含水量的测定[J]. 北方蚕业,2016,37(2):11-13.
[9] 陈赞华. 干寒地区桑树不同品种物候期与抗旱试验初报[J]. 吉林林业科技,2010,39(6):12-14.
[10] 李合生. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2006:164-167.
[11] 张志良,瞿伟菁. 植物生理学实验指导:第三版[M]. 北京:高等教育出版社,2003:123-124.
[12] 王学奎. 植物生理生化实验原理和技术[M]. 北京:高等教育出版社,2006:192-195.
[13] 胡晓丽. NaCl胁迫对李属彩叶植物生理特性及叶色的影响[D]. 保定:河北农业大学,2010.
[14] 胡晓立,李彦慧,陈东亮,等. 3种李属彩叶植物对NaCl胁迫的生理响应[J]. 西北植物学报,2010,30(2):370-376.
[15] 姚侠妹,纪敬,岳剑云. ABA对盐胁迫下侧柏活性氧代谢及其相关基因表达的研究[J]. 西北植物学报,2017,37(1):105-114.
[16] 朱金方,刘京涛,陆兆华,等. 盐胁迫对中国柽柳幼苗生理特性的影响[J]. 生态学报,2015,35(15):5140-5146.
[17] 刘玉艳,于凤鸣,曹慧颖,等. 盐胁迫对紫花地丁植株生长及生理特性的影响[J]. 西北林学院学报,2011,26(3):36-40.
[18] 班月圆,方荣俊,杜伟. 盐胁迫下9个地域来源桑种子的萌发率及部分生化性状差异[J]. 蚕业科学2016,42(6):960-967.
[19] 王合云,李红丽,董智. 滨海盐碱地不同土壤-树种系统中盐分离子分布与运移[J]. 水土保持学报,2014,28(4):222-226.
[20] 于振旭,王延平,王华田,等. 干旱和盐分交互胁迫对桑树部分生理生化性状的影响[J]. 蚕业科学,2014,40(6):987-994.
[21] 李云飞,李彦慧,王中华,等. 土壤干旱胁迫及复水对紫叶矮樱生理特性的影响[J]. 河北农业大学学报,2008,31(6):78-82.
[22] 杨升. NaC1胁迫下不同种源沙枣幼苗耐盐性差异生理机制研究[D]. 北京:中国林业科学研究院,2014.
[23] 董江超. NaCl胁迫下竹柳与红叶杨生理特性的研究[D]. 保定:河北农业大学,2015.
Physiological Responses of Grafted‘Jisang 2’ Seedlings to NaCl Stress
JIA Man-li1,2,LI Na1,2,LI Ji-sheng1,2,WANG Jun3,YANG Gui-ming1,2
(1. Hebei Universities R&D Centre for Sericulture and Specialty Enabling Technologies, Chengde 067000, China; 2. Institute of Sericulture, Chengde Medical University, Chengde 067000, China; 3. Hebei Mulan Paddock State-owned Forest Centre Administration, Chengde 068450, China)
Scions of‘Jisang 2’ were grafted in stocks of‘Jisang 3’ in April of 2014 in Chengde, Hebei province. Grafted seedlings were transplanted in pot under rain-proof shed in the April of the next year. In June of 2015, seedlings were treated with 0 (control),0.2%,0.3% and 0.4%NaCl solutions of NaCl for 28 days, and physiological parameters were detected each 7 days after treatment. The results showed that relative conductivity and malondialdehyde () content in leaves of‘Jisang 2’ increased with stress duration of NaCl, while the activities of superoxide dismutase (), peroxidase () and catalase () increased first and then decreased, as well as the content of free proline and soluble sugar, and soluble protein decreased.
‘Jisang 2’; salt tolerance; NaCl stress; physiological property
10.3969/j.issn.1001-3776.2018.04.004
S888.2
A
1001-3776(2018)04-0021-07
2017-11-14;
2018-05-25
贾漫丽,硕士研究生,助理研究员,从事蚕桑资源评价与利用研究;E-mail:94789458@qq.com。
杨贵明,硕士,研究员,从事蚕桑资源综合利用研究;E-mail:seri999@163.com。

