鼠神经生长因子对急性脑梗死患者外周血EPCs、VEGF及SDF-1水平的影响
于丽 高凤岩 尹惠丽 陈永庆 徐丽丽
急性脑梗死是急性脑供血障碍导致的脑细胞变性坏死,临床上主要应用药物或其他手段来改善梗死区微循环、保护缺血神经元和促进功能恢复。但由于对急性脑梗死的病理机制尚不完全清楚,目前还没有十分有效的传统药物及方案阻滞其进展[1]。鼠神经生长因子(mouse nerve growth factor,mNGF)是从小鼠下颌下腺提取的一种具有营养神经元和促进神经突触发育生长作用的活性蛋白,与人神经生长因子没有显著的种属特异性,具有明显的神经细胞保护、营养和再生功能,是治疗周围神经损伤的有效药物[2]。近年研究证实其对中枢神经损伤恢复亦有一定作用[3-5]。本研究通过观察mNGF对急性脑梗死患者外周血内皮祖细胞( Endothelial progenitor cells,EPCs)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、基质细胞衍生因子-1(stromal cell-derived factor-1,SDF-1)等内皮功能标志物水平的影响,进一步探讨其对急性脑梗死的治疗机制。
1 资料与方法
1.1 一般资料
选取 2015年3月-2017年7月本院收治的急性脑梗死患者130例,均符合2010年中国急性缺血性脑卒中诊断标准[6],并经CT及MRI 检查证实。纳入标准:①初次发病;②病程≤48 h;③生命体征稳定、格拉斯哥昏迷评分(GCS)>8分;④无严重肝肾功能不全;⑤患者或家属知情同意。排除标准:①合并小动脉病变、颅内出血、心源性栓塞、动脉畸形引起的缺血性脑卒中;②过敏体质患者;③合并有严重精神疾病以及其他不能配合治疗的患者。按照数字列表法将符合纳入标准及排除标准的130例患者随机分为对照组和观察组,每组各65例。其中对照组男39例、女26例, 年龄53~86岁,平均年龄(70.9±18.3)岁,体重指数 (21.26±3.45)kg/m2,梗死面积(9.91±2.31)cm3,美国国立卫生研究院脑卒中量表(national institute of health stroke scale,NIHSS) 评分(14.65±4.58)分;观察组男37例、女28例,年龄 55~85岁,平均年龄(71.2±18.7)岁,体重指数(20.93±3.67)kg/m2,梗死面积(10.35±2.78)cm3,NIHSS评分(15.10±4.60)分。2 组在性别比例、年龄、体重指数、梗死面积、NIHSS评分等基线资料方面比较无明显差异 (P>0.05),具有可比性。
1.2 治疗
对照组给予灯盏细辛注射液活血祛瘀,阿司匹林肠溶片抑制血小板聚集,尼莫地平扩张脑血管、改善微循环,他汀类药物降脂稳斑,胞二磷胆碱营养神经等常规急性脑梗死治疗,如合并有颅内高压、高血压病、感染、糖尿病、水电解质紊乱则给予脱水降颅压、控制血压、抗感染、降血糖及调节电解质平衡等治疗;观察组在常规治疗基础上加用鼠NGF [北京生物制药股份有限公司生产,规格:30 μg(生物学活性≥15 000 AU)/瓶,国药准字S20060023]治疗,将鼠NGF 30 μg 溶于2 mL生理盐水中肌内注射,30 μg/次,1 次/d,21 d为一个疗程,2组均治疗1个疗程。
1.3 观察指标
1.3.1 疗效评定 根据NIHSS评分变化程度进行疗效评估,分为基本痊愈、显效、有效、无效。 NIHSS评分下降91%~100%为基本痊愈;NIHSS评分下降46%~90%为显效;NIHSS评分下降18%~45%为有效;NIHSS评分下降17%以下为无效。总有效率=(基本痊愈+显效+有效)/总例数×100%[7]。
1.3.2 梗死面积、NIHSS评分及格拉斯哥昏迷指数(GCS)评分 根据颅脑MRI检查表现、参照Pullicino公式[8]计算2组治疗前、后梗死面积:梗死面积(cm3)=长×宽×MRI扫描阳性层数÷2。应用NIHSS评分进行神经功能缺损评估,评分越高,神经功能受损越严重;应用GCS 评分评价患者昏迷程度,有睁眼反应、语言反应和肢体运动三个方面,得分值越高,提示意识状态越好。
1.3.3 外周血EPCs数量、VEGF及SDF-1水平 应用CytoFLEX型流式细胞仪(美国Beckman Coulter公司)检测治疗前后外周血 EPCs 细胞数量的变化,CD34+细胞中CD133/VEGFR-2双阳性即为EPCs细胞。采用酶联免疫吸附法检测2组血浆VEGF、SDF-1水平(上海超研生物科技有限公司提供试剂盒)。
1.4 统计学处理
2 结 果
2.1 2组临床疗效比较
观察组治疗总有效率为83.08%,明显高于对照组的67.69%(P<0.05)(表1)。
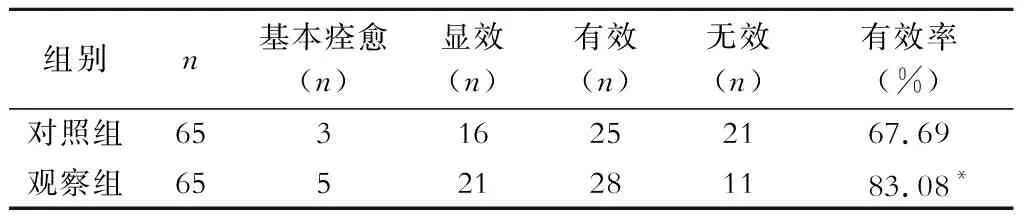
表1 2组临床疗效比较
注:与对照组比较,*P<0.05
2.2 2组治疗前后梗死面积、NIHSS评分及GCS评分比较
与治疗前比较,2组治疗后梗死面积、NIHSS评分明显降低(P<0.05),GCS 评分明显增高(P<0.05),但观察组变化幅度显著大于对照组(P<0.05)(表2)。
2.3 2组治疗前后血浆EPCs数量、VEGF及SDF-1水平比较
2组治疗前外周血EPCs数量、VEGF及SDF-1水平无明显差异(P>0.05),观察组治疗后EPCs数量、VEGF及SDF-1水平显著高于常规组同期水平(P<0.05)(表3)。
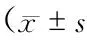
表2 2组治疗前后梗死面积、NIHSS评分及GCS评分比较)
注:与对照组比较,*P<0.05
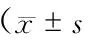
表3 2组治疗前后外周血EPCs数量、VEGF及SDF-1水平比较)
注:与对照组比较,*P<0.05
3 讨 论
神经生长因子是神经营养因子家族中最重要的成员之一,也是目前研究最多的神经营养因子。研究已证实能与效应细胞上的特异性受体结合,启动信号传导通路,参与效应细胞结构蛋白及稳定性的调节,诱导和增加结构蛋白及功能蛋白的合成,调控效应细胞蛋白质磷酸化和基质表达,从而促进轴突再生而起到保护和修复神经元的作用,尤其对于缺血性脑血管病可显示出一定的保护缺血神经元和促进功能恢复等功效[9]。mNGF是从小鼠颌下腺分离取得神经生长因子,可通过增强自由基清除剂的活性、缓冲兴奋性氨基酸的神经毒性、稳定细胞内Ca2+浓度等机制抑制脑缺血瀑布反应,加速脑梗死灶缺血半暗带内可挽救区域损伤细胞的修复[10]。本研究在常规药物治疗的基础上加用mNGF治疗急性脑梗死,结果显示加用mNGF治疗的观察组治疗总有效率显著高于对照组,在梗死面积、NIHSS评分、GCS 评分等方面也明显改善。
EPCs是一类能增殖分化为成熟血管内皮细胞的前体细胞,在正常情况下参与血循环的 EPCs很少,但当机体处于严重应激反应及病理情况下骨髓中 EPCs可动员至外周血循环,参与损伤血管的修复。近年研究表明,EPCs可提高缺血组织的血管新生能力,促进内皮细胞修复[11]。目前EPCs对缺血性疾病治疗作用已成为新的研究热点。VEGF可特异性地直接作用于血管内皮细胞,通过增强内皮细胞内囊泡、细胞器等活性来提高小血管通透性,从而引起内皮细胞和基质细胞的转移,被认为是目前最强的上调血管生成的重要因子之一。VEGF大量表达有助于减轻缺血低氧对神经元的损害,刺激神经细胞轴突的生长和改善神经细胞的生存环境[12]。SDF-1是近年来备受关注的血管刺激因子,属于G蛋白偶联受体超家族中的重要因子,对祖细胞有明显趋化作用,主要与其受体 CXCR4 结合,可通过CXCL12/CXCR4介导的信号途径促进内皮细胞增殖、迁移和血管新生[13]。实验研究显示,通过对脑卒中大鼠实施颅内注射 SDF-1,3 d后可见缺血半暗带周围组织血管密度增高[14]。另有研究显示血浆SDF-1水平与脑卒中严重程度相关,缺血缺氧能显著上调SDF-1的分泌和表达,并参与EPCs的骨髓动员[15]。本研究通过肌肉注射的给药方式对急性脑梗死患者实施连续治疗1个疗程,显示治疗后EPCs数量、VEGF及SDF-1水平显著高于常规组同期水平,神经功能缺损症状明显改善,表明mNGF可能通过诱导EPCs、VEGF、SDF-1等内皮因子的表达来促进急性脑梗死患者血管形成和微循环的改善,从而发挥其抗脑缺血作用。
综上所述,mNGF 可促进急性脑梗死患者外周血EPCs、VEGF及SDF-1水平表达,从而有效改善脑梗死后神经功能缺损症状。

