CRISPR/Cas9技术敲减Ku80基因对人乳头状甲状腺癌细胞生物学功能的影响
范亚莉,王娟红,魏 威,方航荣,段 瑛,李娜苗,张莹莹,李建英
(1西安市中心医院呼吸内科,西安 710003;2延安大学医学院;3西安市第三医院病理科;*通讯作者,E-mail:657237987@qq.com)
甲状腺癌是内分泌系统最常见的恶性肿瘤。甲状腺癌中80%-85%为甲状腺乳头状癌(PTC)[1]。PTC好发于中、青年女性,大多数患者预后良好,然而,部分患者仍存在复发、转移、甚至因癌死亡的风险[2-4]。近年来,全世界范围内,PTC发病率显著上升,部分患者还表现为甲状腺内的多发癌。研究PTC病因及发病机制,寻求除手术治疗、I131治疗以外其他潜在的新的治疗方案对于预防及治疗PTC,提高PTC患者预后具有重要意义。
Ku80是Ku70/Ku80异源二聚体的组成单位,广泛存在于哺乳动物细胞内,在非同源末端连接(NHEJ)DNA修复中具有重要作用。Ku80可以与断裂的DNA双链末端结合,吸引DNA依赖性蛋白激酶并引发NHEJ途径的DNA修复[5]。Ku80除了具有DNA修复作用之外,还涉及其他细胞过程,包括端粒维持、抗原受体基因排列、细胞周期调节、集落形成和细胞凋亡等[6]。近年来,有研究发现Ku80蛋白的活性与某些恶性肿瘤的发生、发展相关[7]。本课题组在前期研究中,通过免疫组化实验也发现人甲状腺乳头状癌组织中Ku80蛋白高水平表达,而且发现Ku80的表达与肿瘤TNM分期中肿瘤T分期相关。本次研究拟在细胞水平上,进一步研究Ku80基因及其表达在PTC中的作用。我们检测PTC癌细胞株K1及B-CPAP细胞中Ku80的mRNA表达水平,并应用CRISPR/Cas9敲减技术,研究Ku80对PTC癌细胞生物学功能,包括增殖、凋亡、侵袭和克隆形成能力等的影响。
1 材料和方法
1.1 材料
甲状腺乳头状癌细胞株K1(购自European Collection of Cell Cultures,ECOCC)维持在补充有10%胎牛血清的Dulbecco’s改良Eagle’s培养基中,甲状腺乳头状癌B-CPAP细胞株(购自中科院上海细胞库)维持在补充有10%胎牛血清的1640培养基中(美国,Gibco公司)。Ku80兔抗人一抗购自美国Cell Signaling公司。胎牛血清FBS购自澳洲Ausbian公司、DMEM培养基购自美国Cornning公司、胰蛋白酶购自上海化学试剂公司。CRISP/CAS9双载体慢病毒购自上海吉凯基因有限公司,且由该公司完成CRISP/CAS9双载体慢病毒包装并测序验证。Lipofectamine2000购自美国invitrogen公司。
1.2 方法
1.2.1 RT-PCR技术检测Ku80在不同细胞株中的表达 ①总RNA的提取:使用Trizol试剂盒在K1、B-CPAP细胞中提取总RNA,Nanodrop 2000/2000C分光光度计分析测定所抽提RNA的浓度及质量。②cDNA的合成:取2 μg总RNA,1 μl Oligo dT(0.5 μg/μl),1 μl M-MLV-RTase(200 U/μl),于42 ℃水浴反应1 h,70 ℃水浴10 min获取cDNA。内参基因和目的基因引物由吉凯基因设计和合成(上下游引物信息见表1,GAPDH为内参引物)。③PCR反应:以同一cDNA为模板,在20 μl反应体系内扩增。反应条件:95 ℃预变性5 min后,95 ℃ 50 s,55 ℃ 1 min,72 ℃ 1 min,循环35次,最后72 ℃延伸7 min。取5 μl PCR产物于1.8%琼脂糖凝胶电泳(80 V,30 min),凝胶成像仪分析RT-PCR产物带的积分吸光度值。用XRCC5/GAPDH扩增量表示细胞的相对表达水平(Ku80亚单位由XRCC5编码,故Ku80又称XRCC5)。

表1 目的基因与内参基因的上下游引物序列Table 1 Upstream and downstream primer sequences of the target gene and the internal reference gene
1.2.2 CRISP/CAS9系统慢病毒包装 由上海吉凯基因有限公司设计三条小向导RNA(small guide RNA,sgRNA)靶点序列。根据目的基因设计的sgRNA序列分别为:5′-GTCATAAGCATATCGAACTA-3′,5′-TCATATCAAGCATAACTATG-3′及5′-GGTTCAGAGAAGATTCTTCA-3′,根据sgRNA序列设计PCR引物,以基因组为模板扩增,对产物进行PCR测序。结果显示:sgRNA处不存在单核苷酸多态性(SNP)位点,可进行细胞感染。CRISP/CAS9系统(购买自上海吉凯基因有限公司)慢病毒包装由上海吉凯基因有限公司完成并测序验证。
1.2.3 细胞感染 ①培养状态良好的K1及B-CPAP细胞铺板(6孔板),进行Puromycin抗体标记的Cas9-Puro慢病毒感染。K1细胞实验用病毒滴度为2×108TU/ml,病毒用量10 μl;感染条件为Eni.S+polybrene(Enhanced Infection Solution+polybrene,感染增强剂和助感染试剂),感染复数(MOI)为10,感染后16 h换液,72 h拍照。感染后72 h加入Puromycin处理(Puromycin工作终浓度为4.00 μg/ml,维持浓度2.00 μg/ml)筛选。B-CPAP细胞实验用病毒滴度为2×108TU/ml,病毒用量5 μl;感染条件为Eni.S+polybrene,MOI为5,感染后16 h换液,72 h拍照。感染后72 h加入Puromycin处理(Puromycin工作终浓度2.00 μg/ml,维持浓度1.00 μg/ml)筛选。筛选后得到稳定表达CAS9的混合克隆细胞株:CAS9-K1及CAS9-B-CPAP。②培养状态良好的稳定表达CAS9的CAS9-K1及CAS9-B-CPAP细胞铺板,进行LV-Ku80-sgRNA慢病毒感染。CAS9-K1细胞实验用病毒滴度为1×109TU/ml,病毒用量1 μl;感染条件为Eni.S+polybrene,MOI为10,感染后16 h换液,72 h拍照。CAS9-B-CPAP实验用病毒滴度为3×108TU/ml,病毒用量3.3 μl;感染条件为Eni.S+polybrene,MOI为5,感染后16 h换液,72 h拍照。
1.2.4 Cruiser酶切检测CAS9-sgRNA活性 收集培养状态良好的CRISPR/CAS9处理后的细胞株K1及B-CPAP(感染7 d后收集细胞检测),用基因组DNA提取试剂盒抽提样品基因组,按照设计的PCR扩增引物(包含切割靶点),在50 μl反应体系中(上、下游引物各1 μl,2×Taq Plus Master Mix 25 μl,Genomic DNA 2 μl,ddH2O21 μl)进行PCR反应(95 ℃ 2 min变性,95 ℃ 20 S,75 ℃ 20 S,72 ℃ 30 S,35循环扩增,72 ℃ 5 min延伸,95 ℃ 5 min变性),获得杂交DNA产物。在灭菌PCR管中配置10 μl反应体系(PCR产物2-3 μl,Detecase Buffer 2 μl,Detecase 1 μl,Add ddH2O至10 μl),45 ℃反应20 min后,立即向上述10 μl体系内加入2 μl终止液,然后进行2%琼脂糖凝胶电泳。
1.2.5 全自动蛋白质印迹定量分析系统检测经CRISPR/CAS9处理后K1细胞中Ku80蛋白表达 收集生长状态良好的感染后K1细胞,提取总蛋白,测定蛋白浓度。将稀释的抗体,稀释变性的蛋白样本及其他试剂按设定程序加入板中,使用全自动蛋白质印迹定量分析系统(WES)检测K1-Cas9稳定株细胞中Ku80的蛋白表达量。蛋白上样量1 μg,一抗兔抗人Ku80抗体稀释比例为1 ∶300。使用普诺森二抗兔IgG试剂盒。目的条带83 kD。检测结果经Compass软件进行灰度分析。
1.2.6 qPCR检测经CRISPR/CAS9处理后B-CPAP细胞中Ku80相关mRNA的表达丰度 收集培养状态良好的CRISPR/CAS9处理后细胞B-CPAP,提取RNA,并反转录成cDNA。采用real time PCR方法检测Ku80相关mRNA的表达情况,内参基因GAPDH,引物由吉凯基因设计和合成。
1.2.7 MTT法检测Ku80敲减对细胞增殖能力的影响 将处于对数生长期的实验组(KO)、阴性对照组(NC)、空病毒组(CON)三组细胞胰酶消化,重悬成细胞悬液并计数,接种5张96孔板。接种细胞数2 000个/孔,每组3孔。放入细胞培养箱中培养。培养终止前4 h加入20 μl 5 mg/ml的MTT于孔中,4 h后完全吸去培养液,加入100 μl DMSO。振荡器振荡2-5 min,酶标仪490/570 nm检测OD值(在进行细胞MTT实验中,一般以490 nm为检测波长,570 nm为参考波长,两者吸收光之差可以消除非特异波长,故以此来表示)。获取K1及B-CPAP细胞随时间变化(1-5 d)的OD490值及OD490变化倍数,绘制时间-效应曲线。
1.2.8 Ku80敲减对细胞侵袭的影响 使用Corning侵袭试剂盒,按照试剂盒说明书操作,准备侵袭小室,接种细胞(细胞数为50 000/孔)至小室。培养体系为24孔板,内室500 μl/孔,外室750 μl/孔。实验分实验组KO、阴性对照组NC、空病毒感染组MOCK组三组,每组3孔。37 ℃培养箱培养16 h。Giemsa染色,晾干。显微镜拍照、随机选取5个镜下视野计数、进行数据分析。
1.2.9 细胞克隆形成实验 将处于对数生长期的各组细胞胰酶消化,分组同1.2.8侵袭实验,重悬成细胞悬液接种于6孔板中,在培养箱中持续培养13 d,荧光显微镜下照相,多聚甲醛固定细胞,PBS洗涤,Giemsa染色,晾干,数码相机拍照,显微镜(低倍镜)计数大于10个细胞的克隆数,最后计算克隆形成率。克隆形成率=克隆数/接种细胞数×100%,两组细胞克隆形成率以配对样本的秩和检验作统计分析;P<0.05视为差异有统计学意义。
1.2.10 细胞凋亡检测 实验分三组进行,分组同1.2.8侵袭实验,当6孔板细胞生长至覆盖率约为85%时药物诱导凋亡,若为贴壁细胞,则上清中细胞也需收集。胰酶消化,完全培养基重悬成细胞悬液,与上清细胞收集于同一5 ml离心管中,每组设三个复孔,若为悬浮细胞,直接收集。1 300 r/min离心5 min,弃上清,4 ℃预冷的D-Hanks(pH=7.2-7.4)洗涤细胞沉淀。1×binding buffer洗涤细胞沉淀一次,1 300 r/min、3 min离心,收集细胞。200 μl 1×binding buffer重悬细胞沉淀。加入10 μl Annexin V-APC染色,室温避光10-15 min。根据细胞量,补加400-800 μl 1×binding buffer,上机检测。
2 结果
2.1 RT-PCR技术检测Ku80 mRNA分别在K1、B-CPAP细胞中的表达
RT-PCR技术定量检测Ku80 mRNA在不同细胞中的表达丰度。通过溶解曲线分析,结果均为单一峰,说明PCR扩增特异性较好,样本3次重复试验数据的重复性较好。从定量PCR结果可以看出,Ku80基因在两株细胞中的表达丰度均为高丰度(见图1)。
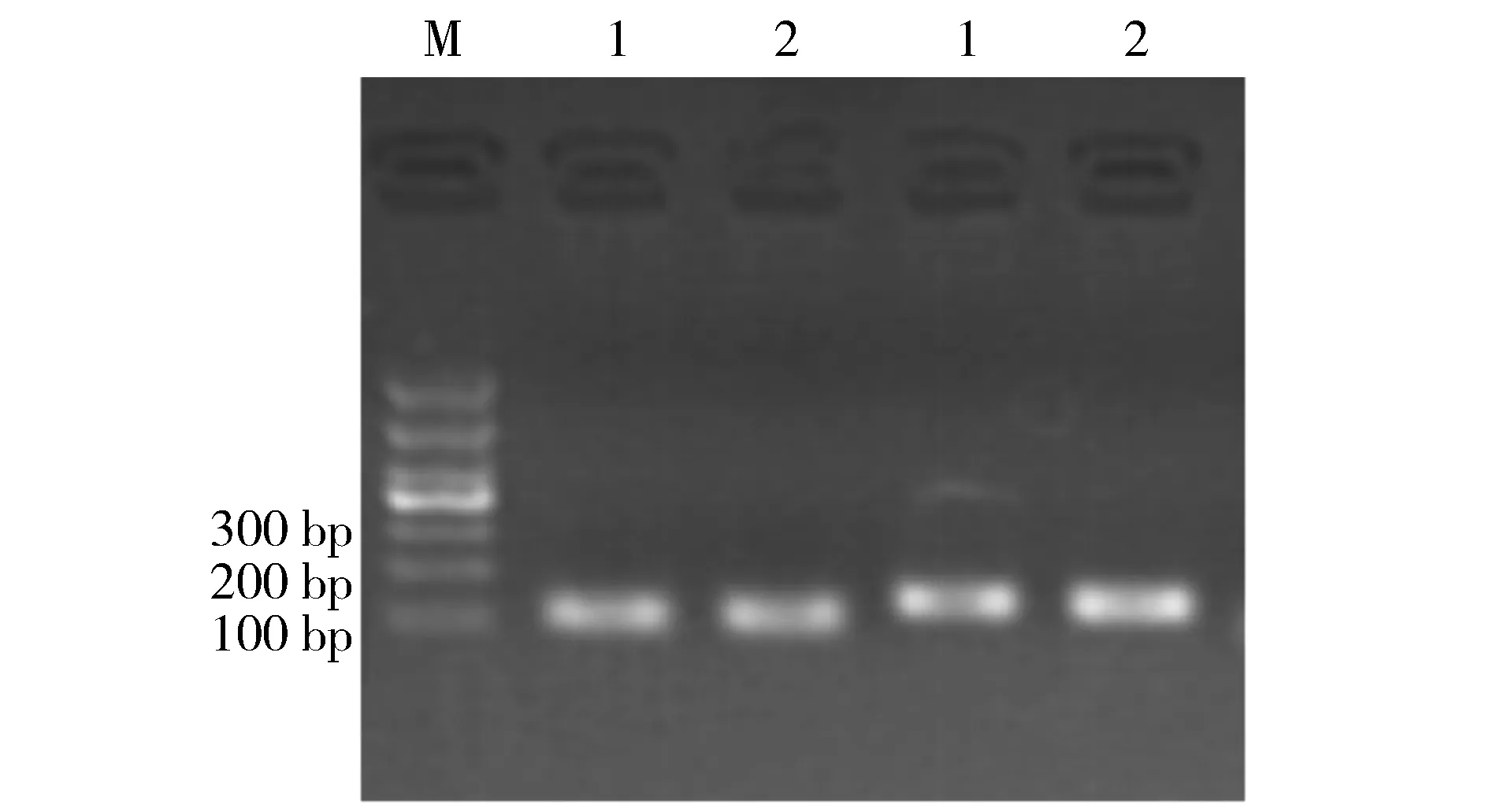
1.K1细胞株; 2.B-CPAP细胞株; M.DNA Marker DL 1000(TAKARA,Code No. D526A)
2.2 应用CRISP/CAS9系统感染K1及B-CPAP细胞后对Ku80表达的影响
K1及B-CPAP细胞铺板,进行Puromycin抗体标记的Cas9-Puro慢病毒感染后,筛选后得到稳定表达CAS9的混合克隆细胞株,继续进行LV-XRCC5-sgRNA慢病毒感染。通过Cruiser酶切检测CAS9-sgRNA活性可以看出K1-cas9-稳定株实验组所对应的KO1、KO2、KO3靶点及B-CPAP-cas9-稳定株实验组对应的KO靶点(与K1细胞中KO1序列一致)均检测出活性,靶点序列如1.2.2所示。结果提示稳定表达CAS9及LV-XRCC5-sgRNA的慢病毒感染成功(见图2)。
2.3 CRISPR/CAS9处理后K1细胞及B-CPAP细胞中Ku80表达水平测定
检测结果经Compass软件进行灰度分析,发现在K1-Cas9稳定株细胞中Ku80表达量相对于对照组显著降低,差异有统计学意义(P<0.05)。qPCR检测CRISPR/CAS9系统处理后B-CPAP细胞中Ku80mRNA的表达丰度,结果显示:B-CPAP细胞中,实验组Ku80mRNA表达水平是对照组的0.443倍,差异有统计学意义(P<0.05),可进行基因敲减后的功能试验研究(见图3)。
2.4 Ku80敲减后对K1、B-CPAP细胞增殖、凋亡、侵袭及克隆形成的影响
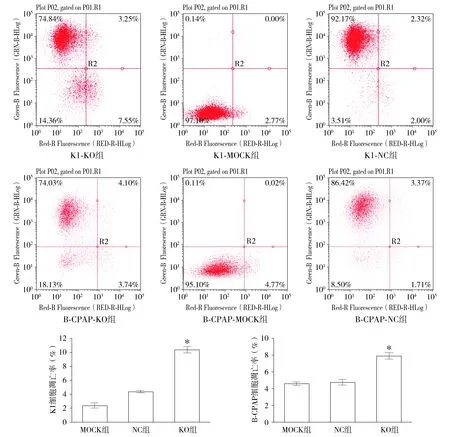
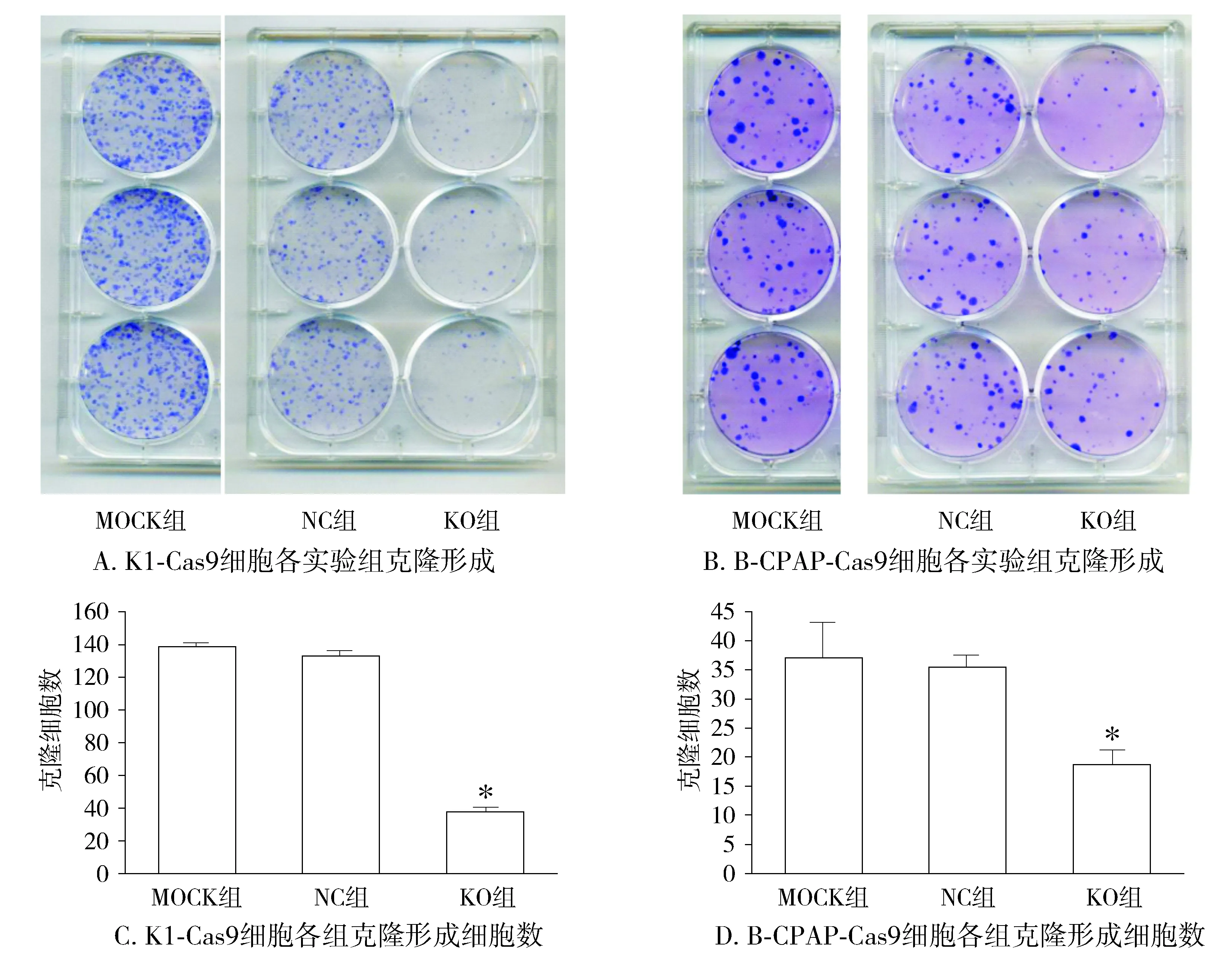
Cas9病毒与sgRNA病毒共同感染目的细胞后,K1细胞,实验组(KO)细胞第5天增殖活力及侵袭细胞数量,较对照组均显著降低,差异具有统计学意义(P<0.05);而B-CPAP细胞,实验组(KO)细胞第5天增殖活力及侵袭细胞数量较对照组(NC)呈下降趋势,但无统计学差异(见图4,5)。细胞凋亡检测结果显示,K1细胞KO组细胞凋亡较对照组显著升高[(10.38±0.42)%vs(2.41±0.33)%];B-CPAP细胞KO组细胞凋亡数较对照组显著升高[(7.91±0.34)%vs(4.61±0.17)%];两株细胞凋亡差异均具有统计学意义(P<0.05,见图6)。克隆形成实验结果显示:相比对照组,实验组敲减Ku80表达的K1、B-CPAP细胞克隆形成细胞数量均显著降低,差异具有统计学意义(P<0.05,见图7)。
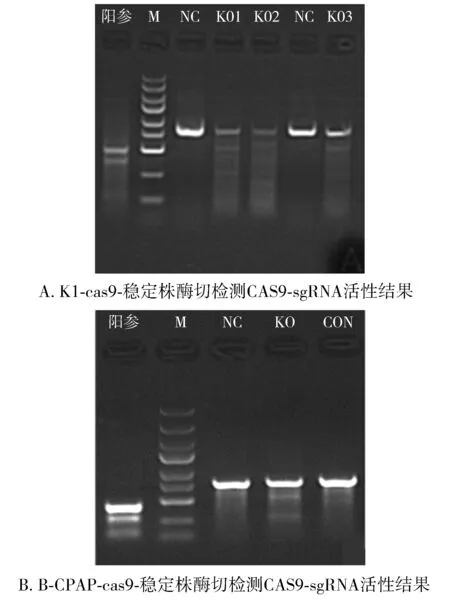
M. DL2502 Ladder Marker(条带从小到大分别为100,250,500,750,1 000,1 500,2 000,3 000,5 000 bp);KO1-3.实验组对应的3个靶点;KO.实验组对应的1个靶点;NC.各实验组对应的阴性对照;CON.实验组对应的空细胞对照;阳参:扩增片段大小为493 bp,酶切片段大小分别为122 bp、371 bp
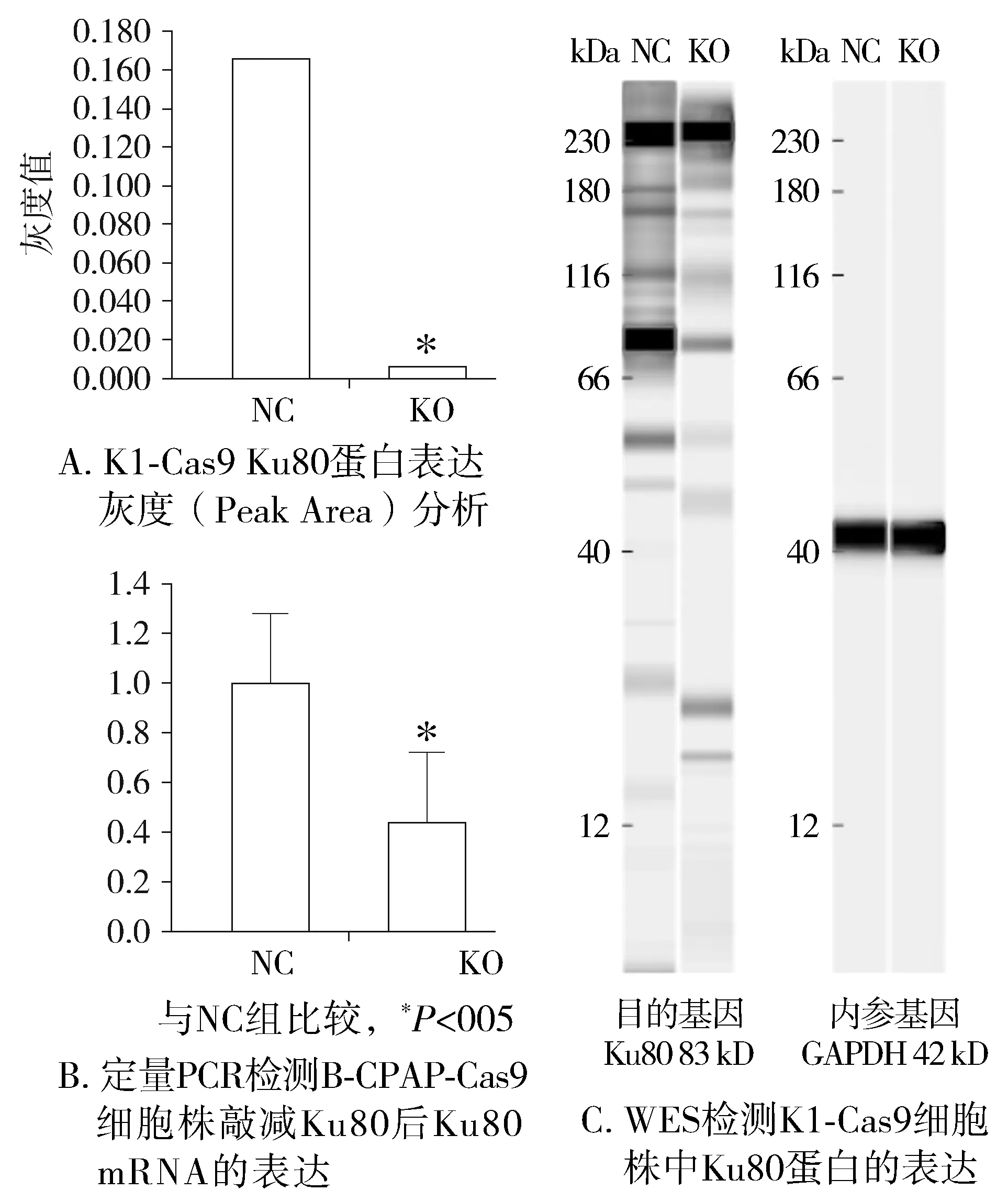
图3 CRISPR/CAS9处理K1细胞及B-CPAP细胞后Ku80敲减效率测定Figure 3 Ku80 knockdown efficiency in K1 cells and B-CPAP cells after treatment by CRISPR/CAS9
3 讨论
乳头状甲状腺癌(PTC)是最常见的内分泌系统恶性肿瘤。过去20年来,由于对偶发结节的检测技术得到改善,PTC的发病率在全球范围内稳步上升。PTC占所有甲状腺癌的80%-85%,且很大程度上可以治愈,其5年生存率为98%[8]。然而,5%-20%的病例发生疾病复发,并且是患者死亡的重要原因。因此,在初次确诊PTC时,风险评估和进展性预测非常重要[9,10]。
分子生物标志物因其在PTC中的诊断和预后标志物的潜在用途而被广泛认可。Ku蛋白是由Ku80与Ku70两亚基紧密结合形成的异二聚体结构,在DNA末端具有丝氨酸-苏氨酸激酶活性,能激活相关蛋白表达。在电离辐射造成的双链DNA断裂(DSBs)的同源末端结合和非同源末端结合修复途径中发挥重要作用[11,12]。研究发现Ku蛋白表达存在一种精细的平衡,Ku蛋白的过度表达促进致癌基因表型,包括高增殖和抗凋亡性[13],然而表达不足或低表达Ku蛋白会导致基因不稳定和肿瘤的形成[14]。有研究表明Ku80可以作为黏附分子并在细胞黏附、迁移和侵袭中发挥作用[15,16]。此外,谭卉妍等[17]的研究表明,Ku80具有多种生物活性,参与DNA转录调节,可独立参与细胞抗凋亡,并且在治疗前列腺癌中,沉默Ku80的表达,可以显著提高细胞对放疗的敏感性。严姗姗等[18]通过回顾性分析223例鼻咽癌患者组织标本中Ku80表达与临床病理特征相关性提示,Ku80的表达与肿瘤N分期、M分期有关,这说明Ku80可能与鼻咽癌的转移行为相关。Ku作为转录调节剂通过与重组信号结合蛋白Jκ和核因子NF-κB p50同二聚体相互作用而上调p50的表达,可能调节胃癌细胞的增殖[19]。
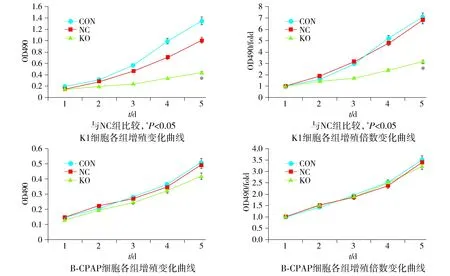
图4 K1及B-CPAP细胞增殖变化曲线Figure 4 K1 and B-CPAP cell proliferation curve
与NC组比较,*P<0.05
与NC组比较,*P<0.05
本课题组前期研究已经发现Ku80在PTC癌组织中较正常癌旁组织呈高表达,且与肿瘤TNM分期有一定的相关性。与其他肿瘤中Ku表达研究结果一致,为了更进一步探究Ku80在甲状腺乳头状癌中的具体功能,我们采用CRISPR/CAS9技术,敲减甲状腺乳头状癌细胞中的Ku80表达,通过MTT、细胞凋亡、细胞侵袭及克隆形成实验发现,抑制Ku80表达,K1肿瘤细胞增殖、侵袭及克隆形成数目均显著降低,且可有效诱导细胞凋亡。虽然在MTT实验及细胞侵袭实验中B-CPAP细胞的增殖活力和侵袭率与对照组相比并无差异,但是整体趋势是细胞的增殖和侵袭能力受到抑制;为此,我们考虑到Ku80在细胞中表达丰度极高,CRISPR/CASE9技术敲减后B-CPAP细胞Ku80的敲减效率仅达到55.7%,仍有一定量的Ku80发挥作用,因此对B-CPAP细胞增殖、侵袭功能无显著影响。总体来说,此研究结果提示Ku80过表达可能在PTC的发生、发展中起到促进作用。
癌症的发生是一个复杂的过程,某种通路中相关基因的突变或者异位等均可导致肿瘤细胞的增殖与凋亡,常见的基因突变包括BRAF、RET、RAS、PTEN等,基因易位如RET/PTC等[20]。为此,本课题下一步拟通过检测RET、NF-κB等在PTC组织中的表达来进一步研究其与Ku80蛋白在甲状腺乳头状癌发生、发展中具体通过哪些信号通路发挥作用。以相关靶基因为目的基因是目前甲状腺乳头状癌精准治疗和个体化治疗的关键所在,本研究发现,PTC癌组织Ku80阳性表达率高于癌旁组织,Ku80表达下调可抑制肿瘤细胞的增殖、侵袭和克隆形成能力,诱导细胞凋亡。但其具体的作用机制仍有待于进一步的研究。

