二花脸猪卵巢卵泡发育过程中可溶性鸟苷酸环化酶和一氧化氮合酶活性变化及其定位
丁 威, 邢 军, 周燕芬, 刘 晨, 魏全伟, 石放雄
(1.江苏农林职业技术学院,江苏句容 212400; 2.南京农业大学动物科技学院,江苏南京 210095;3.江苏省农业科学院,江苏南京 210014)
哺乳动物的卵巢是其生殖系统中的重要功能器官,主要包含卵泡、黄体。随着卵泡的发育、闭锁,颗粒细胞合成雌激素(E2)的功能发生明显改变,而排卵后形成的黄体及黄体退化,进一步形成了孕酮的周期性变化,在这个过程中卵巢周期性变化又受到下丘脑-垂体-性腺轴的精准调控。除此以外,卵泡的形成和发育又受到胰岛素样生长因子(IGF-1)、锌指转录因子4(GATA4)、叉头转录因子1(foxo1)等多种因子的影响。研究表明,明星分子一氧化氮(NO)作为细胞间的信使,在卵泡发育及其生成类固醇激素等过程中发挥重要的调节作用[1-3]。在动物体内,一氧化氮合酶(nitric oxide synthase,简称NOS)的主要功能是催化精氨酸分解生成NO,同时生成L-瓜氨酸。而NOS又是合成NO的限速酶,在调控NO合成过程中发挥关键作用。根据NOS对Ca2+的依赖性可将其分为2种类型:Ca2+依赖型[nNOS(neuronal nitric oxide synthase)、eNOS(endothelial nitric oxide synthase)]和非Ca2+依赖型[iNOS(inducible nitric oxide synthesis)],而从结构和功能上可将其分为3种构型:神经型(nNOS)、诱导型(iNOS)、内皮型(eNOS),其中iNOS主要在巨噬细胞、嗜中性白细胞、内皮细胞及上皮细胞中表达[4-5];nNOS主要在脑组织中表达,它是第1个被纯化和克隆的同工酶[6-7];eNOS基因在各种属之间进化保守,且主要在血管内皮细胞中检测到表达[8]。Stuehr等研究表明,多种细胞因子能够改变iNOS在体内的生物学活性[9]。
在小鼠、大鼠、猪等动物的生殖系统中,研究人员对NOS进行了大量的研究[10-13]。Mitchell等在小鼠的卵母细胞、颗粒细胞以及膜细胞中均检测到iNOS、eNOS的表达[14]。笔者所在实验室前期研究结果表明,在卵母细胞中均检测到NOS3种亚型的表达,且随着卵泡的发育,NOS的表达量逐渐增加[15]。此外,也有相关研究报道,在卵巢的各类细胞中检测到eNOS表达[16]。而仅在卵泡的颗粒细胞和黄体细胞中检测到iNOS的表达[1,17-19]。nNOS在神经系统和非神经系统等的细胞和组织中均有表达[20-22]。在猪卵巢上已有一些关于NOS的研究,但先前的研究结果并不一致[11,19,23-25]。目前,关于NOS在猪卵巢组织中的表达缺乏系统性的研究,而在早期卵巢形成和发育过程中,特别是关于胎儿期和出生期胎猪卵巢的NOS研究至今鲜有开展。
在细胞质中可溶性的鸟苷酸环化酶能够催化鸟苷三磷酸(guanosine triphosphate,简称GTP)转变为环鸟苷酸(guanosine 3′,5′-cyclic phosphate,简称cGMP),而生成的cGMP在卵巢生成类固醇激素、促性腺激素受体的表达、颗粒细胞凋亡、卵泡排卵等方面具有非常重要的作用[26-30]。可溶性的鸟苷酸环化酶(sGC)含有α、β亚基,其中α含有α1、α2异构结构,β含有β1、β2异构结构[31-32]。前期研究结果表明,sGCα、sGCβ在大鼠卵巢腔前卵泡中的表达较强,而在有腔卵泡中的表达强度减弱[15,33]。由此可见,sGC在卵巢卵泡形成和早期发育过程中起到一定的作用。然而,关于sGC在猪卵巢卵泡形成及发育过程中的研究鲜有报道。
1 材料与方法
1.1 试验动物
试验动物为性成熟、体质量接近的母猪,来自于南京农业大学试验猪场。试验动物依据二花脸饲养标准进行普通饲养,在其发情周期启始的24 h后进行人工授精,间隔12~24 h 复配1~2次,并将第1次配种日期记为怀孕0 d。选择胎70日龄(70 dpc)、胎90日龄(90 dpc)、新生1日龄(1 dpp)和生后120日龄(120 dpp)等4个日龄阶段的母猪各5头,其中前3个日龄阶段属于出生前期,第4个日龄阶段属于出生后期。采集一侧卵巢置于4%多聚甲醛(paraformaldehyde,简称PFA)中固定36~48 h,以备进行组织学分析;采集另一侧卵巢置于液氮中保存,用于酶活性测定。
1.2 试剂
3,3-二甲基联苯胺(3,3′-diaminobenzidine etrahydrochloride,简称DAB)、3-氨基-丙基三乙氧基硅烷(3-aminopropyltriethoxysilane,简称APES)、兔抗sGCα和兔抗sGCβ等来源于Sigma公司;兔多克隆抗体nNOS(BA0360)、iNOS(BA0362)、eNOS(BA0364)和羊抗兔IgG(BA1054)、NOS测定试剂盒、动物切片石蜡等均为国产试剂。
1.3 仪器
RM2235切片机(Leica)、HI1220烘片机(Leica)、YS100显微镜(Nikon)、iMark酶标仪(BioRad)、DHG-9073BS-III电热恒温鼓风干燥箱(上海新苗医疗器械制造有限公司)、2XZ-2真空泵(郑州长城科工贸有限公司)、DZF-6020真空干燥箱(上海新苗医疗器械制造有限公司)、KD-P展片机(浙江省金华市科迪仪器设备有限公司)、YD-6D包埋机(浙江省金华市科迪仪器设备有限公司)、TY-80S脱色摇床(南京大学)。
1.4 方法
1.4.1 免疫组化染色
脱蜡止水:二甲苯Ⅰ7 min→二甲苯Ⅱ7 min→100%乙醇Ⅰ 5 min→100%乙醇Ⅱ 5 min→90%乙醇5 min→70%乙醇 2 min→蒸馏水5 min;灭活内源酶:用3%甲醇-H2O2处理15 min→蒸馏水5 min;抗原热修复:柠檬酸三钠(pH值=6.0)100 ℃ 10 min→磷酸盐缓冲液(phasphate buffered saline,简称PBS)洗涤3次,每次3 min;加一抗:10%牛血清白蛋白(bovine serum albumin,简称BSA)室温封闭30 min→一抗加入后,须要在室温条件下过夜,阴性对照可用1% BSA代替(nNOS、iNOS、eNOS抗体稀释浓度为1 ∶100,sGCα、sGCβ抗体稀释浓度为1 ∶2 000) →PBS洗涤3次,每次3 min;链霉素亲和素-生物素复合物(strept avidin-biotin complex,简称SABC)反应:二抗加入后,须要在室温条件下30 min→PBS洗涤3次,每次3 min→加SABC,室温 15 min→PBS洗涤3次,每次3 min;显色:0.05% DAB+0.01% H2O2,显色2~10 min→流水冲洗5 min→苏木素复染→流水冲洗5 min;脱水透明:50%乙醇2 min→70%乙醇2 min→90%乙醇2 min→100%乙醇Ⅰ 2 min→100%乙醇Ⅱ 2 min→二甲苯Ⅰ 4 min→二甲苯Ⅱ 4 min;封片观察。
1.4.2 卵巢组织中的酶活性测定 NOS等活性测定方法参见笔者所在实验室前期研究方法[15],检测步骤参照操作说明。
1.5 数据统计
应用Microsoft Excel 2007对数据进行录入与处理,计算平均数、标准差等特征值;采用SPSS 19.0进行单因素方差分析,差异显著性检验采用Turkey检验法进行多重比较。
2 结果与分析
2.1 NOS在猪卵巢卵泡形成和发育过程中的表达
eNOS抗体免疫组化试验结果表明,eNOS在猪卵巢卵母细胞巢(图1-A、图1-B、图1-C)、各级卵泡卵母细胞(图1-D、图1-E)、卵巢表皮细胞(图1-B)和多层卵泡的颗粒细胞层及膜细胞层(图1-F、图1-G、图1-H)中均有表达,且在颗粒细胞、膜细胞中的表达随着卵泡的发育而增强。此外,eNOS在黄体(图1-I)中也有表达,对照组无表达(图1-J)。
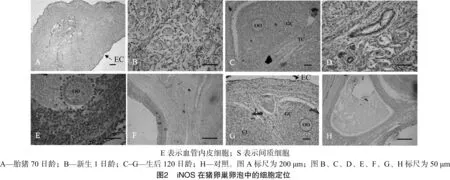
iNOS抗体免疫组化试验结果表明,iNOS在卵巢表皮细胞(图2-A、图2-G)、各级卵泡的卵母细胞(图2-B、图2-C、图2-E、图2-G)、卵母细胞透明带(图2-C、图2-G)、多层卵泡的颗粒细胞(图2-C、图2-E、图2-F、图2-G)、膜细胞(图2-C、图2-E、图2-F)、间质细胞(图2-F)、血管内皮细胞(图2-D)和黄体细胞(图2-G)中均有表达,但在单层卵泡的颗粒细胞层中未见表达,对照组无表达(图2-H)。
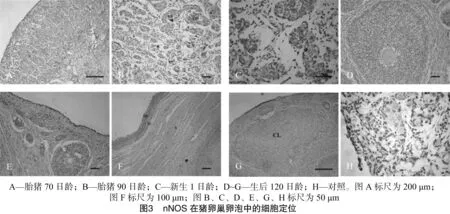
用抗nNOS抗体对猪卵巢组织进行免疫组织化学检测,结果表明,nNOS和eNOS的表达定位基本一致,具体情况见图3。
2.2 sGCα1和sGCβ1在猪卵泡形成和早期发育过程中的表达
sGCα1抗体免疫组化试验结果表明,sGCα1在腔前卵泡的颗粒细胞、卵巢组织血管内皮细胞、黄体细胞、卵母细胞巢中均有较强表达,在卵泡膜细胞中的表达较弱。sGCβ1的表达位置和程度与sGCα1基本一致,具体情况见图4。

2.3 卵巢中NOS活性测定
各日龄阶段猪卵巢中一氧化氮合酶活性的测定结果(图5)表明,在出生前期,随着日龄增加,卵巢中总NOS活性升高,胎70日龄组总NOS活性显著低于胎90日龄和新生1日龄组,新生1日龄组和胎90日龄组之间差异不显著,生后120日龄组显著低于出生前期各组;胎90日龄组卵巢中的eNOS活性显著高于其他组;新生1日龄组卵巢中的iNOS活性显著高于其他组;各组之间卵巢中的nNOS活性差异不显著,其中以胎70日龄最高,生后120日龄最低。


3 讨论
前期研究表明,NO、NOS在调控哺乳动物卵泡发育和卵巢功能过程中发挥重要的作用[10,34-38],本试验对胎猪和新生仔猪卵巢中的NOS、sGC表达与卵泡发育进行研究,结果表明,NOS和sGC在卵泡发育过程中呈细胞特异性表达。
本试验中,eNOS主要在卵泡颗粒细胞、卵泡膜细胞、卵母细胞中表达,同时还发现,在胎猪和新生仔猪的卵巢卵母细胞中有eNOS表达。Jablonka-Shariff等研究发现,在敲除eNOS基因的小鼠中,其卵巢有腔卵泡的数量和排卵率等指标下降显著[38]。综合上述结果表明,在猪早期卵巢卵泡的形成和发育过程中,eNOS发挥了重要的作用。此外,本试验中nNOS、iNOS、eNOS的表达定位基本一致,这与Kim等的试验结果[11]基本一致。而Matsumi等研究表明,在大鼠卵巢中,只有eNOS、iNOS表达,而未检测出nNOS[39],说明nNOS的表达存在种属差异性,但在猪卵巢中,nNOS和eNOS、iNOS都参与原始卵泡的形成及发育过程。
本试验中NOS活性测定结果表明,卵巢中总NOS活性,出生前期显著高于出生后120日龄,且从胎70日龄至新生1日龄阶段,有逐渐上升的趋势,说明NOS在出生前期卵巢内发挥更重要的调控作用;eNOS在胎猪90日龄的卵巢中表达量最高,结合此阶段为原始卵泡形成与发育的关键时期的特点进行分析,说明eNOS在参与响应卵巢原始卵泡的形成和原始卵泡的激活过程中发挥了重要的作用,但仍须深入研究其具体机制。检测结果发现,iNOS在新生1日龄的仔猪卵巢中表达量最高。而在哺乳动物细胞中,iNOS极易受到细胞因子等多种物质和外部环境的影响[9]。这可能是由于胎儿出生后,外部环境急剧改变,仔猪应激反应引起卵巢中iNOS表达升高。笔者所在实验室前期研究结果表明,新生卵巢组织中孕激素和雌激素的含量显著低于胎儿时期,iNOS的阶段特异性变化是否与激素含量等因素有关,还有待进一步研究。在本试验中nNOS的活性明显低于iNOS、eNOS,结合笔者所在实验室先前的研究结果,总NOS活性主要依赖于eNOS、iNOS等2种酶,而nNOS对总NOS活性的贡献较少[15]。由此可以推断,在猪卵巢卵泡形成和发育过程中起主要作用的NOS是eNOS、iNOS等2种类型。
NO通过激活sGC来提高细胞内的cGMP水平,以发挥多种生理作用[40]。细胞内的NO能够与sGC的二聚体结合,活化sGC,从而提高cGMP的产量[41]。本试验首次对sGCα1、sGCβ1在猪卵巢组织中的表达进行定位,结果表明,sGC在腔前卵泡的颗粒细胞、卵巢组织血管内皮细胞、黄体细胞、卵母细胞巢中均有较强表达,在卵泡膜细胞中的表达较弱,并随着卵泡的不断发育增大,颗粒细胞中sGCα1、sGCβ1的表达量下降,这一研究结果与笔者所在实验室前期在大鼠上获得的试验数据[15,33]是一致的。随着卵泡的持续增大,sGC表达量下降,其细胞内合成的cGMP量必定减少。这与前人关于NO、cGMP能够拮抗颗粒细胞成熟的研究结论[42-44]是相符的。综上所述,sGC能够调节早期卵泡的发育,且其表达水平与颗粒细胞增殖呈负相关关系。研究发现,NOS主要在早期卵泡的卵母细胞中高表达,而sGC主要在颗粒细胞中表达。由于NO是气体分子,作为生物信使具有很强的扩散性,可以自由通过临近细胞膜,从而发挥其调节作用,因此,虽然NOS主要在卵母细胞中表达,但其催化产生的NO可以通过气体扩散作用进入周围的颗粒细胞。

