植物根际促生细菌菌肥对新疆灰枣根际土壤解钾效果及其与有机酸的相关性
朱舒亮, 刘胜亮, 李 静, 杨 越, 杨文英, 李建贵
(1.新疆农业大学林业研究所,新疆乌鲁木齐 830052; 2.新疆农业大学/新疆红枣工程技术研究中心,新疆乌鲁木齐 830052;3.新疆农业大学2612团队,新疆乌鲁木齐 830052)
植物根际促生细菌(plant growth-promoting rhizobacteria,简称PGPR)是在植物根际系统定殖、能够明显促进植物生长或抑制病原菌活动的一类有益细菌的总称,具有普通土壤微生物的促进有机质分解与转化、养分循环和吸收等作用[1-5]。
目前大量研究表明,PGPR能够有效促进植物根部生长,为植物的生长提供营养需求。部分特定功能菌株通过生长代谢作用还可以活化微生物生态环境。植物对土壤有效营养成分的利用效率主要通过根部的生长和根表面积的增加来反映[6-8]。将PGPR制备的菌肥施入土壤后,在土壤微生物及土壤酶活性影响下能分泌产生大量有机酸,土壤pH值呈下降趋势,通过不断释放出土壤中的氮(N)、磷(P)、钾(K),不仅能够有效提高根系的抗逆性,还能改善土壤的理化性质[9]。因此,揭示以微生物、土壤、植物三者之间相互作用为核心内容的根际动态过程的作用机制,通过对根际生态系统的调控,提高水分、养分资源的利用效率,控制和减少环境污染,是提高作物产量和品质的一种新途径,也将是未来生态农业生产一个新的发展方向[10-12]。
目前,人们在解磷菌和固氮菌的相关应用技术上已经有了较为成熟的方法和经验,但在解钾菌方面的技术较为薄弱,而耕作层土壤中含有大量固定态的钾,随着科学技术的发展,人们越来越注重对增加土壤钾离子含量的需求。科学配比、合理施用钾肥,以及补充土壤中的钾素,已经成为农业领域研究的热点[13-15]。
由于新疆地区地理条件特殊,土地普遍盐碱成分含量较高,且新疆处于干旱半干旱地带,这对于目前已有的大部分菌肥与制剂在农业上的应用产生了制约。因为微生物普遍对于生存环境较敏感,且具有一定的专一性。由于针对新疆地区特殊环境土壤的解钾机制研究相对较少,所以,根据新疆地区独特的气候条件和土壤环境及灰枣的营养需求,加上对解钾细菌特性的了解,笔者用分离筛选的4株高效解钾菌进行田间试验,进一步分析菌株分泌的有机酸对释放土壤中速效钾的效果,不仅可以提高钾肥利用率,还能切实缓解我国对钾肥产生的供应与需求之间的矛盾,改良盐碱地土壤肥力,保障农业生产,维持作物高产,降低对化肥的使用量与对环境的污染性,进而保护我国农业生态环境,对发展有机、生态、低碳农业,以及保证粮食安全具有极其深远的意义。
1 材料与方法
1.1 试验材料
1.1.1 试验地概况 新疆库尔勒位于我国西北地区(地理位置85°12′~86°27′E,41°14′~42°14′N),由霍拉山、天山形成了库尔勒的北部屏障,南部为著名的塔克拉玛干沙漠,可谓地理位置险峻,是连接南北疆的枢纽。库尔勒地区属于温带大陆性气候,光照条件充足,早晚温差较大,且降水量稀少,该地区适合喜温植物的种植生长。
试验地位于库尔勒市东北方位25 km处的新疆农业大学林业研究所博湖南山试验基地枣树果园中,土壤质地为沙壤土,日照时数为2 990 h,年平均降水量为58.6 mm,年平均温度为12.1 ℃,土壤碱解氮含量为33.36 mg/kg,速效磷含量为16.34 mg/fig,速效钾含量为55.36 mg/kg。土壤结构较为多样,其中沙壤土杂质较多,有机物、P、K含量普遍不高。
1.1.2 供试菌株 本田间试验供试菌株为新疆农业大学林业研究所微生物实验室经筛选得出的解钾能力较强的解钾菌4株:K3、K7、K11、K24。
1.1.3 供试作物 供试果树为六年生灰枣树,并选择东西方向种植,且树龄、树干直径、树形一致的作为试验处理小区样株,样株的种植密度(株行距)为1.5 m×2.5 m。
1.1.4 室内扩繁培养 牛肉膏蛋白胨培养基配方:3.0 g牛肉膏,10.0 g蛋白胨,5.0 g NaCl,18.0 g琼脂,pH值为7.0~7.2,1 000 mL蒸馏水。
对于经过分离鉴定的解钾菌株,取冷冻保存的菌种,经过复苏活化,在无抗平板上划线,重复3次,于恒温培养箱培养24 h后,挑选培养皿内培育的优势单菌落接种于牛肉膏蛋白胨液体培养基中,在30 ℃、180 r/min环境中扩繁培养,扩繁培养在室内无菌条件下进行。
1.2 田间试验设计
1.2.1 田间试验设计 本试验采取随机区组的试验方法,以保证试验的可靠性,共设置3个处理,处理1:各供试菌剂(K3、K7、K11、K24)+基肥;处理2:未接菌空白培养基+基肥;处理3:清水+基肥。2个对照为CK1(空白培养基)与CK0(清水空白)。
1.2.2 试验小区及重复设计 试验成年果树选择树龄相同、果树株形与产量相对一致,且土壤地力差异性相对较小的果园地块,共有6个处理,分别为处理1(K3菌株)、处理2(K7菌株)、处理3(K11)、处理4(K24菌株)、处理5(空白培养基对照)、处理6(清水空白对照)。每个处理各设3个平行试验小区,每个小区各种4株果树,合计18个试验小区,共72株灰枣果树,各个处理区组采用长方形随机排列,最好做到单灌单排,避免边际效应和各个处理间的相互影响。
1.2.3 灌根及回收采集 本试验于2016年4月底在灰枣果园中进行,各处理菌液采用穴施法按200 mL/株浇施,浇施前用清水将原液稀释到1 000 mL,施入枣树正东方向(距树干10~15 cm,土层深度为30 cm),空白对照处理加入无菌空白液体培养基,而清水对照加等量清水。施菌后0、30、60、90、120 d采集土壤样品,并将回收后的土壤风干,进行速效养分含量的测定。
1.3 土壤养分测定
对于试验用地取回的土样,土壤微生物相关测定选用新鲜土样,其他一般分析项目都采用风干土样。
1.3.1 土壤活菌数的测定 在本试验中用稀释平板法进行活菌数量的测定,虽然可以测定根际土壤中的活菌数量,但是因为田间试验具有较多不可控性并受诸多因素制约,单纯地使用计数结果不能准确无误地反映微生物的实际数量,因此,为了降低测定的误差,对于采集的土壤样品稀释液每次都需要经过充分的振荡以保证混匀[16]。
在无菌环境下取根际土壤并称量(10 g)后,一同溶于装有90 mL无菌水的三角瓶中,于28 ℃恒温振荡30 min,使微生物细胞充分分散。取0.5 mL 10-1稀释液与4.5 mL无菌水混匀,即得10-2稀释液;再取0.5 mL 10-2稀释液与4.5 mL无菌水混匀,即得10-3稀释液,将所制备的稀释液均匀地涂布在含有利福平(300 μg/mL)的牛肉膏蛋白胨平板上,重复3次。在恒温培养箱中于28 ℃培养2 d后进行计数,培养结束后取出培养平板,对各个试验组的菌株发育情况进行统计分析,对相同浓度培养皿上的有效菌落数量进行计数。
1.3.2 土壤速效钾含量的测定 土壤速效钾含量测定方法:将采集的土样风干后,经1 mm筛孔过滤后称5 g土样,倒入浸提瓶中,加1 mol/L乙酸铵溶液定容至50 mL,给浸提瓶口封膜加盖后,于水浴恒温振荡器中振荡30 min,用干滤纸进行杂质过滤,将滤液提取至试管中,各处理重复3次,使用火焰光度计测定速效钾含量。
1.3.3 土壤有机酸含量的测定 土壤有机酸含量测定采用高效液相色谱法(HPLC),用U3000高效液相色谱仪测定,色谱条件:C18色谱柱,250 mm×4.6 mm;流动相:99% 0.02 moL/L KH2PO4和1%甲醇(用H3PO4调节pH值至 2.6),流速:0.5 mL/min,进样量:20 μL;柱温:30 ℃。样品处理:取10 mL发酵液样品于离心管中,在离心机中于 4 000 r/min 离心10 min,离心后经0.22 μm滤膜过滤,将滤液在超声波清洗器上振荡后,测定有机酸含量,重复3次。因有机酸分泌有时间的滞后性,所以施菌后1d开始采样检测灰枣根际土壤内有机酸含量。
1.3.4 土壤pH值的测定 土壤pH值的测定方法:将采集的土样风干后经1 mm筛孔过滤,称取 20 g 土样,倒入浸提瓶中,加入蒸馏水定容至50 mL,于水浴恒温振荡器上振荡 3 min,用酸度计测定pH值,重复3次。
1.4 数据分析
试验数据整理使用Excel 2003,数据分析采用SPSS 19.0。
2 结果与讨论
2.1 不同浓度有机酸对矿物钾释放的影响
土壤的肥力与土壤供给植物生长发育的营养元素都与土壤养分有着直接关系[17-18]。在研究不同菌剂对灰枣根际土壤微生物数量的影响中,测得的土壤微生物菌落数是1个生长周期的平均值。由表1可以看出,微生物菌株处理组在刚浇灌菌液(0 d)时,菌落数在1.0×1010CFU/g以上;在浇灌菌液30 d时,菌落数量降至1.0×107CFU/g以下;在浇灌菌液60~90 d时,菌落数维持在1.0×108CFU/g数量级,可见菌落数量变化不大,但4株菌株具有不同强弱的定殖效果;到浇灌菌液120 d时,菌落数量略有下降。其中K7菌株制备的菌液对土壤中的微生物数量具有较为平稳和较强的增益效果,其他几种处理菌有不同程度的表现。
2.2 PGPR对灰枣根际土壤中有机酸含量的影响
采用高效液相色谱法测定混合有机酸的标样,从而对土壤中有机酸含量进行测定。由表2可以看出,不同菌肥施菌后经过1 d分泌有机酸,与清水对照处理(CK0)对比后可以看出,施菌前土壤中的有机酸含量与施菌后无明显差异,土样中基本没有检测出有机酸含量;在施菌液30 d时,3种有机酸含量多数到达分泌的峰值, 土壤中丙酮酸的含量变化较为明显,其中K7菌株的丙酮酸浓度达4.018 mg/kg,乙酸与柠檬酸在部分处理下均有增加,在随后的60 d时逐渐下降,在90、120 d时趋于平稳。说明土壤中分泌有机酸是有一个动态的变化趋势的,与速效钾含量变化趋势相结合分析,说明土壤中的有机酸含量对含钾矿物产生溶解释放作用,并增加了土壤中植物可吸收利用的速效钾含量。

表1 根际土壤微生物菌落计数

表2 根际土壤中的有机酸含量
2.3 PGPR对灰枣根际土壤中速效钾含量的影响
由表3可知,在施入菌液1 d后,各菌剂处理组土壤中的速效钾含量均高于对照组且与CK0之间差异显著(P<0.05),其中K3菌株的速效钾含量达到了112.75 mg/kg,比清水对照的速效钾含量高 45.2 mg/kg,各处理速效钾含量比清水对照高40.39%~66.91%。在施入菌液30、60 d时,各处理土壤中的速效钾含量均不同程度地高于对照,其中K7、K24菌株对土壤中速效钾含量提升效果显著;在施入菌液90 d 时,K3菌株速效钾含量最高,其余菌株处理土壤中的速效钾含量趋于平稳,并接近对照。
观察土壤中活菌数量可知,虽然活菌数量已有下降趋势,但土壤中的PGPR仍具有一定的解钾效用,因此可见,试验土壤中的速效钾含量并没有随着活菌数的减少而下降,而且还有部分小区出现了速效钾含量提高的现象。到施用菌液 120 d 时,随着果实成熟期的到来,果实细胞分化,果实体积逐渐增大,土壤中的速效钾逐渐流入枣果中,此时土壤中的速效钾含量降低。说明在一定程度上,施用微生物菌液可以提高土壤中速效钾的供给能力,施菌后1 d K24菌株对速效钾含量的提升能力最佳,较CK0含量高37.24 mg/kg。
2.4 PGPR对灰枣根际土壤中pH值的影响
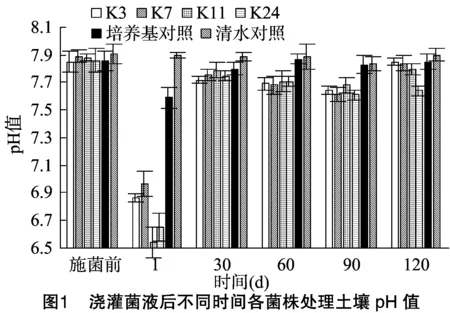
由图1可以看出,土壤中的pH值随着时间的推进有一个动态的变化趋势,因为菌株在发酵液中分泌有机酸,使得菌液pH值呈酸性,在施菌后1 d的土壤中的pH值最低。并且空白对照培养基的pH值初始为7.0~7.2,所以对比清水对照,也有一定差异。在30 d时,土壤中pH值提高,说明根际土壤吸收PGPR菌肥,相比CK产生一定的差异,在施菌后60、90 d时,pH值开始逐渐下降,其中K24菌株处理土壤pH值的变化明显。在施菌后120 d时,pH值有所升高,说明PGPR经过生长代谢产物,改善了盐碱土地的酸碱度,作用于生长期内,但是随着时间的变化,PGPR对土壤中pH值的改良功效有所减弱。
3 结论
本研究将制备的微生物菌液进行田间试验,定期采样并测定土壤中的速效钾含量与有机酸种类、含量,进一步分析有机酸对转换土壤中钾离子形态的作用。主要研究结果如下:
(1)通过对统计结果的分析可知,不同菌剂处理微生物菌落数量均高于清水对照,在施菌后明显高于清水对照,之后进入一个动态变化过程,其中K7菌株制备的菌液对土壤中微生物数量具有提高且平稳的效果。
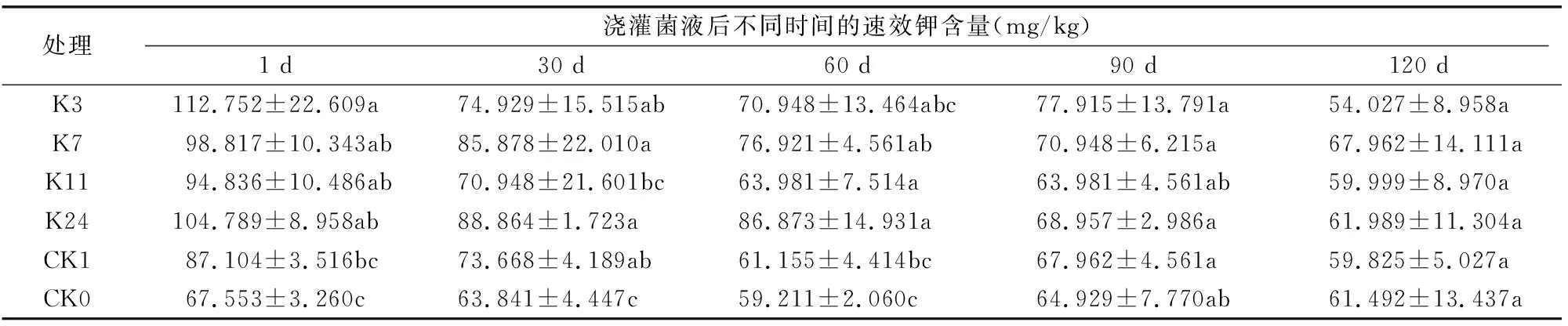
表3 不同处理根际土壤中的速效钾含量
注:同列数据后标有不同小写字母表示差异显著(P<0.05)。
(2)通过前期对有机酸标样的测定,定期采样检测土样后发现,因为田间试验的不可控因素过多,有机酸含量普遍偏低,提取其中含量高的3种有机酸——丙酮酸、乙酸、柠檬酸进行动态跟踪。3种有机酸含量多数在施菌后30 d时达到最高值,随后逐渐下降并趋于平稳。其中丙酮酸中K7菌株处理的浓度在施菌后30 d时最高,达4.018 mg/kg。
(3)不同菌剂施入后的土壤都具有提高土壤中钾离子释放量的作用,速效钾含量均明显高于对照,其中K3菌株处理的土壤中速效钾含量达到了112.75 mg/kg,比CK0的速效钾含量高45.2 mg/kg,不同菌株处理的速效钾含量比CK0提高了40.39%~66.91%。K7、K24菌株处理与对照相比,在30、60 d时对土壤中速效钾含量的提升效果明显,K24菌株处理对土壤中矿物钾的释钾能力最佳,施菌后1 d较清水对照含量高37.24 mg/kg。K3菌株处理在90 d时解钾量最高,随后降低并趋于平稳。
4 讨论
本研究结果表明,经过1个生长期内的动态测定,施用PGPR菌肥处理使得枣树根际土壤中的速效钾含量、有机酸含量、微生物数量比只施用常规化肥的对照明显提高,但是由于田间试验的不可控性,有机酸的含量普遍偏低。土壤中接种PGPR可以显著地改善作物的钾素营养,释放生长养分,改良土壤品质,调节土壤生态系统平衡[19-21],其解钾作用与生长代谢过程中所产生的有机酸种类与含量密切相关。因为不同解钾菌株特性存在差异,导致在生长代谢过程中产生的有机酸浓度、种类相差较大,所以不同高效解钾菌之间在对钾的活化能力上也存在较大差异[22]。
当植物根际土壤中的有机酸含量较低时,有机酸的种类将在一定程度上决定对土壤中难溶性或不可溶性钾的活化作用。丙酮酸、乙酸、柠檬酸在土壤中含量最高,对含钾矿物中的钾离子释放也起到较为重要的作用。
综上所述,不同菌株处理与只施用常规化肥的对照相比,施用了PGPR对土壤的肥力提高明显,从而进一步论证了PGPR可改良土壤环境、促进植物对土壤养分的吸收利用[23-24]。PGPR中的有机酸可有效地促进矿物钾的分解释放,但有机酸对含钾矿物的释钾是一个既缓慢又持续的综合动态过程,含钾矿物的释钾量既受有机酸种类的影响,也与其浓度影响关系密切。由于微生物自身的局限性以及植株对养分变化表达的滞后性,需要增加试验点扩大试验并对样本进行连续观测,以期建立更完善的数据体系。进一步的研究将有可能更深入地揭示与阐明高效解钾菌的解钾机制,这一点很值得关注。

