一株黄色杆菌的分离鉴定及对邻苯二甲酸酯的降解研究
王嘉翼 樊双虎 任超 王俊欢 杨婷 贾阳 李先军 闫艳春
(中国农业科学院研究生院,北京 100081)
邻苯二甲酸酯(Phthalic acid eaters,PAEs)是一类重要的工业原料,常见的PAEs包括邻苯二甲酸二甲酯(Dimethyl phthalate,DMP)、邻苯二甲酸二乙酯(Diethyl phthalate,DEP)、邻苯二甲酸二丁酯(Dibutyl phthalate,DBP)、邻苯二甲酸二辛酯(Dioctyl phthalate,DOP)、邻苯二甲酸甲苯基丁酯(Butyl benzyl phthalate,BBP)和邻苯二甲酸二乙基己酯(di-2-ethylhexyl phthalate,DEHP)。PAEs主要用作增塑剂,以增强塑料制品的柔韧性、可塑性和耐用性,此外还用作油漆、化妆品、杀虫剂等中的化学添加剂[1-2]。在塑料中,PAEs与塑料基质并非以共价键的形式结合,因此在塑料的在生产、使用和废物处理过程中,PAEs会从塑料中渗漏并进入环境[3]。DBP作为一种被广泛应用在实际生活中的邻苯二甲酸酯,环境中也是普遍存在。DBP在水中和和沉淀物中的浓度范围分别为1.0-13.5 μg/L和0.3-30.3 μg/g[4]。大量研究表明,PAEs具有环境雌激素效应,影响人体和动物的内分泌系统。PAEs还具有致畸致癌致突变的“三致效应”,主要表现在肝脏毒性、生殖毒性方面,如DBP可诱发肝细胞癌变。体外研究表明,DBP和BBP能抑制胚胎肢芽细胞的生长和分化,对成熟的大鼠和鱼类有抗雄性激素和抗雌性激素的作用[5]。目前,DMP,DEP,BBP,DBP,DOP 和 DEHP 已被美国环保局(EPA)列为优先控制的污染物。
PAEs在自然环境中极难降解,DEHP在环境中的半衰期长达2000年。PAEs 通过非生物途径降解如光解和水解的速度都很慢,且对环境造成二次污染。微生物代谢是一个酶促反应过程,对PAEs降解速率快,成本低,无二次污染,是PAEs 降解的主要途径。因此,PAEs 高效降解菌株的筛选对消除PAEs环境污染具有重要意义[6]。目前,许多学者已经从受污染的土壤、污泥等环境中分离纯化到大量的能快速降解PAEs的微生物。本实验室分离的戈登氏菌(Gordoniasp.)YC-RL2和分支杆菌(Mycobacteriumsp.)YC-RL4高 效 降 解 DEHP、DBP、BBP和DCHP等多种PAEs,质谱分析表明菌株通过酯键的逐步水解将PAEs转化成邻苯二甲酸单酯、邻苯二甲酸(Phthalic acid,PA)[7-8]。陈济安等[9]从活性污泥中分离的Microbacteriumsp. strain CQ0110Y,能将浓度在1 350 mg/L及以下的DEHP在10 d内完全降解,当浓度提高到2 000 mg/L时,10 d内DEHP的降解率在85%以上。
DBP是生活中应用最广泛的增塑剂之一,实验以DBP作为底物从受石油污染的土壤中分离到一株DBP降解菌,研究了温度,pH和盐度对其降解能力的影响,确定降解的最适条件。通过降解产物的确定,分析确定菌株对DBP的基本代谢途径。
1 材料与方法
1.1 材料
1.1.1 实验土壤样品采集与处理 土壤样品采集于受石油严重污染的土壤中,采样前对采样的玻璃器皿进行清洗并121℃高温高压灭菌20 min。用钢铲除去各个采样点上层15 cm的土层后取样,样品内同时含有水样和土壤样品。将所有采样点的样品混合装入已灭菌的玻璃器皿中密封,放置在装有冰袋的保温箱中,并于24 h内运回实验室,放入冰箱4℃保藏。
1.1.2 药品与实验试剂 该实验中所使用的化学药品均为分析纯,DBP等其他邻苯二甲酸酯购自于国药集团化学试剂北京有限公司;甲醇为HPLC级,购自于Fisher 公司;胰蛋白胨、酵母提取物购自于Oxiod 公司;NaCl等无机盐试剂,购自于国药集团化学试剂北京有限公司;基因组提取试剂盒、纯化试剂盒、rTaq 酶及核酸Marker购自于TaKaRa 公司;荧光核酸染料,购自于北京全式金生物技术有限公司;琼脂糖购自于天根生化科技(北京)有限公司;引物合成与测序均送往上海生工生物公司。
1.1.3 培 养 基 Luria-Bertani培 养 基(LB,pH 7.0)含有胰蛋白胨10.0 g/L,酵母提取物5.0 g/L,NaCl 10.0 g/L。无机盐培养基(TEM pH 7.0)含有(NH4)2SO42.0 g/L,Na2HPO4·12H2O 1.5 g/L,KH2PO41.5 g/L,MgSO4·7H2O 0.2 g/L,CaCl2·2H2O 0.01 g/L,微量元素溶液100 μL/L。微量元素溶液配置方法如下:将FeSO4·7H2O 5 g,ZnSO4·7H2O 0.22 g,CuSO4·5H2O 0.03 g,MnSO4·2H2O 1.43g,CoSO4·7H2O 0.12 g,Na2MoO4·2H2O 0.02 g,Na2WO4·2H2O 0.23 g溶于100 mL H2O。LB和TEM固体培养基按1.5%添加琼脂粉,所有的培养基都应121℃高温高压灭菌20 min。
1.2 方法
1.2.1 DBP降解菌株的筛选与形态特征 将DBP溶于甲醇中,配制成20 g/L的母液。在250 mL的锥形瓶中加入TEM液体培养基100 mL,土壤样品5 g,DBP浓度为100 mg/L。置于恒温振荡器中150 r/min、30℃培养5 d。将上述培养液按2%重新接至含有100 mg/L DBP的TEM液体培养基中,同条件培养5 d。重复进行5次富集,DBP的浓度保持不变。
取150 μL最终富集的培养液在含有100 mg/L DBP 的TEM固体培养基上均匀涂布,平板放置于30℃培养箱培养,直至长出单菌落。分别挑取表型不同的单菌落于含有100 mg/L DBP的TEM固体培养基上,进行划线分离,重复划线至TEM固体培养基上出现形态特征一致的单菌落,平板4℃保存备用。挑取单菌落接入含有100 mg/L DBP的TEM液体培养基中培养至对数期,加入30%甘油,-80℃冰箱保存备用。挑取单菌落接入含有100 mg/L DBP的LB液体培养基中,培养24 h,经固定液处理后用于扫描电镜观察。
观察菌落的形态及特征,根据伯杰氏细菌鉴定手册,对分离到的DBP降解菌株进行生理生化实验[10]。
1.2.2 16S rDNA 序列分析 采用试剂盒提取细菌基因组DNA,用通用引物27F(5′-AGTTTGACMTGGCTCAG-3′)和 1492R(5′-CGGTTACCTTGTTACGACTT-3′)对16S rDNA 进行PCR扩增。PCR扩增体系如下:PCR premix buffer(TaKaRa)25 μL,正反向引物各 1.5μL,ddH2O 20 μL 和 2 μL 的细菌基因组 DNA。PCR循环参数如下:94℃预变性5 min,94℃变性1 min,56℃退火45 s,72℃延伸90 s,上述循环重复34次,最后一次延伸10 min。
PCR产物纯化之后与pEASY-T1 克隆载体连接,连接体系如下:PCR产物4 μL,p-EASY-T1载体1 μL混合均匀后,放置37℃金属浴反应10 min。将连接产物加入至DH5α感受态细胞中,轻弹混匀,冰浴30 min。42℃金属浴热激60 s,冰浴2 min。加入500 μL平衡至室温的LB培养基,180 r/min,37℃培养 1 h。取 16 μL 250 mmol/L IPTG 和 40 μL 20 mg/mL X-gal混合,均匀涂在LB平板上,待全部吸收后,再将200 μL菌液均匀地涂在平板上,37℃培养箱中过夜培养。次日,挑取白斑送至生工测序公司进行测序。测序结果提交至GenBank(NIH,Bethesda,MD,USA)并用BLAST将其与GenBank已知序列进行比对,并用MEGA 7.0 软件构建系统发育树。
1.2.3 菌株YC-JY1对DBP的降解验证 根据已有文献报道,将起始温度设为30℃,培养基的pH设为7.0。将单菌落接种至含有100 mg/L DBP的LB培养基中扩大培养至OD600=0.6-1.0,取出1 mL 菌液12 000 r/min 离心2 min,用TEM液体培养基(pH 7.0)吹打清洗两次。为验证菌株YC-JY1以DBP作为唯一的碳源进行生长,将菌株YC-JY1以2%接菌量分别接至不添加任何碳源的TEM液体培养基中和只有甲醇为唯一碳源的TEM液体培养基中。再以同样的接菌量接入至含有100 mg/L DBP 的10 mL TEM液体培养基中,150 r/min、30℃培养5 d,未接菌的样品作为空白对照。验证菌株YC-JY1能够以DBP作为唯一碳源并测定菌株YC-JY1的生长曲线及其对DBP的降解率。
1.2.4 DBP降解的最适条件 为测定pH对菌株YCJY1降解DBP的影响,培养温度初始设为30℃,pH 2.0-13.0。将菌株YC-JY1按2%接菌量接入含有100 mg/L DBP的10 mL TEM液体培养基中,150 r/min培养5 d,未接菌的样品作为空白对照,每个pH设置5个重复。5 d后气相色谱仪(GC)测DBP的含量,计算降解率,确定最适pH。在最适pH条件下,温度设置为15-40℃,每5℃为一个梯度,培养方式与上述方法相同,确定菌株最适的降解温度。
1.2.5 NaCl含量对菌株YC-JY1降解DBP的影响 添加NaCl(含量为0%、2%、4%、6%、8%和10%)至含有100 mg/L DBP的TEM液体培养基中。将菌株YC-JY1按2%接菌量接入培养基中,最适条件下,150 r/min培养5 d,未接菌的样品作为空白对照,考查盐度对菌株降解能力的影响。
1.2.6 菌株YC-JY1对DBP的最大耐受浓度 将菌株按2%的接菌量接入10 mL TEM液体培养基中,同时分别加入100 mg/L、200 mg/L、300 mg/L、400mg/L、500 mg/L、600 mg/L、700 mg/L、800 mg/L、900 mg/L和1 000 mg/L不同浓度的DBP作为底物。最适条件下,150 r/min培养5 d,未接菌的样品作为空白对照。
1.2.7 菌株YC-JY1对其他PAEs的利用 为检测菌株YC-JY1对不同PAEs的利用能力,让其在分别含有以下PAEs的培养基中培养,作为底物的PAEs为:邻苯二甲酸二丙酯(DPrP)、DBP、DPeP、DHP、邻苯二甲酸二庚酯(DHPP)、DOP、邻苯二甲酸二壬酯(DNP)、邻苯二甲酸二癸酯(DDP)、DCHP、BBP,浓度均为100 mg/L。接菌量仍为2%,在最适条件下,150 r/min培养5 d,每种底物设置5个重复,未添加菌株的样品作为空白对照。记录培养基中菌株YC-JY1的生长情况,有明显生长记作(+ +),不明显生长记作(+)。
1.2.8 DBP代谢产物的确定和代谢途径的推测 DBP的中间代谢产物通过HPLC-MS分析,并由此推测菌株YC-JY1对DBP的代谢途径。以2%接菌量接入含有100 mg/L DBP的10 mL的TEM液体培养基中,最适条件下,150 r/min培养3 d,设置3个重复。3 d后,处理样品并用于HPLC-MS分析。
1.2.9 PAEs的分析方法 所有的降解实验均在5 d后使用GC测定样品中的PAEs残留量。样品中加入等体积的正己烷,摇晃震荡1 min。待水相与有机相分离后,取有机相1 mL于样品瓶中用于GC分析。
GC分析仪器和参数如下:岛津气相色谱仪2010,FID检测器,RTX-1301毛细管柱(30.0 m × 0.25mm × 0.25 μm)。载气为氮气(纯度≥ 99.999%,流速为30 mL/min);进样口温度300℃,柱温280℃,检测器300℃;进样量为1 μL,GC分析软件(版本2.32.00,SHIMADZU)分析GC检测结果,计算降解率。
1.2.10 HPLC-MS分析方法 首先用2M HCl对已培养3 d的样品进行酸化,调至样品pH 至2.0-3.0。加入等体积乙酸乙酯,摇晃震荡1 min,待有机相与水相完全分离后,取出全部有机相。氮气吹直至样品中乙酸乙酯完全挥发,1 mL 甲醇复溶,经0.22μm滤膜过滤后用于HPLC-MS检测。
HPLC-MS 仪器与分析参数如下:安捷伦高效液相色谱串联三重四级杆质谱(HPLC-QQQ,1260-6420)对样品进行检测。质谱配置电喷雾电离源(ESI)和Zorbax Eclipse Plus C18 柱,柱温维持在30℃。流动相是水和甲醇(10∶90),流速 0.2 mL/min,进样量10 μL,样品直接进入质谱仪。ESI-MS分析环境如下:载气(325℃)为高纯氮气(99.999%),流速为 8 L/min,毛细管电压为3.5 kV。通过负离子扫描模式进行检测,扫描范围为 50-400 m/z,通过 Mass hunter(version A.02.00,USA)对结果进行收集及数据分析[11]。
2 结果
2.1 邻苯二甲酸酯降解菌的分离与形态学特征
经多轮富集和筛选纯化,在受石油污染的土壤中分离出一株可利用DBP作为唯一碳源进行生长的菌株。该菌株菌落呈圆形,表面光滑呈黄色,不透明,在平板上生长状态如图1所示。通过扫描电镜观察,菌株YC-JY1为杆状,大小约为 (0.36 μm-0.44 μm)×(1.22 μm-1.44 μm)(图 2)。

图1 菌株YC-JY1在TEM固体培养基上的生长

图2 菌株YC-JY1的扫描电镜照片
提取细菌总DNA 并选用细菌通用引物27F和1 492R扩增16S rDNA 基因,扩增产物序列长度为1 445 bp,如图3所示。根据测序结果,所获得的序列提交至GenBank,登录号为MH152572。利用BLAST 软件与GenBank 中已登录的16S rDNA基因序列进行同源性比较,MEGA 7.0 软件建立系统发育树,如图3所示。经过比较,菌株YCJY1与Xanthobacter aminoxidans14a(GenBank:AF399969.1) 和Xanthobacter flavus301(GenBank:X94199.1)具有100% 的同源性,因此确定菌株属于黄色杆菌属(Xanthobactersp.)。
2.2 菌株YC-JY1对DBP的降解及生长曲线
如图4所示,菌株YC-JY1在TEM液体培养基、在只含有甲醇的TEM液体培养基中均无生长;在含有DBP的TEM液体培养基的样品中,明显由无色变为淡黄色,生长现象明显。由此可知,菌株YCJY1可以将DBP作为唯一碳源进行生长。
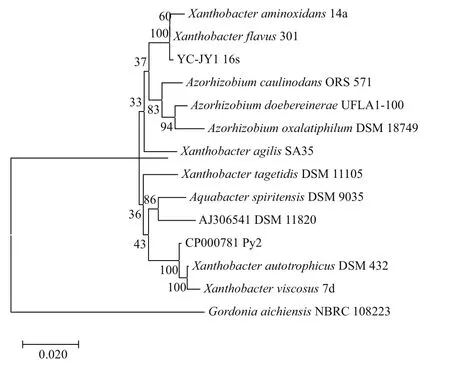
图3 菌株YC-JY1的16S rDNA序列分析与系统发育树的构建

图4 菌株利用DBP作为唯一碳源的生长
DBP的降解率与菌株YC-JY1的OD600值呈正相关,在5 d内被菌株YC-JY1完全降解(图5)。
2.3 菌株YC-JY1降解DBP的最适条件
如图6所示,菌株YC-JY1降解DBP的最适pH为7.0,DBP降解率100%;pH4.0-6.0,DBP的降解率为15%-60%;pH8.0-11.0,DBP的降解率为30%-80%;pH12.0-13.0,DBP的降解率为10%左右;pH2.0-3.0,菌株YC-JY1不降解DBP。数据说明,偏碱性环境更适合菌株YC-JY1降解DBP。
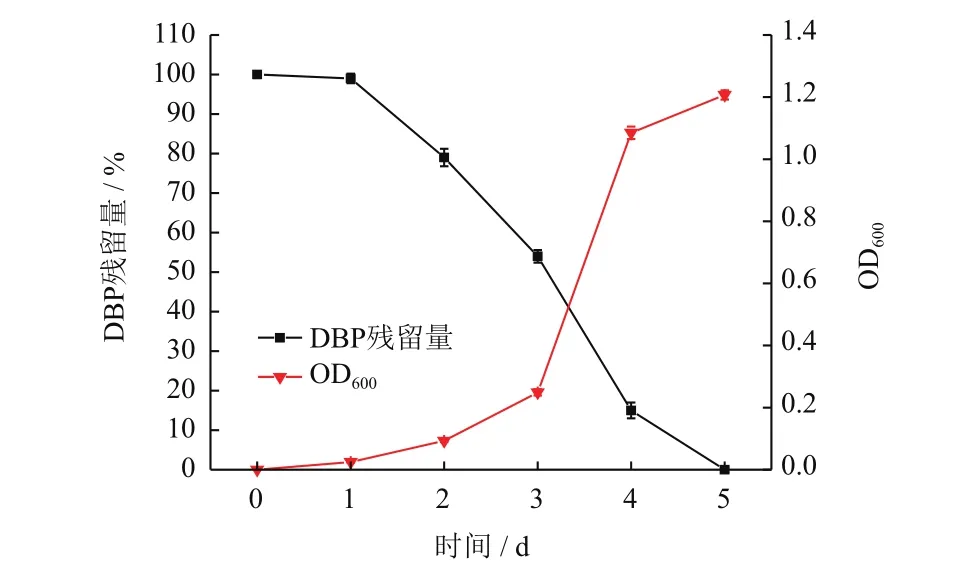
图5 菌株YC-JY1对DBP的降解和生长曲线
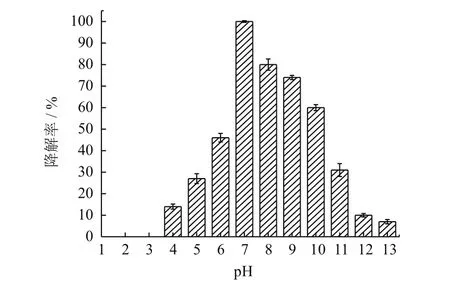
图6 pH对菌株YC-JY1 降解DBP的影响
如图7所示,菌株YC-JY1降解DBP的最适温度为30℃,DBP降解率为100%;20℃-35℃,DBP降解率在40%以上;15℃和40℃,DBP无降解。所有pH,温度的对照组中,DBP起始浓度与终浓度无明显变化,菌株YC-JY1无生长迹象。
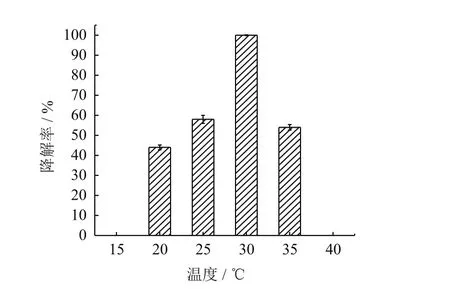
图7 温度对 YC-JY1 降解DBP的影响
2.4 NaCl对菌株YC-JY1降解DBP的影响
DBP的降解率如图8所示。培养5 d之后,未添加NaCl 的样品中,DBP被完全降解;NaCl 含量上升到2%时,DBP的降解率迅速下降到35%;NaCl 含量超过2%时,DBP的降解率稳定在10%左右,由此说明菌株YC-JY1并没有表现出明显的耐盐能力。
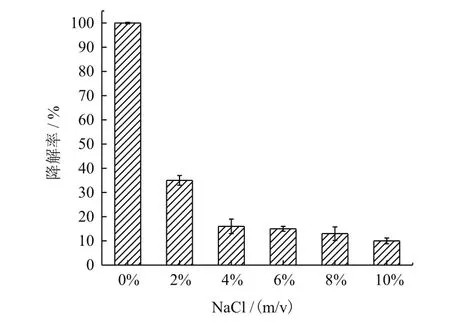
图8 NaCl的添加对菌株YC-JY1降解DBP的影响
2.5 菌株YC-JY1对DBP的最大耐受浓度
验证菌株YC-JY1 对DBP的最大耐受浓度,结果如图9所示,培养5 d后,100 mg/L 的DBP 能够被完全降解;200 mg/L-400 mg/L DBP的降解率在94%以上;500 mg/L-1000 mg/L DBP降解率在24%-77%之间。由此可知,菌株YC-JY1对DBP的最大耐受浓度为400 mg/L。对于更高浓度的DBP降解,菌株YC-JY1可能需要更长的时间。
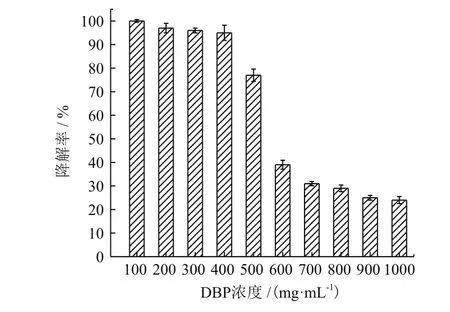
图9 YC-JY1对DBP的最大耐受度
2.6 菌株YC-JY1的底物谱
菌株YC-JY1在以各种PAEs为底物的TEM液体培养基中的生长情况,如表1所示。
GC 检测样品中各种PAEs残留量,通过计算,得到的降解率如图10所示。从数据中可以得出,菌株YC-JY1能否降解该底物,与在培养基中的生长情况是相关的。菌株YC-JY1在分别以DBP、DPeP、DHP作为唯一碳源的样品中,菌株有明显生长,相应的PAEs降解率在90%以上;在分别以DPrP、DHPP、DOP、DNP、DDP、DCHP、BBP为唯一碳源的样品中,菌株有生长,但不明显,此时相应的PAEs降解率在10%-60%。综上所述可知,菌株的生长与对PAEs降解能力是相符合的。
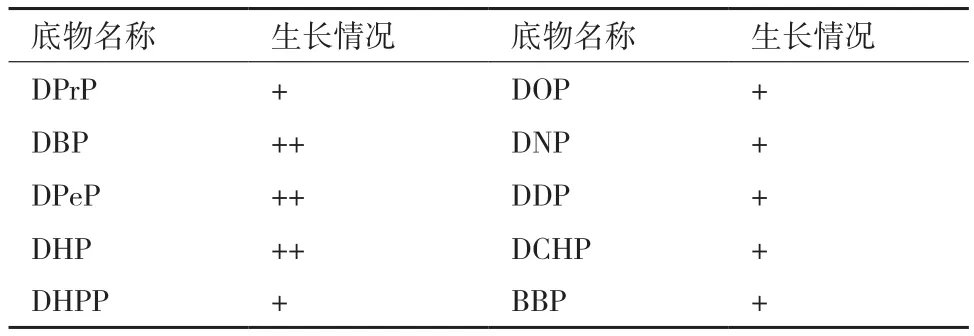
表1 菌株YC-JY1以PAEs作为底物的生长情况
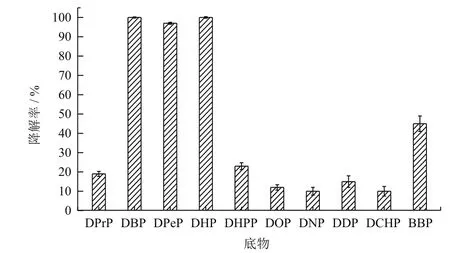
图10 YC-JY1 对PAEs的降解
菌株YC-JY1可以利用不同类型的PAEs,具有相对广泛的PAEs 底物谱。菌株YC-JY1在含有DBP、DPeP、DHP的TEM液体培养基中生长良好,并能够很好地降解这些底物,说明菌株YC-JY1对具有中长侧链的PAEs的降解能力要好于具有短侧链和长侧链的PAEs。
2.7 菌株YC-JY1降解DBP的代谢途径推测
通过HPLC-MS分析,将质谱图所显示的分子量,与标准化合物标准与技术(NIST,Gaithersburg,MD)库数据库进行比对。由于质谱扫射选用的是负离子模式,所以图11中的221.0所对应的物质应是丢失一个氢离子的MBP,164.9对应的物质应是丢失一个氢离子的PA。如图12所示,推测菌株YC-JY1降解DBP的起始代谢途径为:DBP通过水解反应形成MBP,MBP进一步水解形成PA。
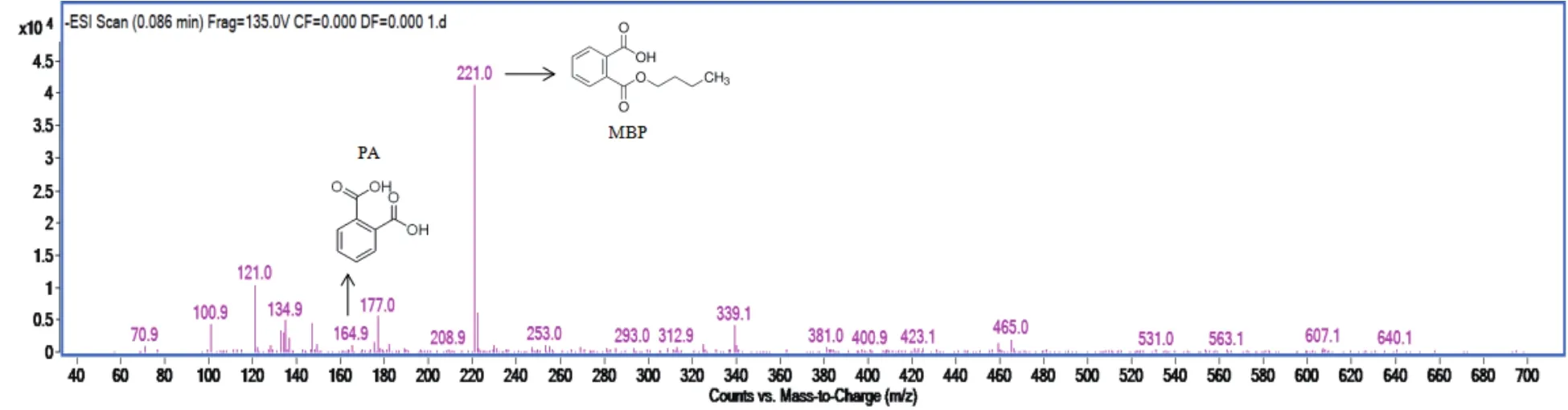
图11 DBP代谢产物HPLC-MS分析图

图12 DBP代谢途径推测
3 讨论
Xanthobactersp.是一类广泛存在于自然环境中的革兰氏阴性菌,已发现该属的菌株具有降解多种污染物的能力。Xanthobactersp.有较多关于降解含卤素的有机污染物的文章,Hosoda等[12]筛出的菌株XautotrophicusGJ10 和 Kevin McClay等[13]筛出的菌株XautotrophicusENV481都是能够利用卤化烃作为唯一的碳源和能源,对其进行脱卤作用。Petrus等[14]从土壤中分离出Xanthobacter autotrophicusPy2.,可以对汞和甲基汞进行有效地降解。这些都表明,Xanthobactersp.在环境污染物的降解方面起到了重要作用。尽管来自不同环境的微生物降解PAEs的研究有很多,但是至今还没有关于Xanthobactersp. 降解DBP的文献。本文关于Xanthobactersp. 降解DBP 的报道,为Xanthobactersp. 降解有机污染物研究提供了参考。
细菌对PAEs的降解已有很多的研究,其中pH和温度是影响菌株降解能力的重要因素,目前有关Xanthobactersp.降解最适条件已基本清楚。Schneider等[15]提出Xanthobacter autotrophicus.最适生长条件是 pH 6.8-7.2;Padden等[16]也发现,Xanthobacter aminoxidans最适pH 为7.2-7.9,在pH 6.5-8.5 也可以生长,这与上述实验数据基本一致。苍白杆菌属(Ochrobactrumsp.)降解DBP,pH 4.0-10.0 时,DBP的降解率在5%-100%。与之相比,菌株YC-JY1能在更广泛的pH范围内降解DBP[17]。也有相关文章表明Xanthobactersp.生长和降解的最适温度为28℃和32℃[18-19],与本实验中菌株YC-JY1最适降解温度30℃相符合。此外,在以前有关Xanthobactersp.的研究中,也未测过盐度对其降解DBP的影响,而盐度也是影响菌株降解能力的一个因素。本研究对Xanthobactersp.的耐盐特征进行了补充。
关于菌株对DBP的最大耐受浓度现已有很多报道。Herbert等[20]发现鞘氨醇单胞菌属(Sphingomonassp.)DEP-AD1通过20 d的培养,发现其可以在139 mg/L 的DBP中生长。而菌株YC-JY1在400 mg/L DBP中,3 d就可以看出明显的生长。金雷等[21]筛出DBP降解菌株,类芽胞杆菌属(Paenibacillussp.)S-3在5 d内能够将100 mg/L DBP降解82.7%,而菌株YC-JY1在5 d内可以将100 mg/L DBP完全降解。与之相比,菌株YC-JY1对DBP具有更好的降解能力和耐受能力。
4 结论
本研究从长期受石油污染土壤中筛选出一株可以利用DBP作为唯一碳源的菌株,根据16S rDNA鉴定,确定其属于黄色杆菌属(Xanthobactersp.),并命名为YC-JY1。DBP降解的最优条件是30℃,pH 7.0,不添加NaCl;菌株YC-JY1能够高效降解100 mg/L-400 mg/L DBP,并具有相对广泛的PAEs底物谱。5 d内可以将100 mg/L DBP完全降解,对于100 mg/L DPeP和100 mg/L DHP可大部分降解;通过HPLC-MS分析,菌株YC-JY1降解DBP的中间代谢产物为MBP和PA,由此推测其起始代谢途径为DBP水解为MBP,MBP进一步水解为PA。

