沙漠小球藻转人乳铁蛋白的电转优化
汪文伦, 牟 云, 胡梦薇, 许万云, 严 国, 王会敏, 高剑峰
(石河子大学 生命科学学院,新疆 石河子 832000)
沙漠微藻的研究开始于20世纪80年代末。有研究表明,在新疆沙漠中生长着百余中藻类,小球藻是其重要的组成部分[1]。小球藻(Chlorella)是一种单细胞绿藻,富含油脂、蛋白质、碳水化合物、维生素、食用纤维、微量元素和其它生物活性物质[2]。有研究表明,通过基因工程手段和诱导条件,它能够积累大量的油脂酸和藻蛋白[3-5]。因此,小球藻的研究和开发应用越来越受到重视。采用基因工程技术优化小球藻的油脂酸和藻蛋白合成具有重要的科学意义和巨大的应用价值,然而对小球藻而言,还缺乏有效的遗传转化方法,成功转化的报道只有农杆菌介导法[6],尚没有报道沙漠小球藻的电击转化法的优化研究。
在遗传转化中根瘤农杆菌转染法常用于酵母和植物细胞中[7],而微藻细胞中常用电转化法,并且操作简单、价格低廉、过程易于控制,在适当的电转化条件下对细胞的伤害小,电转效率高。目前,电击转化也是一种比较成熟转化方式并成功的应用于等 鞭 金 藻 (Isochrysis sp)[8]、 小 球 藻 (Chlorella vulgaris)[9]、 鱼 腥 藻 (Anabaena)[10]、 斜 生 栅 藻(Scenedesmus obliquus)[11]、 杜 氏 盐 藻 (Dunaliella sallina)[12]和莱茵衣藻 (Chlamydomonas reinhardtii)[13-14]、雨生红球藻(Haematococcus pluvialis)[15]等,并且获得了稳定的外援基因转化系统。有文献表明[16],电击后细胞存活率<50%时,在雨生红球藻细胞中能实现高效转化。
作者以小球藻为实验材料,进行电转化导入质粒pCAMBIA2300。质粒pCAMBIA2300上含有人乳铁蛋白(human lactoferrin,HLF)和 GFP 以及卡那霉素基因,即pCAMBIA2300-35S-GFP-HLF-OCS。为了检测质粒pCAMBIA2300是否导入到小球藻细胞中,采用单菌落PCR和荧光倒置显微镜检测转化效率。为了有利于沙漠微藻转基因工程改进,作者研究了主要电击参数和相关因子对小球藻存活和转化效率的影响,从而建立电转化体系,以期待指导小球藻的成功转化。
1 材料与方法
1.1 材料与仪器
沙漠小球藻GTD8A1:作者所在实验室分离鉴定获得,采用的培养基为BBM。取对数生长期的藻液,按照10%的接种体积分数接种。培养条件:25℃光照培养箱中培养,光照强度:4 000 Lx,光照周期为光/暗=12 h/12 h静止培养,每三天手动摇晃一次。
质粒pCAMBIA2300-35S-GFP-HLF-OCS的大小为10 kb左右,由作者所在实验室保存,在E.coliDH5α培养扩增,采用高纯度质粒小提试剂盒提取纯化。质粒pCAMBIA2300含有人乳铁蛋白(human lactoferrin,HLF)和GFP以及卡那霉素基因,质粒浓度采用紫外分光光度计仪测定。
主要试剂:山梨醇、甘露醇和HEPES均购自上海生工;质粒小提试剂盒购自北京天根;卡那霉素(Kanamycin,Kan)购自北京索莱宝科技有限公司。
主要仪器:荧光倒置显微镜、电击转化和PCR仪等。
1.2 实验方法
1.2.1 质粒载体pCAMBIA2300-35S-GFP-HLFOCS验证通过含有抗性的LB培养基将E.coliDH5α扩增24 h后,采用质粒小提试剂盒将质粒载体pCAMBIA2300-35S-GFP-HLF-OCS提取,采用HLF和GFP引物进行PCR检测,同时送样测序验证。
PCR (Polymerase Chain Reaction) 反应体系:ddH2O 8 μL, 单克隆变性液 2 μL, 引物 (GFP-F/GFP-R;HLF-F/HLF-R)2 μL,2×Taq PCR MasterMix(TaKaRa,China) 8 μL,共 20 μL 扩增体系。
PCR(Polymerase Chain Reaction)反应条件:94℃ 3 min;94 ℃ 30 sec,55 ℃ 30 sec,72 ℃ 1 min,循环30次;72℃10 min。 扩增后的目的条带约750 bp,PCR产物通过1%的琼脂糖凝胶电泳检测。
PCR(Polymerase Chain Reaction)反应条件:95℃预变性 5 min;95℃ 变性 60 s,62℃退火 40 s,72℃延伸2.5 min,35个循环;72℃延伸10 min,4℃保存。扩增后的目的条带约2 133 bp,PCR产物通过1%的琼脂糖凝胶电泳检测。
沙漠小球藻GT8A1所用的BBM培养基:NaNO3250 mg/L,KH2PO4175 mg/L,K2HPO475 mg/L,MgSO4·7H2O 75 mg/L,CaCl2·2H2O 25 mg/L,NaCl 25 mg/L,EDTA 50 mg/L,KOH 31 mg/L,FeSO4·7H2O 4.98 mg/L,H3PO411.42 mg/L,ZnSO4·7H2O 8.82 mg/L,MnCl21.44 mg/L,MoO30.71 mg/L,CaSO4·5H2O 1.57 mg/L,Co(NO3)2·6H2O 0.49 mg/L,98%H2SO42 μL/L。(可以在以上组份中加入15~20 g琼脂,加入蒸馏水补至1 L制成固体培养基,121℃灭菌20 min,4℃保存)。
E.coliDH5α所用的LB培养基:胰蛋白胨10g/L,酵母提取物 5 g/L,氯化钠 10 g/L(加去离子水溶解至终体积1 L,用2 mol/L NaOH调pH值7.0~7.4之间;同时加入15~20 g琼脂粉,制成固体培养基;在121℃高压下灭菌20 min,4℃保存)。
1.2.2 生长曲线的测定小球藻采用BBM培养基进行培养,接种后的细胞浓度为3.2×105个/mL,设置3个平行样,每隔两天取样一次,进行细胞OD680检测。
1.2.3 电击转化过程 取不同培养时间的小球藻细胞3~5 mL(细胞数量控制在 1×108个/mL),在5 000g/min离心5 min,收集小球藻细胞后再用无菌的BBM培养基清洗3次,然后分别在5 000﹑4 000、3 000g/min离心收集比较干净的小球藻细胞;将收集好的小球藻细胞置于不同浓度的高渗溶液中(甘露醇、山梨醇各100 μL),在冰上处理不同的时间,然后3 000g/min离心收集比较干净的小球藻细胞,去掉上清液,在沉淀中加入pH 7.2的不同浓度HEPS电击缓冲液 (取23.8 g HEPES溶于90 mL双蒸水中,用2 mol/L的NaOH调pH至7.0~8.0,然后用蒸馏水定容至100 mL,过滤除菌,分装成2 mL/瓶,4℃保存),将藻细胞稀释成1×108个/mL放置冰上备用;用紫外光处理干净的电击杯30 min左右,将其放置在冰上备用;按藻细胞:质粒(不同浓度的质粒)=3∶1的比例混匀样本加入到电击杯中,在冰上放置10 min后,在电击仪上电击,在不同的电压条件下电击,持续时间0.2 s,脉冲距离2 mm;电击后的藻细胞置于含有3 mL复活培养基的六孔版中,在黑暗的条件下复活24~48 h后,一部分用血球计数板计数,并计算细胞的存活率;一部分在7 000g/min离心1 min收集转化小球藻细胞,再用无菌的BBM培养基清洗3次,然后分别再5 000﹑4 000、3 000g/min离心收集比较干净的小球藻细胞,一部分用无菌的ddH2O稀释后在荧光倒置显微镜下观察荧光和计数,一部分涂布于含有100 mg/L卡那霉素的BBM固体平板上,筛选单克隆。培养4~6周后会有单克隆长出,然后将平板上所长的单克隆用无菌的牙签挑起后置于10 μL的ddH2O中,95℃预变性后作为PCR反应的模板,用PCR检测阳性克隆,PCR条件同上。
1.2.4 单因素实验设计分别以不同的电压、培养周期、渗透剂浓度、渗透时间、质粒浓度和电击缓冲液浓度为单因素进行实验,根据实验结果确定正交实验变量的设计范围。
1.2.5 正交实验设计根据单因素实验结果,选取单因素实验最适的范围,设计正交实验表以获取最佳的电转优化体系,结果见表1。

续表1
1.2.6 分析方法将所有电击转化后的小球藻细胞24 h复活后,通过梯度离心获得细胞,用400 μL培养基重悬,取100 μL做细胞计数和荧光倒置显微镜计数;然后将300 μL细胞悬液涂布于3个平行的抗性筛选平板中,培养4~6周后有单克隆长出,用灭菌的牙签挑取单克隆做菌落PCR检测,检测结果用1%的琼脂糖凝胶电泳检测。
PCR (Polymerase Chain Reaction) 反应体系:ddH2O 8 μL, 单克隆变性液 2 μL, 引物 (HLF-F/HLF-R)2 μL,2 ×Taq PCR MasterMix (TaKaRa,China) 8 μL,共 20 μL 扩增体系。
PCR(Polymerase Chain Reaction)反应条件:95℃预变性 5 min;95℃ 变性 60 s,62℃退火 40 s,72℃延伸2.5 min,35个循环;72℃延伸10 min,4℃保存。扩增后的目的条带约2 133 bp,PCR产物通过1%的琼脂糖凝胶电泳检测。
采用PCR手段对遗传稳定性进行评价:本实验将获得的转化藻株进行传代培养,每隔两个月提取其RNA反转录后采用PCR技术验证目的基因(HLF)是否存在,来证明其遗传稳定性。其中RNA的提取按照TRIZOL的说明书进行;反转录采用TAKARA的试剂盒进行,操作按说明书进行;PCR反应体系同上。
2 结果与分析
2.1 质粒载体pCAMBIA2300-35S-HLF-GFPOCS鉴定及其荧光表达
采用PCR和荧光倒置显微镜对构建的载体进行验证和表达,通过PCR获得HLF和GFP目的基因,其目的条带大小为2 133 bp和750 bp,见图1(a)。通过荧光倒置显微镜证明了GFP能在小球藻细胞中表达,其中绿色为含有GFP的小球藻细胞,红色为不含GFP的小球藻细胞,见图1(b)。实验结果表明,质粒载体可以用于下面的实验研究。
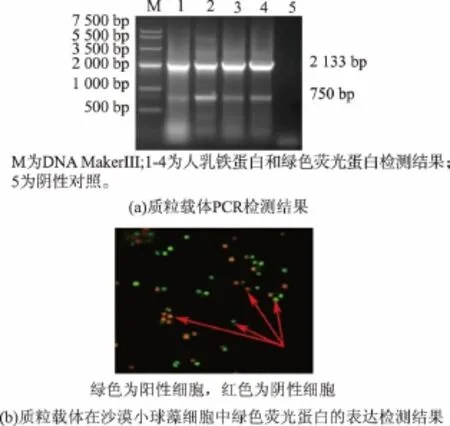
图1 质粒载体pCAMBIA2300-35S-HLF-GFP-OCS鉴定及其荧光表达Fig.1 Plasmid vector of pCAMBIA2300-35S-HLFGFP-OCS isdetectand expressfluorescent protein
2.2 小球藻细胞生长曲线的测定
以小球藻细胞的培养天数为横坐标,吸光值为纵坐标,绘制小球藻细胞生长曲线,见图2。由图2可以看出,沙漠小球藻在培养到第8天开始进入对数生长期,对数生长周期大约为16 d左右,稳定期22 d,在30 d左右出现衰亡期。

图2 沙漠小球藻细胞生长曲线Fig.2 Growth curve of desert chlorella vulgaris
2.3 单因素实验结果
2.3.1 优化电转击穿电压采用不同电压对小球藻细胞进行电转化实验,分别记录其细胞的致死率、荧光阳性百分率和PCR阳性百分率,将进行3次重复实验的结果求平均值,见表2。实验结果见图3。可知,最佳的电击电压为1 400 V,此时的细胞致死率为56.20%,荧光阳性平均百分率为30.83%,PCR阳性平均百分率为39.56%。

表2 不同击穿电压条件下的电转化效率Table 2 Electrotransformation efficiency was detected in different breakdown voltage condition
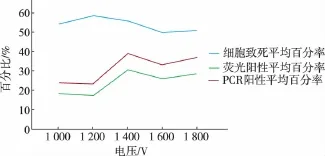
图3 不同击穿电压条件下的实验结果Fig.3 Experimental statistics and results charts under the different breakdown voltage conditions
2.3.2 优化培养周期采用不同培养周期的小球藻细胞进行电转化实验,分别记录细胞的致死百分率、荧光阳性百分率和PCR阳性百分率,将3次重复实验的结果求其平均值,见表3。实验结果见图4。可知最佳培养周期为8 d,此时的细胞致死率为52.94%、荧光阳性平均百分率为30.20%,PCR阳性平均百分率为38.29%。
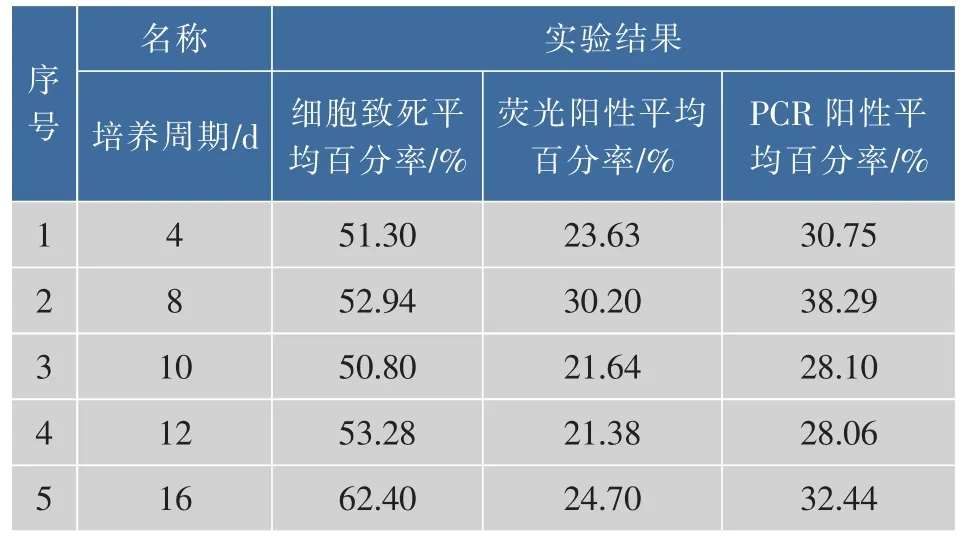
表3 不同细胞培养条件下的电转化效率Table 3 Electrotransformation efficiency was examined under different microalgae cell cycle condition
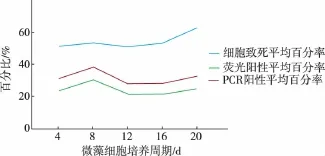
图4 不同培养周期的实验结果Fig.4 Experimental statistics and results charts under different micro-algae cell cycle condition
2.3.3 优化渗透剂浓度采用不同渗透剂浓度对小球藻细胞渗透处理后,进行电转化实验,分别记录其细胞的致死率、荧光阳性百分率和PCR阳性百分率,将3次重复实验的实验结果求平均值,见表4,实验结果见图5。可知最适渗透剂浓度为0 mol/L,此时的细胞致死率为53.70%,荧光阳性平均百分率为27.87%,PCR阳性平均百分率为36.17%。
2.3.4 优化渗透时间采用渗透剂对小球藻细胞进行不同时间的处理,然后进行电转化实验,分别记录其细胞的致死率、荧光阳性百分率和PCR阳性百分率,将3次重复实验的结果求其平均值,见表5,实验结果见图6。可知最佳渗透时间0 h,此时的细胞致死率为51.24%,荧光阳性平均百分率为28.01%,PCR阳性平均百分率为35.55%。
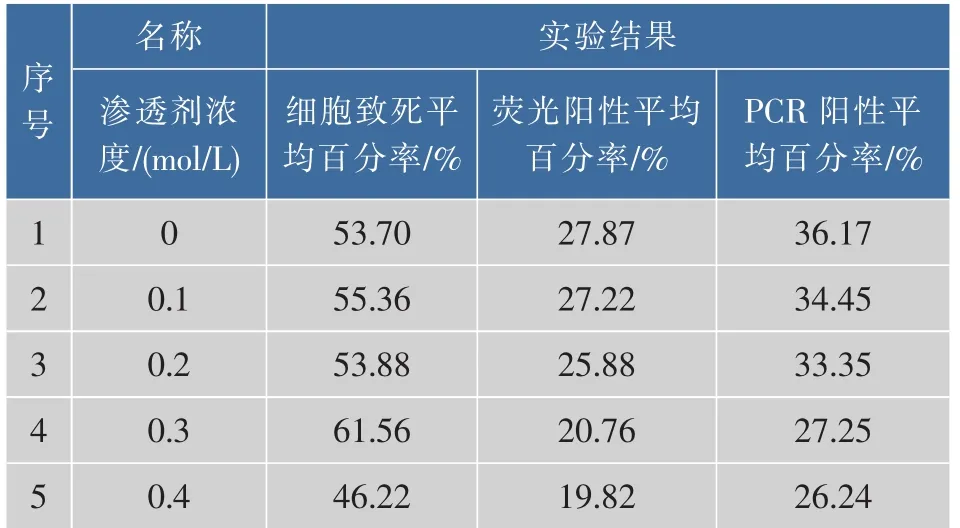
表4 不同渗透剂浓度条件下的电转化效率Table 4 Electrotransformation efficiency was detected under different osmosis buffer concentration condition
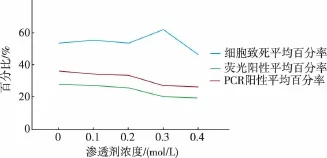
图5 不同渗透剂浓度的实验结果Fig.5 Experimental statistics and results charts under different osmosis buffer concentration condition
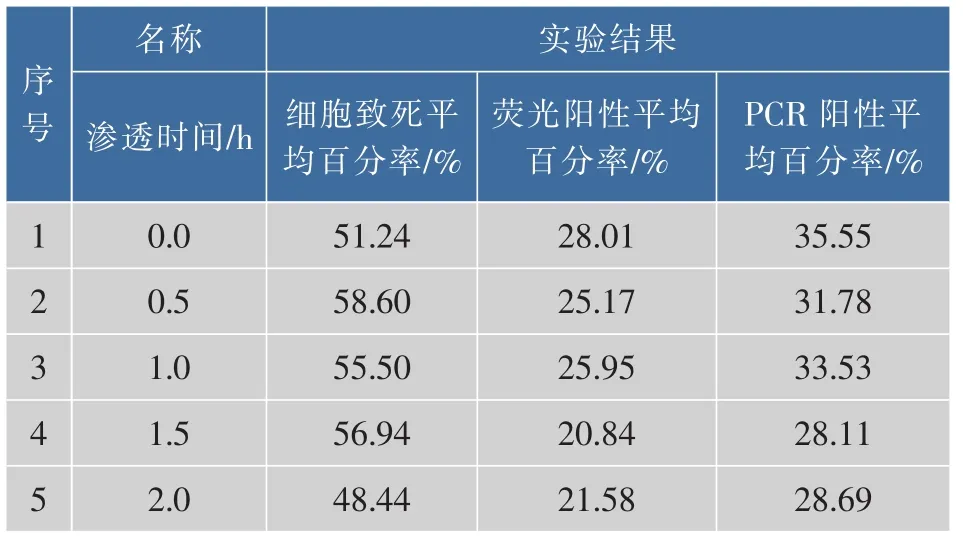
表5 不同渗透处理时间条件下的电转效率Table 5 Electrotransformation efficiency was obtained the samepenetrant osmosistreatmentChlorella Vulgaris under different time condition
2.3.5 优化电击缓冲液浓度对处理好的小球藻细胞添加不同浓度的电击缓冲液,然后进行电转化实验,分别记录其细胞致死率、荧光阳性百分率和PCR阳性百分率,将3次重复实验的结果求其平均值,见表6,实验结果见图7。可知最适电击缓冲液浓度为0.1~0.2 mol/L,此时的细胞致死率为51.16%~53.64%,荧光阳性平均百分率为26.35%~26.38%,PCR阳性平均百分率为33.47%~33.81%。
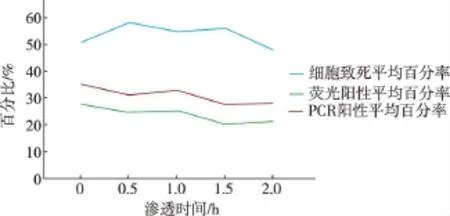
图6 不同渗透剂处理时间的实验统计和结果统计图Fig.6 Experimental statistics and results charts under different time of osmosis treatment condition
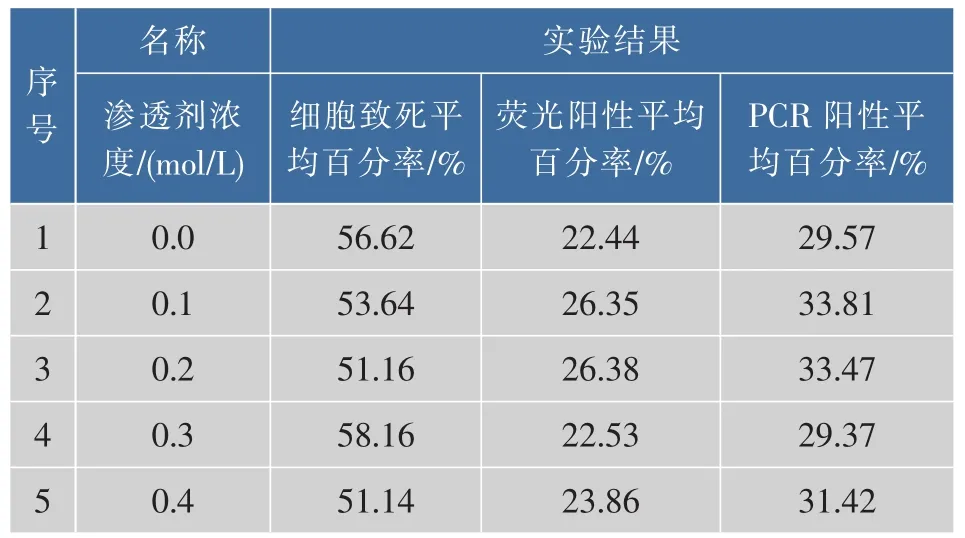
表6 不同电击缓冲液浓度下的电转化效率Table 6 Electrotransformation efficiency was obtained under different electroporation buffer concentration condition

图7 不同电击缓冲液浓度的实验结果Fig.7 Experimental statistics and results charts under different electroporation buffer concentration condition
2.3.6 优化质粒质量浓度对处理好的小球藻细胞添加不同质量浓度的质粒,然后进行电转化实验,分别记录其细胞的致死率、荧光阳性百分率和PCR阳性百分率,将3次实验的结果求平均值,见表7,实验结果见图8。可知随着质粒质量浓度的增加,荧光阳性百分率和PCR阳性百分率都在增加,其最小值分别为22.02%和28.98%。

表7 不同质粒质量浓度条件下的电转化效率Table 7 Electrotransformation efficiency was detected under different plasmid concentration condition

图8 不同质粒质量浓度的实验结果Fig.8 Experimental statistics and results charts under different plasmid concentration condition
2.4 正交实验确定最优电转体系
通过单因素水平的优化实验结果,作者对各个因子选取五个水平设计了六因素五水平的正交实验表进行相关的实验,以获取最优的电转化组合。通过对实验数据的各因素进行极差分析得到:最优的电转化组合是电压1 400 V、培养周期8 d、渗透剂浓度0.2 mol/L、渗透时间为0 h、质粒质量浓度为6 μg/mL、电击缓冲液浓度为0.4 mol/L,其细胞致死率为51.30%,荧光阳性平均百分率为52.54%,PCR阳性平均百分率为42.30%。
2.5 采用PCR手段对遗传稳定性进行评价
对本实验所获得转化藻株进行扩大培养,每隔两个月取50 mL的培养液离心后提取RNA,反转录后检测其HLF的遗传稳定性。实验结果表明,HLF基因能在沙漠小球中传代保存六个月以上,具有相对的遗传稳定性,实验结果见图9。

图9 采用PCR手段对遗传稳定性进行鉴定Fig.9 Genetic stability of recombinant desert Chlorella was detected with PCR
3 结 语
作者优化了小球藻电击转化的条件,并获得最佳的电击转化条件,在该条件下获得较高的转化水平,其荧光平均百分率高达42.30%、PCR阳性平均百分率高达52.54%。在整个电击转化的过程中,通过细胞的预处理和转化后细胞的恢复,利用PCR技术和激光共聚焦技术检测获得比较成功的转化体系,而该体系也在其他藻类中被证明。
电击转化参数是转化过程中最主要的影响因素之一,例如像细胞的细胞壁、电压的大小、质粒浓度的大小、细胞活力等。克服这些影响因素的障碍主要有两种方法。第一种就是改变细胞壁的通透性,来增加质粒DNA进入细胞的几率。本实验研究结果表明,改变细胞壁的通透性可以增加电转化的效率,特别是在甘露醇、山梨醇和HEPES[17-19]处理细胞和在有适当卡那霉素[20]筛选的条件下,可以获得较高的电击转化效率。第二种方法就是施加高电压的脉冲,这种方法可以增加细胞膜的通透性从而有效的转移质粒载体。我们结合这两种解决方法的影响因素,进行了相关的实验条件的优化,实验结果表明,电压、细胞培养周期、渗透剂浓度和渗透时间等对电转化效率起到重要作用。
细胞成功转化的另一个主要的影响因素是细胞的生长阶段,当细胞进入到对数期时,细胞对电压特别灵敏,容易受到电压的电击而死亡,但是存活下来的细胞却有较高的转化率[21]。为了证实生长周期对电击转化的电转化效率都要比对数期的要低,而在对数期时间段中,对数前期的电转化效率比对数后期要高。考虑到这过问题,我们在转化细胞的后期培养过程中加入卡那霉素进行培养而获得最大的电击转化效率。
有研究[22]表明,电转化需要较高浓度的渗透体系,例如用山梨醇、甘露醇处理细胞可以明显地改善细胞的转化效率。我们利用山梨醇和甘露醇的混合渗透体系,在0.1~0.2 mol/L之间都获得30%以上的转化效率。在有相同浓度的HEPES电击缓冲液条件下,电击转化效率也能达到30%以上。这很可能是山梨醇、甘露醇和HEPES对细胞的转化提供保护,降低了电击电压对细胞的损伤几率,这与以往在其他物种上的研究结果相似[8,23-25]。试验中使用渗透缓冲液和电击缓冲液处理了电击体系,增加了转化效率,也保证了实验的重复性。在我们的实验中,我们发现在不同的渗透剂浓度和不同的渗透处理时间上,细胞的转化效率随浓度和时间的改变呈递减趋势,符合变化趋势。而电击缓冲液浓度处理的细胞的转化效率是先增加后下降最后又上升,这结果经三次重复实验验证。
本实验的研究结果表明,质粒质量浓度对电转化效率似乎有着不一样的敏感性,质粒可以被轻松的转化进入到细胞中。质粒质量浓度从2 μg/mL到10 ug/mL变化时,电转化效率呈先上升后下降的趋势,或者是呈下降趋势。这可能是在电击转化体系中对细胞存活有一些影响而造成[26-28]。而我们的实验结果刚好和已报道的结果[29]相反,我们的实验结果是随着质粒质量浓度的上升,电转化效率也上升,造成这样的原因可能是渗透处理过的细胞在电压导流下比较容易进入到细胞中,再者就是没有必要进行感受态的制备,有的报道中也证实质粒DNA是伴随着电流进入细胞的[16,19,27,30-32],这与我们的实验结果相似。本实验的反应体系中除含有处理细胞核质粒DNA之外,我们还加入渗透缓冲液和电击缓冲液,使得质粒DNA能够以稳定的转化进入到细胞中,从而获得比较高的转化效率。我们实验获得了一个比较优化的转化体系,能够获得较高遗传转化效率的菌株。同时我们将转化的藻株进行传代培养的遗传稳定性的研究,研究结果表明,HLF基因可以在转化藻细胞中保存六个月以上。
我们首次在单细胞的沙漠小球藻上建立了比较完整的遗传转化体系,对沙漠小球藻而言,这样高效和可重复的转化体系还是非常少见。我们在试验中获得电击转化的最佳组合和相关的转化体系,该体系简单、方便、节约时间,更重要的是该转化体系可以扩展到其他藻类遗传转化研究中。我们希望优化改造的电击转化体系可以运用到藻类的经济开发和遗传转化研究方面。

