CEUS定性分析诊断不同大小甲状腺良恶性结节
李 鑫,杜联芳,李 凡,邢晋放,史秋生,高 峰
(上海交通大学附属第一人民医院超声科,上海 200080)
常规超声是甲状腺结节的首选检查方法。随着高分辨力超声的应用,甲状腺结节的检出率达68%[1],其中约5%~15%为恶性结节,与良性结节的常规超声表现存在交叉,常需细针穿刺细胞学(fine needle aspiration biopsy, FNAB)进一步明确,但仍有约10%~20%甲状腺结节不能确诊[2]。CEUS可作为FNAB鉴别甲状腺结节良、恶性的重要补充[3]。CEUS定性分析鉴别甲状腺结节良恶性具有更高的敏感度及特异度[3],且甲状腺结节CEUS特征与结节大小密切相关[4]。本研究探讨CEUS定性分析鉴别诊断不同大小甲状腺良恶性结节的价值。
1 资料与方法
1.1一般资料 收集2015年12月—2017年6月于我院接受甲状腺CEUS检查的255例甲状腺结节患者(共329个结节),男44例,女211例,年龄20~80岁,平均(48.0±12.6)岁;纳入结节均为实性,最长径0.5~4.7 cm,平均(1.29±0.82)cm,经FNAB或手术切除后获得病理结果;根据结节大小,将其分为小结节组(最长径≤1 cm,n=166)和大结节组(最长径>1 cm,n=163)。排除标准:①常规超声探查结节为囊性或囊实性;②对造影剂过敏或严重心肺功能障碍等CEUS禁忌证;③妊娠或哺乳期妇女;④年龄≤18岁。本研究经本院伦理委员会审核通过,患者均签署知情同意书。
1.2仪器与方法 采用Philips iU Elite超声诊断仪,常规超声探头为L12-5,频率5~12 MHz;CEUS探头为L9-3,频率3~9 MHz,机械指数(mechanical index, MI)0.08。嘱患者仰卧,头部后仰,充分暴露检查区域,检查过程中嘱患者平静呼吸,并尽量避免吞咽动作。首先对结节进行常规超声检查,记录结节最大径、部位、回声、血流等特征;随后启动造影模式,选择结节血流最丰富切面,同时显示结节周围正常甲状腺组织。经肘静脉团注2.0 ml造影剂(声诺维),同时观察并记录2 min造影图像。造影过程中探头位置保持固定,不对结节施压。所有操作均由同1名具有3年以上甲状腺CEUS工作经验的医师完成。
1.3图像分析 由2名具有5年以上甲状腺CEUS诊断经验的医师在不知晓病理结果及临床资料的前提下独立分析图像,结论不一致时与另1名具有10年以上甲状腺CEUS诊断经验的医师商议后得出最终结论。首先观察结节增强程度(无增强、低增强、等增强、高增强),排除无增强结节。评价指标包括增强方式(向心性、离心性、弥漫性、偏心性、环状)、增强达峰时结节边界(清晰、不清晰)、增强达峰时结节形态(规则、不规则)、增强达峰时是否充填完全(完全、不完全)、增强均匀性(均匀、不均匀)以及增强后结节大小(减小、不变、增大)。根据文献[5]方法对甲状腺结节的CEUS特征进行赋值评分(表1),将各项评分相加,得到甲状腺结节的总评分。

表1 甲状腺结节CEUS特征评分标准
1.4统计学分析 采用SPSS 20.0统计分析软件。以χ2检验分别比较大结节组和小结节组甲状腺良恶性结节CEUS特征差异。对2组甲状腺结节CEUS评分分别绘制ROC曲线,评价其鉴别诊断甲状腺结节良恶性的效能。P<0.05为差异有统计学意义。
2 结果
小结节组166个结节中,良性结节71个,其中病理证实结节性甲状腺肿34个、桥本甲状腺炎伴结节性增生8个、亚急性甲状腺炎1个,FNAB诊断考虑良性结节19个、桥本甲状腺炎伴结节性增生7个、良性结节伴陈旧性出血2个;恶性结节95个,全部为乳头状癌,其中手术病理证实79个,FNAB诊断16个。大结节组163个结节中,良性结节111个,手术病理证实结节性甲状腺肿56个、桥本甲状腺炎伴结节性增生19个、滤泡状腺瘤5个,FNAB诊断良性结节24个、桥本甲状腺炎伴结节性增生7个;恶性结节52个,均为乳头状癌,手术病理证实42个、FNAB诊断10个。
2.1甲状腺良恶性结节CEUS特征分析
2.1.1小结节组 2个良性结节因CEUS表现为无强化而排除。甲状腺良恶性结节的增强程度、增强方式、增强达峰时结节边界、增强达峰时结节形态及增强均匀性差异均有统计学意义(P均<0.001),增强达峰时是否充填完全及增强后结节大小差异无统计学意义(P均>0.05),见表2。恶性甲状腺结节主要表现为低增强(74/105,70.48%)、向心性增强(69/85,81.18%)、增强达峰时结节边界不清(90/113,79.65%)、增强达峰时结节形态不规则(90/121,74.38%)和不均匀增强(79/110,71.82%),见图1。
2.1.2大结节组 4个良性结节因CEUS表现为无强化而排除。甲状腺良恶性结节7项造影特征评价指标差异均有统计学意义(P均<0.05),见表3。恶性甲状腺结节主要表现为低增强(33/51,64.71%)、向心性增强(30/33,90.91%)、增强达峰时结节边界不清(44/59,74.58%)、增强达峰时结节形态不规则(51/66,77.27%)、不均匀增强(45/59,76.27%)、增强达峰时结节不完全充填(31/42,73.81%)及增强后结节增大(37/43,86.05%),见图2、3。
2.2CEUS评分鉴别诊断甲状腺良恶性结节的效能 小结节组中,以CEUS评分>3.5分诊断甲状腺恶性结节的敏感度、特异度、准确率分别为77.90%、84.06%、78.66%,AUC为0.889(P<0.001),95%CI为(0.840,0.937),见图4。大结节组中,以CEUS评分>2.5分诊断甲状腺恶性结节的敏感度、特异度、准确率分别为90.40%、76.60%、81.13%,AUC为0.910(P<0.001),95%CI为(0.856,0.964),见图5。
3 讨论
CEUS在肝脏等实质器官中的应用已得到广泛认可[6],但用于甲状腺疾病尚处于起步阶段,尤其对鉴别诊断良恶性甲状腺结节,目前尚无统一标准[3,7-8]。甲状腺结节的CEUS特征与其大小密切相关[9]。本研究以最长径1 cm为界,将甲状腺结节分为小结节组和大结节组,分别讨论其CEUS特征及其诊断良恶性结节的价值。
本研究结果表明,不同大小甲状腺恶性结节的共同CEUS特征表现为低增强、向心性增强、增强达峰时结节边界不清、增强达峰时结节形态不规则和不均匀增强。低增强可能与甲状腺乳头状癌内部形成动静脉瘘、微血管狭窄或闭塞以及微血管处于不完全开放状态有关[10-11]。恶性结节边缘区通常新生血管密度较高,而中心的新生血管相对稀疏,可能导致恶性结节的向心性增强及灌注不均匀[10]。造影能够清晰显示恶性结节内部及周边血流灌注,易于观察伸入恶性结节内部或向周边浸润的滋养血管,以及由此导致的增强后结节边界不清、形态不规则[12]。
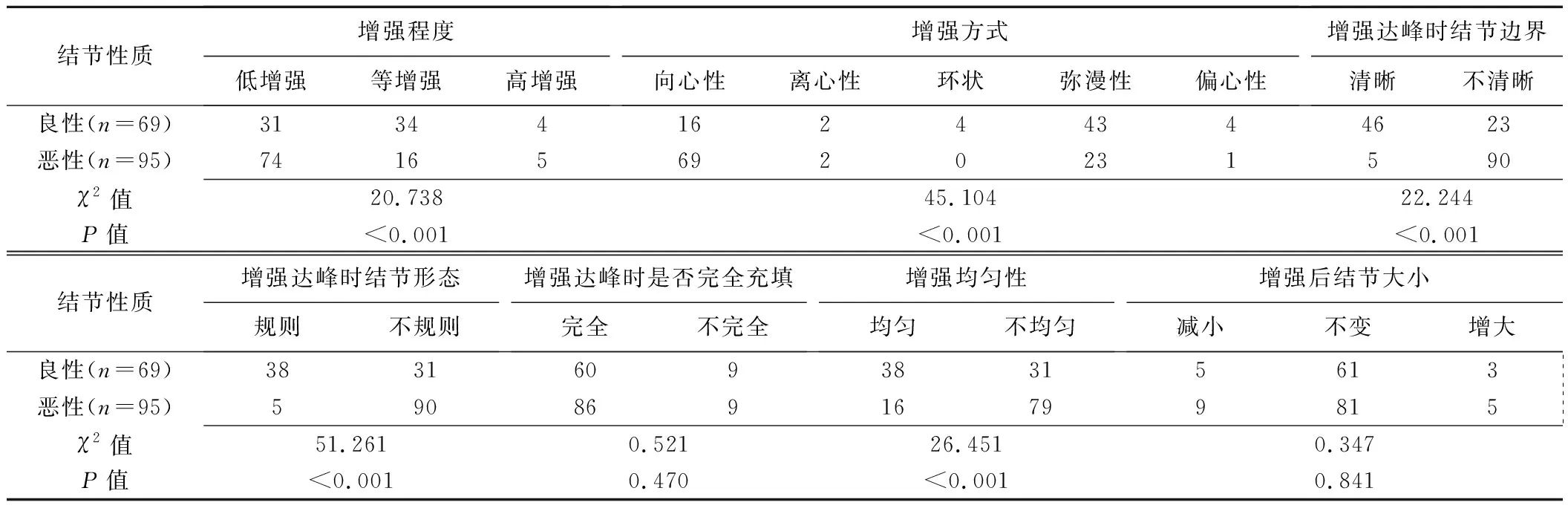
表2 小结节组甲状腺良恶性结节CEUS特征比较(个)
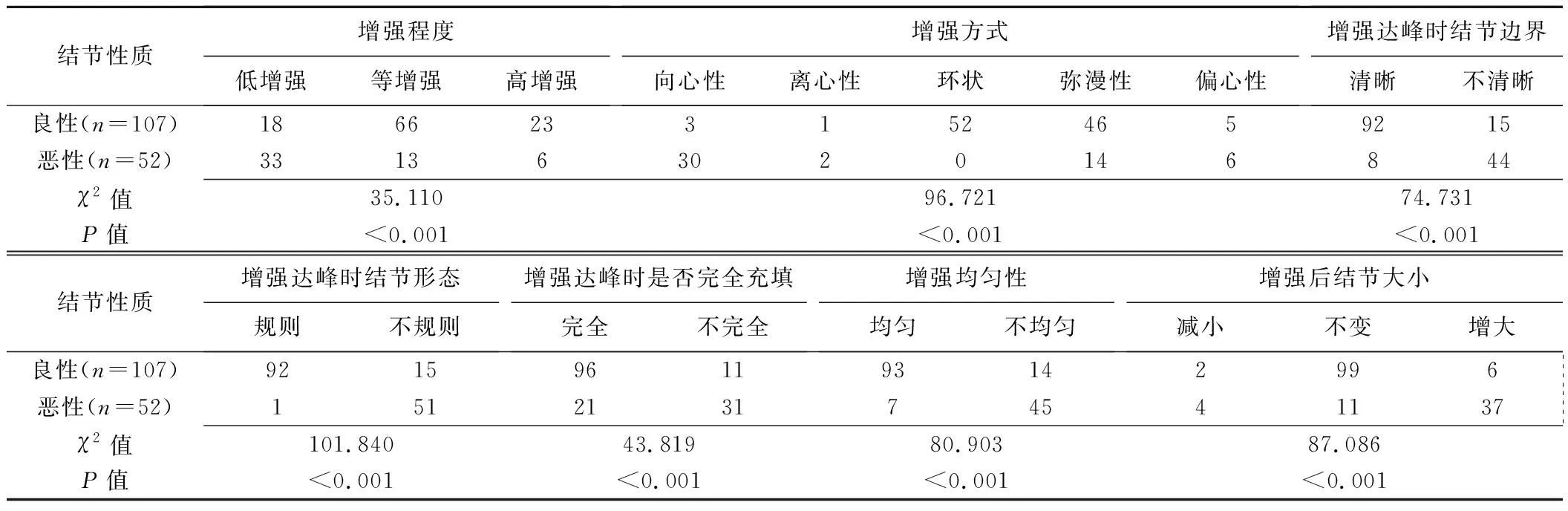
表3 大结节组甲状腺良恶性结节CEUS特征比较(个)
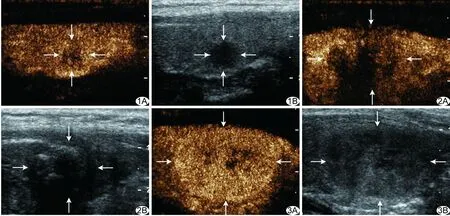
图1 患者女,25岁,甲状腺结节最长径0.78 cm,甲状腺乳头状癌 A.CEUS图像,增强达峰时结节表现为低增强、边界不清,形态不规则,增强不均匀(箭); B.灰阶图像(箭示甲状腺结节) 图2 患者女,54岁,甲状腺结节最长径2.14 cm,甲状腺乳头状癌 A.CEUS图像,增强达峰时结节表现为低增强、边界不清,形态不规则,增强不均匀,充填不完全,较增强前增大(箭); B.灰阶图像(箭示甲状腺结节) 图3 患者男,54岁,甲状腺结节最长径2.60 cm,滤泡状腺瘤 A.CEUS图像,表现为环状增强(箭); B.灰阶图像(箭示甲状腺结节)
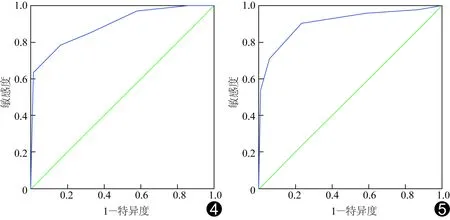
图4 小结节组CEUS评分诊断甲状腺良恶性结节的ROC曲线 图5 大结节组CEUS评分诊断甲状腺良恶性结节的ROC曲线
本研究大结节组甲状腺恶性结节CEUS特征还表现为增强达峰时不完全充填及增强后结节增大,原因可能是随着肿瘤增大,易受周围结缔组织挤压,使血管扭曲、变形,血流不畅[13]。最长径>1 cm甲状腺乳头状癌易发生坏死、纤维化及钙化[13-14],表现为造影剂充填不完全,出现灌注缺损区。此外,肿瘤生长是肿瘤细胞不断增殖、浸润的过程,随肿瘤增大,向周围组织浸润的范围增大,更易突破甲状腺包膜侵犯甲状腺周围组织,使得大结节组恶性结节增强后表现为结节增大。
Wu等[15]认为无强化多见于囊变或出血吸收导致皱缩的甲状腺结节及少部分甲状腺癌。本研究小结节组中2个无强化结节,FNAB结果为甲状腺良性结节伴陈旧性出血;大结节组4个无强化结节,术后证实为结节性甲状腺肿伴纤维化钙化及骨化,其声像图表现为结节内钙化长径较长并位于结节表面,后方伴声影,由于声影影响,导致增强后结节表现为无强化。
本研究对CEUS特征进行赋值评分,小结节组诊断良恶性的AUC为0.889(P<0.001),大结节组AUC为0.910(P<0.001),提示其诊断价值较高。CEUS评分诊断大结节组中恶性甲状腺结节的敏感度(90.40%)和准确率(81.13%)较高,特异度(76.60%)较低,对小结节组则特异度较高,提示CEUS诊断不同大小甲状腺结节的能力有所侧重,临床应用时需全面考虑。
本研究的不足在于恶性结节中仅有甲状腺乳头状癌,缺少其他病理类型甲状腺癌,可能对统计学结果有所影响,今后可纳入不同类型甲状腺癌进一步研究。

