Survivin- siRNA敏感肿瘤株的筛选及其侵袭和迁移的作用机制研究
周伟华
(宜春学院 化学与生物工程学院,江西 宜春 336000)
恶性肿瘤是当今威胁人类生命健康的主要杀手之一,并且恶性肿瘤的治疗是长期困扰医学界的世界性难题。Survivin基因是近年新发现的凋亡抑制蛋白(Inhibitor of apoptosis protein,IAP)家族成员,在肿瘤发生、发展中起关键作用,在肿瘤细胞及胚胎组织中呈高表达,而在成人绝大多数正常组织中被关闭而很少表达[1- 3]。RNA干扰技术是近几年兴起的生物技术,用小分子干扰RNA(siRNA)干扰特定基因的表达是基因治疗的重要组成部分。本研究运用RNA干扰技术和抗肿瘤药物筛选平台,设计筛选高效的靶向Survivin基因的抗肿瘤siRNA前体药物,并探讨其抑制肿瘤细胞侵袭和迁移的分子机制。
1 材料与方法
1.1 材料
1.1.1 肿瘤细胞株 非小细胞肺癌细胞株H1299、肝癌细胞株SMMC- 7721、甲状腺癌细胞株8505C、乳腺癌细胞株MCF- 7、结肠腺癌细胞株HCT- 116、食管癌细胞株EC109,均由中科院上海生命科学研究院细胞库提供。
1.1.2 主要药品与试剂 Survivin siRNA脂质体(1 mg·L-1),由本课题组制备。RPMI- 1640培养基(美国Invitrogen Gibco公司),四甲基偶氮唑盐(MTT)、胰蛋白酶、Trizol试剂(美国Sigma公司),逆转录试剂盒、实时荧光定量PCR试剂盒(大连TaKaRa公司),Survivin抗体、基质金属蛋白酶- 9(matrix metalloproteinases- 9,MMP- 9)抗体和粘着斑激酶(focal adhesion kinase,FAK)抗体(英国Abcam公司),胎牛血清、β- actin抗体、HRP- 羊抗鼠IgG、ECL Prime蛋白印迹试剂(上海碧云天生物公司)。Survivin、MMP- 9、FAK和GAPDH引物序列均由上海捷瑞生物工程有限公司合成,引物序列及产物长度见表1。
表1引物序列和产物长度

名 称序列产物长度/pbSurvivin正向引物:5'-GACAGATGAAGGTTGGG-3'反向引物:5'-AGGTGGATGAGGAGACAGA-3'228MMP-9正向引物:5'-AAATGTGGGTGTACACAGGC-3'反向引物:5'-TTCACCCGGTTGTGGAAACT-3'310FAK正向引物:5'-TTGCGGAGAATATGGCTGAC-CTAA-3'反向引物:5'-TGGTATTGATGGCAAAGCCCGT-TC-3'116GAPDH正向引物:5'-CGTTGACATCCGTAAAGACCTC-3'反向引物:5'-TAGGAGCCAGGGCAGTAATCT-3'110
1.1.3 主要仪器 低温离心机(德国Eppendorf公司),超微量分光光度计(美国Molecular Devices公司),定量PCR仪、Western blotting电泳仪、凝胶成像分析系统(美国BIORAD公司),Fluor Chem Q蛋白印迹成像和定量分析系统(美国Alpha公司)。
1.2 方法
1.2.1 Survivin siRNA脂质体的制备 根据Invitrogen公司的网上设计系统(http:www.invitrogen.com)进行Survivin基因的siRNA片段设计。Survivin- siRNA序列的正义链为5′- GAAGCAGUUUGAAGAAUUATT- 3′,反义链为5′- UAAUUCUUCAAACUGCUUCTr- 3′。Survivin- siRNA序列均由杭州四季青生物工程公司制备。在搅拌条件下将siRNA加入阳离子脂质、二硬脂酰磷脂酰胆碱、胆固醇和聚乙二醇(4∶1∶4∶1)混合物,超声10 min,形成Survivin- siRNA脂质体(1 mg·ml-1)。
1.2.2 肿瘤细胞的培养 从液氮中取出冻存的H1299、SMMC- 7721、8505C、MCF- 7、HCT- 116和EC109细胞株,复苏后转入培养瓶,用含10%(V/V)胎牛血清的RPMI 1640培养基于5%CO2、37 ℃条件下培养,每48 h更换1次培养基,当细胞长满90%时进行消化、传代,取第3代细胞用于实验。
1.2.3 MTT法筛选Survivin- siRNA的敏感肿瘤菌株 取对数生长期的H1299、SMMC- 7721、8505C、MCF- 7、HCT- 116和EC109细胞,常规消化,离心,重悬细胞并调整至1×105个·ml-1,加入96孔培养板,每孔100 μl。在细胞培养箱中培养24 h使细胞贴壁后,在各培养孔分别加入不同浓度的Survivin- siRNA脂质体,终浓度分别0.1、0.3、1.0、3.0、10.0、30.0和100.0 μg·ml-1,每个浓度设6个平行孔,同时设阴性对照组为等体积空白脂质体。继续培养48 h后每孔加入5 mg·ml-1MTT溶液20 μl,继续培养4 h后弃上清液,加DMSO 150 μl·孔-1,振荡溶解15 min,立即用分光光度计测定在570 nm波长处的吸光度(A)值,计算细胞生长抑制率。选择对Survivin- siRNA最敏感的肿瘤株8505C进行后续试验。
1.2.4 癌细胞迁移实验 在培养板加入甲状腺癌细胞株8505C 1×105个·孔-1,培养至细胞铺满单层。用100 μl移液枪头沿培养板底部垂直划线,用PBS冲洗,分别加入不同浓度的Survivin- siRNA脂质体,终浓度分别为1.0、3.0和10.0 μg·ml-1,同时设阴性对照组为等体积空白脂质体,培养24 h后拍照,测量间距。各组设6个复孔。
1.2.5 癌细胞侵袭实验 制备Transwell小室(上室),加入100 μl密度为105个·ml-1对数生长期的8505C细胞,将上室放入细胞培养板孔(下室)。下室加入含10%胎牛血清的RPMI 1640培养基,分别加入不同浓度Survivin- siRNA脂质体,终浓度分别为1.0、3.0和10.0 μg·ml-1,同时设阴性对照组为等体积空白脂质体。培养24 h后取出上室,用棉签将上室内细胞刮除,用多聚甲醛固定,染色,双蒸水冲洗上室,在相差显微镜下进行细胞计数。各组设6个复孔。
1.2.6 RT- PCR实验 在培养板加入甲状腺癌细胞株8505C 1×105个·孔-1,各孔分别加入不同浓度Survivin- siRNA脂质体,终浓度分别为1.0、3.0和10.0 μg·ml-1,同时设阴性对照组为等体积空白脂质体。将96孔板置于5 % CO2、37 ℃培养箱内培养48 h。Trizol提取细胞总RNA,用超微量分光光度计测定260和280 nm的吸光度值,以RNA电泳检测其完整性。取总RNA进行cDNA合成。采用RT- PRC仪测定Survivin、MMP- 9和FAK mRNA的表达水平。PCR反应条件:95 ℃预变性5 min,98 ℃变性10 s,58 ℃退火30 s,72 ℃ 30 s,循环35次,72 ℃延伸10 min。Survivin、MMP- 9和FAK mRNA表达量以内参物GAPDH的相对定量表示。
1.2.7 Westen blotting实验 在培养板加入甲状腺癌细胞株8505C 1×105个·孔-1,各培养孔分别加入不同浓度Survivin- siRNA脂质体,终浓度分别为1.0、3.0和10.0 μg·ml-1,同时设阴性对照组为等体积空白脂质体。各组细胞分别培养48 h,收集细胞,加入RIPA裂解液,冰浴,离心,取上清液测定蛋白浓度。制备SDS- PAGE凝胶,加样后电泳,电转至PVDF膜上,脱脂奶粉室温封闭2 h,加入Survivin、MMP- 9和FAK抗体,4 ℃过夜,TBST缓冲液洗膜,加入HRP- 羊抗鼠IgG,25 ℃孵育1 h,洗膜,显色,显影。Survivin、MMP- 9和FAK的表达量以各自吸光度值与β- actin吸光度值比值表示。
1.3 统计学处理
采用SPSS 20.0进行数据分析,各组数据采用单因素方差分析。P<0.05为差异有统计学意义。
2 结 果
2.1 Survivin- siRNA对多种肿瘤细胞增殖的影响
Survivin- siRNA对H1299、SMMC- 7721、8505C、MCF- 7、HCT- 116和EC109细胞株均有一定程度的抑制作用,见图1。其中,Survivin- siRNA对8505C细胞株抑制作用最强(IC50=5.83 μg·ml-1),选择8505C细胞株为Survivin- siRNA敏感菌株进行后续研究。
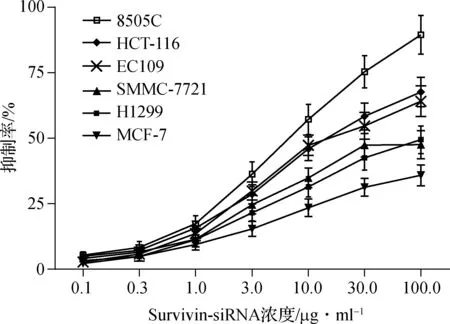
图1Survivin-siRNA对多种肿瘤细胞增殖的抑制作用(n=6)
2.2 Survivin- siRNA对甲状腺癌8505C细胞迁移的影响
在肿瘤细胞迁移实验中,1 μg·ml-1组和阴性对照组划痕刻度差异均无统计学意义(P>0.05);3 μg·ml-1组和10 μg·ml-1组划痕刻度较阴性对照组显著增大(P<0.01),并且10 μg·ml-1组划痕刻度较3 μg·ml-1组显著增大(P<0.05),见图2。

与阴性对照组比较,aP<0.05;与1.0 μg·ml-1组比较,bP<0.05;与3.0 μg·ml-1组比较,cP<0.01
图2Survivin-siRNA对甲状腺癌8505C细胞迁移的影响(n=6)
2.3 Survivin- siRNA对甲状腺癌8505C细胞侵袭的影响
在肿瘤细胞侵袭实验中,1 μg·ml-1组和阴性对照组穿膜细胞数量差异无统计学意义(P>0.05);3 μg·ml-1组和10 μg·ml-1组穿膜细胞数量较阴性对照组显著减少(P<0.05);并且10 μg·ml-1组穿膜细胞数量较3 μg·ml-1组显著减少(P<0.05),见图3。
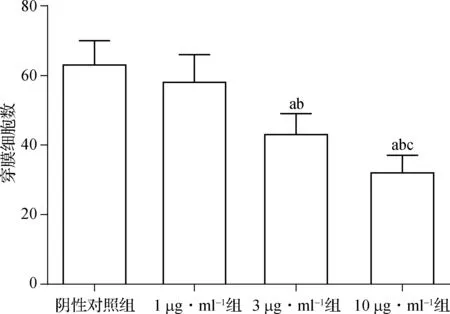
与阴性对照组比较,aP<0.05;与1.0 μg·ml-1组比较,bP<0.05;与3.0 μg·ml-1组比较,cP<0.01
图3Survivin-siRNA对甲状腺癌8505C细胞侵袭的影响(n=6)
2.4 Survivin- siRNA对甲状腺癌8505C细胞Survivin、MMP- 9和FAK mRNA表达的影响
在RT- PCR实验中,1 μg·ml-1组和阴性对照组Survivin、MMP- 9和FAK mRNA表达差异均无统计学意义(P>0.05);3 μg·ml-1组和10 μg·ml-1组Survivin、MMP- 9和FAK mRNA表达较阴性对照组显著降低(P<0.05);并且10 μg·ml-1组Survivin、MMP- 9和FAK mRNA表达较3 μg·ml-1组显著降低(P<0.05),见图4。
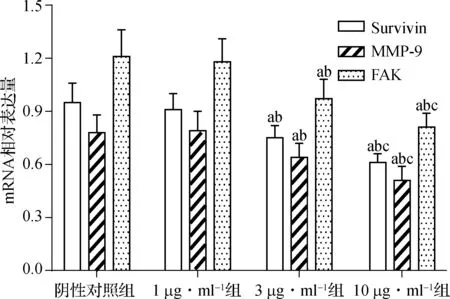
与阴性对照组比较,aP<0.05;与1.0 μg·ml-1组比较,bP<0.05;与3.0 μg·ml-1组比较,cP<0.01
图4Survivin-siRNA对甲状腺癌8505C细胞Survivin、MMP-9和FAKmRNA表达的影响(n=6)
2.5 Survivin- siRNA对甲状腺癌8505C细胞Survivin、MMP- 9和FAK蛋白表达的影响
在Western blotting实验中,1 μg·ml-1组和阴性对照组Survivin、MMP- 9和FAK蛋白表达差异均无统计学意义(P>0.05);3 μg·ml-1组和10 μg·ml-1组Survivin、MMP- 9和FAK蛋白表达较阴性对照组显著降低(P<0.05);并且10 μg·ml-1组Survivin、MMP- 9和FAK蛋白表达较3 μg·ml-1组显著降低(P<0.05),见图5。
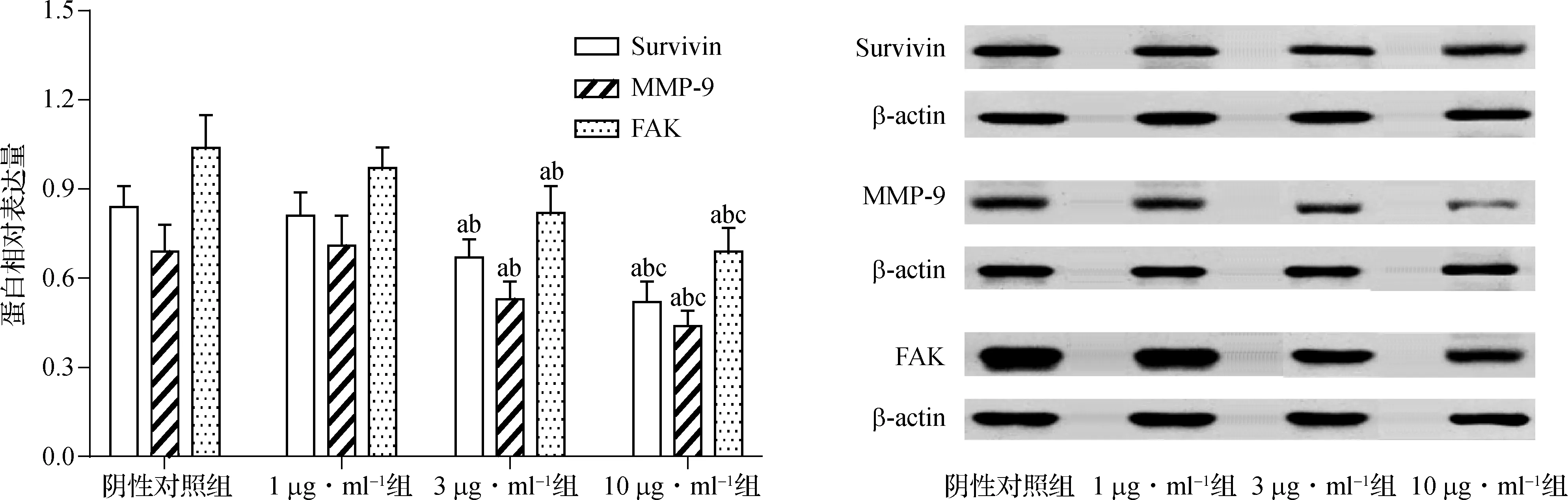
与阴性对照组比较,aP<0.05;与1.0 μg·ml-1组比较,bP<0.05;与3.0 μg·ml-1组比较,cP<0.01
图5Survivin-siRNA对甲状腺癌8505C细胞Survivin、MMP-9和FAK蛋白表达的影响(n=6)
3 讨 论
siRNA是近10年来分子生物学领域最突出的发现之一,siRNA技术不但是研究功能基因强有力工具,而且也是基因治疗行之有效的武器。应用siRNA技术干扰特定致病基因的表达是基因治疗的重要组成部分,这为某些恶性疑难疾病的治疗带来了新希望。国内外研究发现Survivin是肿瘤发生、发展中起关键作用的基因之一,该基因在肿瘤细胞中表达水平异常升高,而在成人绝大多数正常组织中被关闭。该基因在肿瘤细胞中高表达后不仅促进细胞抗凋亡[4]、加速细胞有丝分裂[5],还增加肿瘤细胞对放化疗的耐受性[6],促进肿瘤组织血管的形成。靶向该基因的抗肿瘤基因治疗药物的毒副作用可能较小,安全性较好。本研究在H1299、SMMC- 7721、8505C、MCF- 7、HCT- 116和EC109细胞株中筛选对Survivin- siRNA敏感的菌株,结果显示Survivin- siRNA对上述6种肿瘤细胞株均有一定程度的抑制作用,但是Survivin- siRNA对8505C细胞株抑制作用最强。因此将Survivin- siRNA的目标肿瘤锁定为甲状腺癌,选择8505C细胞株为Survivin- siRNA敏感菌株进行后续研究。
侵袭和迁移是甲状腺癌治疗失败的最常见原因,也是肿瘤细胞转移的原因。侵袭是肿瘤细胞降解细胞外基质向局部临近组织的浸润,而转移是肿瘤细胞突破血管膜或淋巴管膜并在其他器官生长。在癌细胞迁移实验中,3 μg·ml-1和10 μg·ml-1Survivin- siRNA划痕刻度较阴性对照组显著增大(P<0.01),并且10 μg·ml-1组划痕刻度较3 μg·ml-1组显著增大(P<0.05),说明Survivin- siRNA可剂量依赖性抑制甲状腺癌8505C细胞的迁移;在癌细胞侵袭实验中,3 μg·ml-1组和10 μg·ml-1组穿膜细胞数量较阴性对照组显著减少(P<0.05),并且10 μg·ml-1组穿膜细胞数量较3 μg·ml-1组显著减少(P<0.05),说明Survivin- siRNA可剂量依赖性抑制甲状腺癌8505C细胞的侵袭。
细胞和细胞基质间的信号通路失衡是肿瘤细胞侵袭和转移的重要原因之一[7]。FAK是一种非受体酪氨酸激酶,其作为多条信号通路的上游分子广泛参与细胞的多种生物学过程。FAK活化后可通过细胞外信号调节激酶途径引起级联反应,促进细胞增殖、转移和侵袭,因此FAK的高表达与肿瘤的转移、侵袭有关[8- 9]。MMPs是一组降解细胞外基质(Extracellular Matrix,ECM)的锌离子依赖内肽酶,在肿瘤的生长、侵袭和转移中发挥至关重要的作用[10]。目前已确定的MMPs有26种,其中MMP- 9可降解ECM中的Ⅳ型以及Ⅴ型胶原纤维[11],参与肿瘤组织转移[12- 13]。本研究结果显示,3 μg·ml-1和10 μg·ml-1Survivin- siRNA可显著降低甲状腺癌8505C细胞中Survivin、MMP- 9和FAK mRNA和蛋白的表达,说明Survivin- siRNA抗甲状腺癌细胞侵袭和迁移的作用可能与其抑制Survivin、MMP- 9和FAK表达有关。
总之,Survivin- siRNA作为新型的抗肿瘤药物对甲状腺癌8505C细胞增殖具有较强的抑制作用,并且可以抑制8505C细胞的迁移和侵袭,这可能与其抑制细胞Survivin、MMP- 9和FAK的表达有关。

