Fe2O3@GO聚合物对水中As3+的吸附特性表征
邓天天,胡 烨,刘帅霞,李晗晟,侯宇梦
(河南工程学院资源与环境学院,河南 郑州 451191)
邓天天,胡烨,刘帅霞,等.Fe2O3@GO聚合物对水中As3+的吸附特性表征[J].生态与农村环境学报,2018,34(10):930-938.
DENG Tian-tian,HU Ye,LIU Shuai-xia,etal.Adsorption Characteristics of Fe2O3@GO Polymer to As3+in Water[J].Journal of Ecology and Rural Environment,2018,34(10):930-938.
在自然水体中,砷的主要存在形式为无机砷酸盐(AsO43-)和亚砷酸盐(AsO33-)[1]。其中三价砷由于其高毒性而被美国疾病控制中心和国际防癌研究机构同时确定为第1类致癌物[2]。近年来,由于砷在农药生产、化工等工业领域的广泛应用和不规范排放,造成部分地区水体和土壤的砷污染日趋严重,给当地居民的健康带来不可逆转的潜在危害。
吸附法简单易操作,适合浓度较低、水量较大的处理体系,并因其高效经济和无二次污染等优点成为水体砷污染处理的常用方法。常用的吸附剂有活性炭、矿物吸附剂、壳聚糖、生物吸附剂、工业废弃物、金属(氢)氧化物等[3]。而上述吸附剂存在吸附容量小、吸附效率偏低等缺陷,未能被广泛应用。近年来,铁基材料及其复合物由于其表面电荷高,比表面积大等特点对砷表现出较高的亲和力和去除效果[4]。在高浓度范围内,铁氧化物除了对砷酸盐有吸附作用,表面沉淀还可以促使砷酸盐在铁氧化物表面发生化学反应形成砷酸铁沉淀[5-6]。王强等[7]研究了赤铁矿(α-Fe2O3)对三价砷离子的吸附和氧化特征,显示Langmuir方程可以很好地表述吸附量与三价砷溶液初始浓度的关系,且根据拟合方程计算得到35 ℃条件下赤铁矿的最大吸附量为11.99 mg·g-1。石墨烯是近年来备受关注的一种碳基吸附材料,由于其具有独特的结构和性质引起了各领域科技工作者的广泛关注[8-9]。相比于传统材料,石墨烯依靠单层高达2 630 m2·g-1的比表面积[10-11]和丰富的孔隙结构成为新型的高效吸附材料。而氧化石墨烯(GO)是由石墨粉末先经化学氧化,再剥离至单层得到的产物,与石墨烯具有相同的特性。除此之外,氧化石墨烯薄片可以看作是在石墨烯的表面和边缘修饰了含氧官能团,这些含氧官能团使其具有良好的亲水性,能够通过与金属离子之间发生的富集作用,实现对水相中金属离子的去除。WANG等[12]在石墨烯的填充柱上填充双硫腙和铅的螯合物研究其吸附性能,在最佳实验条件下,对石墨烯、C18硅胶、石墨碳、多壁碳纳米管、单壁碳纳米管富集Pb2+的效果进行比较,其富集回收率分别为96.2%、57.1%、45.9%、75.8%和84.6%,显示了石墨烯优良的吸附性能。ZHAO等[13-14]将片状氧化石墨烯用于富集水相中的Pb2+和U6+,考察了溶液pH值、离子强度和温度等条件对富集率的影响,结果表明,在20、40和60 ℃时,片状氧化石墨烯对Pb2+的最大富集量分别为842、1 150和1 850 mg·g-1,对U6+的最大富集量则分别是97.5、111.7和185.9 mg·g-1,该材料对Pb2+和U6+的吸附量均显著高于其他吸附剂。
石墨烯基质复合材料是以石墨烯或氧化石墨烯与其他成分复合后制得的材料,这种材料可同时具备上述2种物质的优点。布林朝克等[15]以氧化石墨烯和铁盐为前驱体一步合成的部分还原氧化石墨烯-Fe3O4复合材料在中性溶液下5 min内即可实现对于200.09 mg·L-1镉溶液的吸附平衡,吸附率和吸附量分别为90.88%和363.99 mg·g-1;刘佩佩等[16]将氧化石墨烯和正硅酸乙酯作为原料,采用溶胶-凝胶法制备石墨烯/二氧化硅复合材料(GS),并使用液相还原法,以GS为基体负载零价纳米得到复合体,作为吸附剂对水中的As3+进行去除,其最大吸附量为55.93 mg·g-1;朝木尔乐格等[17]将氧化石墨作为载体,分别负载磁铁矿、赤铁矿和零价铁制得3种吸附材料,在弱酸性至中性条件下对As3+均表现出较好的吸附效果。尽管以石墨烯或氧化石墨烯的复合材料作为除砷吸附剂的研究已经开展,但目前尚处在初步阶段,针对水中As3+吸附特性相关研究较少。该研究主要为去除水中As3+,同时发挥铁氧化物和氧化石墨烯自身优点,将Fe2O3负载于氧化石墨烯上制备复合材料,并进行表征和吸附实验,对所制备的复合材料的吸附性能进行评估,探讨其特性及机理,以期找到一种新型高效的除砷吸附剂。
1 材料与方法
1.1 实验仪器与材料
实验仪器与试剂:NaAsO2·12H2O购于中国国家标准物质中心;硝酸铁、盐酸、硼氢化钾、抗坏血酸、硫脲等测试所需试剂均为优级纯,实验用水均为去离子水。
实验设备:in Via Reflex显微激光拉曼光谱仪(Renishaw);Quanta 250扫描电镜配备EDAX能谱仪(FEI);Nicolet 6700傅里叶红外光谱仪(Thermo Fisher);SA-20型原子荧光形态分析仪(北京吉天);868 pH酸度计(美国奥利龙);CS101电热鼓风干燥箱(重庆四达);ZD-85恒温往复振荡器(江苏友联);JP-C100超声波震荡仪(广州吉普)。
氧化石墨烯(GO)的制备:以48 μm粒径的天然鳞片石墨(先锋纳米)为主要原料,采用改良的Hummers法[18]制备得到GO,经盐酸与去离子水洗涤至pH=5~6后,冷冻干燥。称取适量的GO置于200 mL烧杯中,加入100 mL去离子水溶解搅拌至GO破碎,再将烧杯放入超声波振荡仪超声3次,每次20 min,得到ρ约为5~10 g·L-1的GO分散水溶液。
Fe2O3@GO聚合物的制备:将不同体积的0.2 mol·L-1Fe(NO3)3溶液在60 ℃持续搅拌下,逐滴加入到氧化石墨烯分散液中,持续搅拌2 h。在60 ℃陈化8 h后水洗离心,70 ℃干燥得到不同质量比的Fe2O3@GO聚合物[19]。
1.2 实验方法
1.2.1不同Fe/GO质量比对吸附效果的影响
配制ρ为10 mg·L-1的As3+溶液,向100 mL聚四氟乙烯瓶中分别加入所制备的负载铁含量不同的Fe2O3@GO聚合物各10 mg,再各加入配制溶液100 mL,置于温度为35 ℃的恒温摇床中振荡24 h,研究不同铁含量的复合材料对水中As3+的去除效果。
1.2.2吸附热力学实验
配制梯度浓度的As3+溶液,向100 mL的聚四氟乙烯瓶中分别加入10 mg GO或Fe2O3@GO聚合物,再依次加入所配制的不同浓度As3+溶液100 mL,置于温度为35 ℃的恒温摇床中振荡24 h后取样。
1.2.3吸附动力学实验
配置初始ρ为10 mg·L-1的As3+溶液,向100 mL的聚四氟乙烯瓶中分别加入10 mg GO或Fe2O3@GO聚合物,再加入所配制的10 mg·L-1的As3+溶液100 mL,置于35 ℃的恒温摇床中振荡,定时取样。
1.2.4不同pH值对吸附效果的影响
配制ρ为10 mg·L-1的As3+溶液,并用NaOH和HCl分别将其pH值调为3、4、5、6、7、8、9和10,向100 mL聚四氟乙烯瓶中分别加入10 mg GO或Fe2O3@GO聚合物,再加入调好pH值的As3+溶液,置于温度为35 ℃的恒温摇床中振荡24 h后取样。
1.2.5不同温度对吸附效果的影响
配制ρ为10 mg·L-1的As3+溶液,向100 mL的聚四氟乙烯瓶中分别加入10 mg GO或Fe2O3@GO聚合物,再加入100 mL配制的10 mg·L-1As3+溶液,置于温度为25 ℃的恒温摇床中振荡24 h后取样。在30、35、40、45和50 ℃条件下重复上述步骤。
1.3 分析及测试方法
取样后用0.45 μm孔径滤膜过滤,滤液经预处理后使用氢化物发生-原子荧光光度法测定As浓度。并计算吸附量和去除率。
吸附量的计算公式为
(1)
式(1)中,Qe为吸附平衡的吸附量,mg·g-1;C0和Ce为溶液的初始质量浓度和平衡质量浓度,mg·L-1;V为溶液体积,L;m为吸附剂的投加量,g。
去除率(η)的计算公式为
(2)
1.4 表征方法
实验采用扫描电子显微镜(SEM)、X射线能谱(EDAX)、傅里叶红外光谱(FTIR)以及拉曼(Roman)光谱对氧化石墨烯(GO)和Fe2O3@GO聚合物进行表征分析。
2 结果与讨论
2.1 不同Fe/GO质量比对As3+去除率的影响
图1为Fe与GO不同质量比对水中As3+去除效果的影响。从图中可以看出,As3+的去除率与复合物中Fe的质量比呈显著正相关。当Fe与GO质量比达到2∶1时,去除率高达90%,由此可见,Fe2O3的加入对吸附起到了一定的作用。相比单一氧化石墨烯作用是去除率增加了70%,这主要是因为铁氧化物与氧化石墨烯表面存在的含氧官能团络合生成铁(氢)氧化物,其结构中含有由羟基和铁离子组成的Fe—OH,由于质子的离解和缔合而带上正电[20]。砷酸根阴离子通过静电吸引与铁(氢)氧化物接近,产生了吸附作用[21]。其次,浓度较高时在铁氧化物表面还会形成表面沉淀作用,促使形成的砷酸铁沉淀。

图1 Fe与GO质量比对Fe2O3@GO聚合物吸附As3+效果的影响
2.2 等温吸附实验
为了比较2种材料对As3+的吸附容量,对其进行等温吸附实验,利用砷吸附量计算平衡吸附容量Qe和平衡浓度Ce的关系曲线,结果如图2所示。

Qe为平衡吸附量;Ce为溶液平衡浓度。
GO和Fe2O3@GO聚合物对As3+的吸附量都随着As3+浓度的增大而增加,平衡浓度达40 mg·L-1时,吸附量仍有上升趋势。对于初始浓度为10 mg·L-1的溶液,24 h后2种材料的吸附量分别达17.95和31.304 mg·g-1,其中Fe2O3@GO聚合物比GO提高了1.74倍。
吸附等温线指在一定温度下,溶质分子在液固两相进行的吸附过程达到平衡时在两相中的浓度之间的关系曲线。吸附等温模型中较常用的有Langmuir和Freundlich 2种模型[22]。
Langmuir等温吸附模型方程可表示为
(3)
式(3)中,Qe为平衡吸附量,mg·g-1;Qm为最大吸附量,mg·g-1;Ce为溶液平衡质量浓度,mg·L-1;kb为Langmuir吸附常数。
Freundlich等温吸附模型方程式可表示为
(4)
式(4)中,kf和n为Freundlich的无量纲常数。
用Langmuir模型和Freundlich模型分别对GO和Fe2O3@GO聚合物2种材料的数据进行拟合(图3,表1)。结果表明,2种材料均更符合Freundlich等温吸附模型,GO和Fe2O3@GO聚合物用Freundlich模型拟合的R2分别为0.990 8和0.974 0,表明这2种材料去除As3+时是在吸附剂的多相表面上进行的。kf是Freundlich模型中有关于吸附容量和吸附强度的常数,在一定程度上可作为吸附容量的指标;1/n则是Freundlich常数[23]。较大的Kf、n值是吸附剂具有良好吸附性能的表征。通过对比表1中2种材料的kf和n值,可以发现Fe2O3@GO聚合物的kf和n值均高于GO,即与GO相比,Fe2O3@GO聚合物吸附容量提高,吸附作用力也相对增强。
表1吸附等温方程的拟合参数
Table1Parametersofadsorptionisothermequations
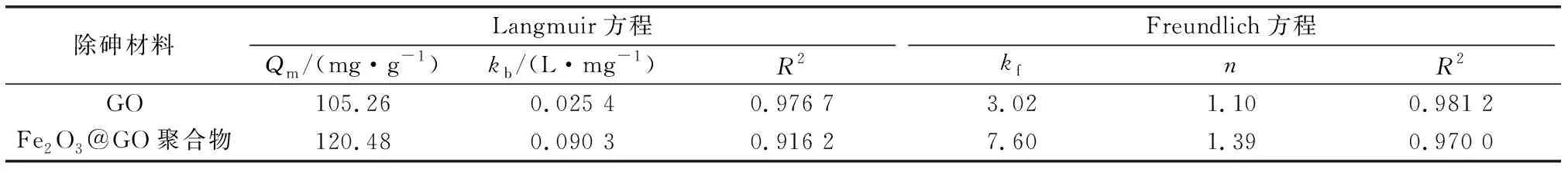
除砷材料Langmuir方程Freundlich方程Qm/(mg·g-1)kb/(L·mg-1)R2kfnR2GO105.260.025 40.976 73.021.100.981 2Fe2O3@GO聚合物120.480.090 30.916 27.601.390.970 0
Qm为最大吸附量,kb为Langmuir吸附常数,kf和n为Freundlich无量纲常数。

Qe为平衡吸附量;Ce为溶液平衡浓度。
2.3 吸附动力学实验
利用砷吸附量计算吸附容量Qt,并绘制吸附容量Qt和时间t的关系曲线,得到GO和Fe2O3@GO聚合物的吸附动力曲线(图4)。2种材料吸附As3+的动力学特性相似,其吸附含量均随时间增长而增大,前100 min吸附速率快,100~300 min速率减慢,300 min以后吸附含量开始趋于稳定,24 h达到吸附平衡。该研究采用准一级模型和准二级模型对GO和Fe2O3@GO聚合物2种材料的吸附速率数据进行拟合。
准一级动力学方程可表示为
ln(Qt-Qe)=lnQe-k1,
(5)
准二级动力学方程可表示为
(6)
式(5)~(6)中,k1和k2分别为准一级和准二级模型的速率常数;Qe为材料平衡吸附量,mg·g-1;Qt为t时刻单位质量材料对砷的吸附量,mg·g-1;t是吸附时间,h。
2种材料的拟合结果图5所示,拟合参数如表2所示。
Qe为平衡吸附量。
根据表2和图5可知,准二级动力学方程较准一级方程可以更准确地描述GO和Fe2O3@GO聚合物对As3+的吸附过程,其R2值分别达0.997 5和0.999 2,说明2种材料去除水中As3+的过程是准二级动力学反应。准二级模型真实表征了反应的外部液膜扩散、表面吸附和颗粒内扩散过程,同时说明吸附过程为物理吸附和化学吸附相结合的过程[24]。

Qe为平衡吸附量;Qt为t时刻单位质量材料的吸附量。
表2动力学拟合参数
Table2Parametersofkinetic

除砷材料准一级模型准二级模型k1/h-1Qt/(mg·g-1)R2k2/(mg·L-1·h-1)Qt/(mg·g-1)R2氧化石墨烯(GO)0.002 217.9500.638 20.007 117.9500.997 5Fe2O3@GO聚合物0.001 931.3040.669 40.005 931.3040.999 2
k1和k2分别为准一级和准二级模型的速率常数,Qt为t时刻单位质量材料对砷的吸附量。
2.4 溶液初始pH值对吸附的影响
图6为溶液初始pH值对GO和Fe2O3@GO聚合物吸附As3+的影响。GO对As3+的吸附量在15 mg·g-1左右,较其他吸附材料并不低,但是较Fe2O3@GO 聚合物相比吸附量仍有较大差距,且随pH值的变化不明显,中性或弱碱性条件下的吸附效果略高于强酸强碱环境,这主要是因为GO对水中As3+的吸附是以静电和范德华力物理吸附为主,因而受pH值影响较小[25]。而Fe2O3@GO聚合物对As3+的吸附效果明显优于GO,在pH值为8时达到最大吸附量34.6 mg·g-1。pH值在3~10范围内时,平衡吸附量呈现出随pH值增大而增大的趋势。初始pH值对吸附性能的影响是由于pH值对于As3+和聚合物中Fe的存在形态有一定影响。Fe在酸性条件下不易发生水解,在中性或碱性条件下则更容易生成Fe3+,随着pH值的升高,分子态H3AsO3的解离度增加,生成H2AsO3-浓度大大增加,更容易和带正电荷的Fe3+发生专性吸附生成沉淀[26],故吸附量增加。
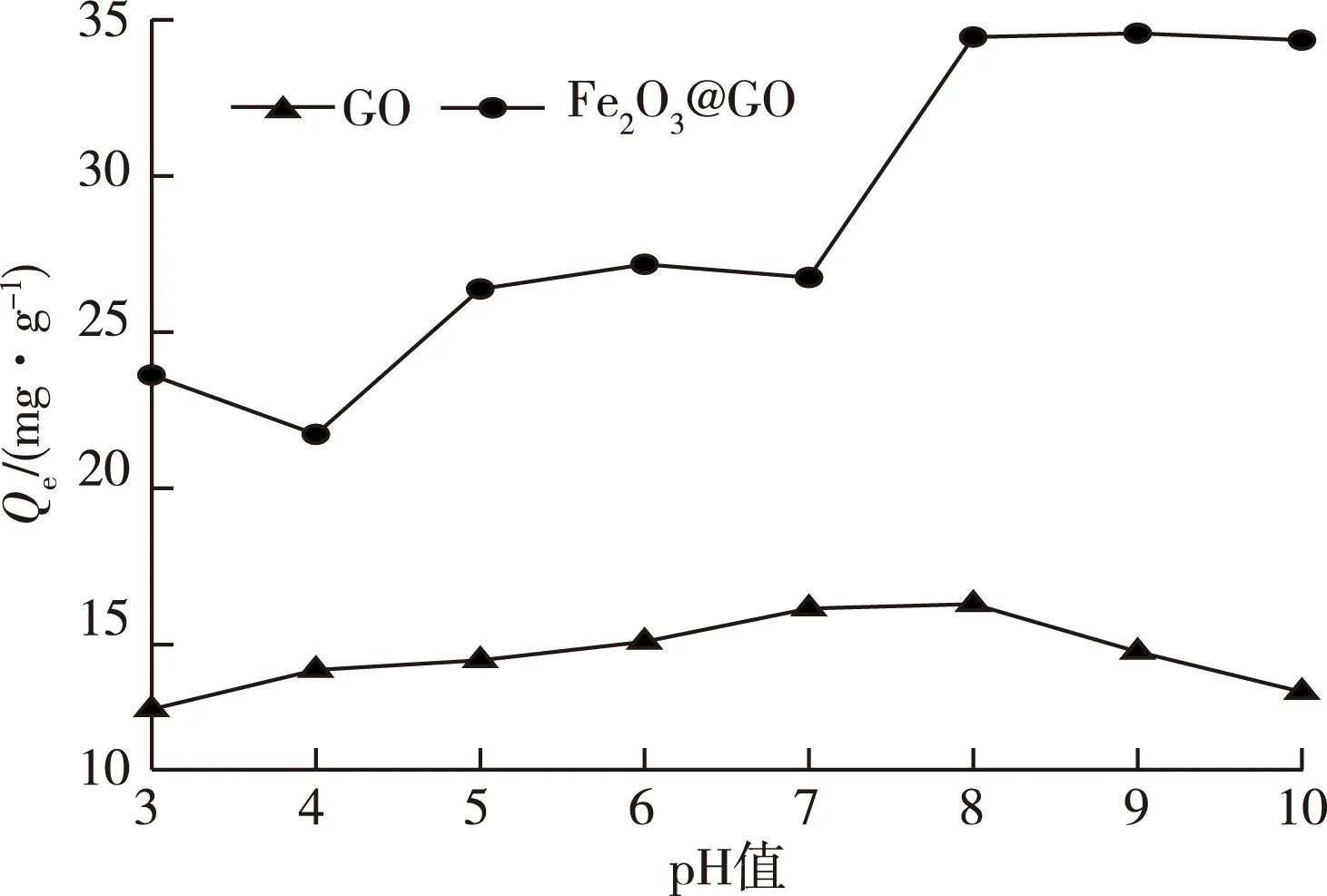
Qe为平衡吸附量。
2.5 温度对吸附的影响
图7为温度对GO和Fe2O3@GO聚合物吸附As3+的影响。温度从25 ℃上升到50 ℃,GO吸附量大体趋势为随着温度的升高而增大。而在25 ℃上升到40 ℃时,Fe2O3@GO聚合物吸附量随温度上升不断增大,40 ℃之后变化不大,只是稍有上升或下降,40 ℃时吸附量为30.738 mg·g-1。分子的热运动使分子运动随温度的升高而加剧,进而增大了砷酸根离子和亚砷酸根离子的活性,使其容易进入材料的微孔隙中,吸附量因此增加[27]。但同时温度过高也会使解吸能增大,导致吸附量下降[28]。
2.6 样品的表征
2.6.1扫描电子显微镜(SEM)分析
采用SEM对GO和Fe2O3@GO聚合物2种材料吸附砷前后的形貌特征进行分析(图8)。

Qe为平衡吸附量。

图8 GO和Fe2O3@GO聚合物吸附砷前后SEM对比图
GO吸附砷前为光滑平整的片层结构,片层的边缘有卷曲现象并且有明显的褶皱。SEM照片无法精确地表征GO的厚度,但根据片层边缘的卷曲程度与褶皱的宽度可以大致估测出其厚度为几到几十纳米[29]。GO的径厚较大,使得它在溶剂中呈现出自然褶皱的形貌,用于降低其较大的表面能。吸附后的GO表面粗糙且能明显看到表面有颗粒状物体附着,这表明砷在GO表面发生吸附反应。
图8 (c)是Fe2O3@GO聚合物吸附砷前的SEM照片,由于放大倍数缩小为1 000倍,可以看到折叠在一起呈阶梯状形貌的Fe2O3@GO聚合物较GO相比其表面变得粗糙,且在GO表面附有分散不均匀的纳米颗粒。吸附砷之后出现些许团聚现象且有大量胶体颗粒附着。与GO吸附后相比孔隙结构明显变少,说明在相同条件下Fe2O3@GO聚合物比GO吸附砷离子的量更多。
从表3可以看出,Fe2O3@GO聚合物的EDAX谱图中明显出现了铁的峰值。吸附砷后得到的2种材料都出现了相应含量的砷的峰值。由此可以看出,Fe2O3@GO聚合物已经负载一定量的铁,并且2种材料对砷都有吸附作用。
表3GO和Fe2O3@GO聚合物吸附砷前后EDAX
Table3EDAXofGOandFe2O3@GOpolymersbeforeandafteradsorptionofarsenic

样品名称COFeAsWt/%At/%Wt/%At/%Wt/%At/%Wt/%At/%GO吸附前53.3960.6046.4139.400000GO吸附后51.1264.1131.0029.18008.751.76Fe2O3@GO聚合物吸附前34.5549.5739.3342.3726.128.0600Fe2O3@GO聚合物吸附后38.9356.4729.3131.9215.484.836.761.57
Wt为质量百分数,At为原子百分数。
2.6.2拉曼光谱分析
拉曼光谱是一种可用来表征碳纳米材料的结构特征和性能的重要方法之一。在碳材料的拉曼光谱中,一般都含有2个显著的拉曼峰。一个是sp2碳原子的E2g振动所形成的G峰(1 580 cm-1),代表有序的sp2键结构;另一个是位于石墨烯边缘的缺陷及无定形结构产生的D峰(1 350 cm-1)[30]。通常用D峰和G峰的强度之比(ID/IG)评价纳米碳材料的石墨化程度,ID/IG比值越大,表明石墨的氧化程度越高[31]。除此之外,对于石墨烯材料,拉曼光谱中还有其他2个微弱的峰,分别是位于2 700 cm-1左右的2D峰和2 900 cm-1左右的D+G峰[32]。
对氧化石墨烯(GO)材料进行拉曼光谱分析,结果如图9所示。碳材料普遍含有的D峰和G峰分别出现在1 354和1 569 cm-1处,而石墨烯材料所特有的2D峰和D+G峰分别出现在2 718和2 913 cm-1,符合石墨烯的拉曼光谱。从图9(b)可知,在500~750 cm-1处出现的是Fe—O键的伸缩震动形成的,而300~450 cm-1处是砷与表面含氧官能团结合形成的As—O键而产生的峰值。

图中数值表示强度。
2.6.3傅里叶红外光谱(FTIR)分析


图10 GO和Fe2O3@GO聚合物的红外吸收光谱
3 结论
使用制得的GO和Fe2O3@GO聚合物分别进行溶液中As3+的一系列吸附实验,并分析其两者的吸附特性,得到如下结论:
(1)与GO相比,相同条件下Fe2O3@GO聚合物吸附容量更大,说明Fe2O3的加入提高了GO对As3+的吸附效果,并同时发挥了GO和Fe2O3的优点。
(2)2种材料的吸附等温线均符合Freundlich等温吸附模型,且Fe2O3@GO聚合物的性能与GO相比更好,动力学曲线则遵从准二级动力学模型。
(3)反应温度对GO和Fe2O3@GO聚合物吸附As3+的影响趋势相同,先随温度升高吸附量增加,达到某一温度后稍有下降。pH值对GO吸附As3+影响不大,而Fe2O3@GO随pH值升高吸附量显著增大,在弱碱性条件更有利于吸附过程的发生。

