液相色谱-串联质谱法分析葡萄中农药残留的 基质效应评价
王娇,齐沛沛,刘之炜,周莉,汪志威,王祥云,徐浩,狄珊珊,王强,王新全
(浙江省农业科学院 农产品质量标准研究所,浙江 杭州 310021)
农药的使用在葡萄生产中具有防治病虫害、提升产量和改善产品品质等重要作用,但随之而来的农药残留问题也使农药的使用备受争议[1-2]。为了保证葡萄质量安全,灵敏、准确的农药残留检测技术必不可少。目前,常用的葡萄中农药残留检测技术有色谱、色谱-质谱联用[3-5]等方法。其中,液相色谱-串联质谱法(LC-MS/MS)具有高灵敏度、高选择性和高通量分析的优势,但普遍存在的基质效应却对精准定量存在影响。为了提高分析结果的精准度,越来越多的研究致力于降低或消除基质效应[6-10]。因此,本研究针对葡萄中常用农药(含植物生长调节剂),评价不同农药残留样品前处理技术,联合液相色谱-串联质谱法分析不同种类葡萄样品时药物的基质效应差异。选用农药品种26种,包括杀虫剂、三唑类杀菌剂和植物生长调剂,分别为啶虫脒、吡虫啉、噻虫嗪、多菌灵、克百威、灭多威、咪鲜胺、嘧霉胺、除虫脲、氟啶脲、苯醚甲环唑、多效唑、戊唑醇、腈菌唑、氟硅唑、丙环唑、戊菌唑、三唑醇、已唑醇、噻嗪酮、矮壮素、氯吡脲、1-萘乙酸、噻菌灵、烯酰吗啉、炔螨特。选用色泽差异显著的葡萄品种5种,分别为白罗莎里奥(浅)、阳光玫瑰(浅)、新雅(深)、新郁(深)及09-142(深)。分别选择代表性检测方法QuChERS和GB/T 20769—2008进行样品前处理和分析,以评价不同葡萄品种的基质效应。
1 材料与方法
1.1 试剂与材料
LC-30A超高效液相色谱仪(日本Shimadzu公司);AB-SCIEX 4500三重四极杆质谱联用仪(美国AB公司);台式离心机(美国Thermo公司);旋转蒸发仪(瑞士BUCHI公司);Filter Unit滤膜(0.22 μm)、Carb-NH2SPE柱(Agela Technologies公司)。氯化钠、无水硫酸镁等均为分析纯;甲醇、乙腈、甲苯(色谱纯,美国Merck 公司);甲酸铵(HPLC级,美国Tedia公司);商品化PSA、C18 (美国Agela Technologies公司);实验用水为超纯水。26种农药分析标准品购于上海农药研究所或农业部环境保护科研监测所。
单标储备液。各分析标准品分别溶解于甲醇中,各配置成一定浓度的单标储备液。
混合标准溶液。分别准确移取一定量的单标储备液于25 mL容量瓶中,混匀,甲醇定容。
1.2 QuChERS方法的样品前处理过程
称取葡萄样品(10.00±0.05) g于50 mL离心管中,准确加入10 mL乙腈,涡旋1 min,然后加入1.5 g NaCl和4 g无水MgSO4,涡旋1 min,在7 000 r·min-1条件下离心3 min,取上清液净化。准确移取乙腈萃取上清液1 mL加入到含有50 mg PSA、50 mg C18和0.15 g无水MgSO4离心管(2 mL)中,剧烈震荡后涡旋1 min,在7 000 r·min-1条件下离心3 min。取0.5 mL上清液转移至含有0.5 mL水的离心管(2 mL)中,混匀,过0.22 μm滤膜,待LC-MS/MS分析。
1.3 GB/T 20769—2008样品前处理过程
称取20 g葡萄样品(精确至0.01 g)于200 mL称量杯中,加入40 mL乙腈,用高速组织捣碎机在15 000 r·min-1,匀浆提取1 min,经抽滤后,在滤液中加入5 g氯化钠,静置30 min,取上清液20 mL(相当于10 g试样量),在40 ℃水浴中旋转浓缩至约1 mL,待净化。
在Carb-NH2SPE柱中,加样前先用4 mL乙腈+甲苯(3+1)预洗柱,当液面到达无水硫酸钠的顶部时,迅速将样品浓缩液转移至净化柱上,并更换新平底烧瓶接收。再每次用2 mL乙腈+甲苯(3+1)洗涤样液瓶3次,并将洗涤液移入柱中。在柱上加上50 mL贮液器,用25 mL乙腈+甲苯(3+1)洗脱农药及相关化学品,合并于平底烧瓶中,并在35 ℃水浴中旋转浓缩至约0.5 mL,将浓缩液置于氮气吹干仪上吹干,迅速加入1 mL的甲醇+水(1+1),混匀,经0.2 μm滤膜过滤,待LC-MS/MS分析。
1.4 LC-MS/MS分析方法
采用AB 4500液相色谱-串联质谱仪进行葡萄中多农药残留的分析测定。色谱柱为Inertsil ODS-3 (75 mm×2.1 mm,2 μm),流动相为水和甲醇(1∶9,V∶V),其中水相和有机相中均加入5 mmol·L-1甲酸铵。流速为0. 25 mL·min-1,柱温40 ℃,进样量2 μL。
质谱条件。采用电喷雾离子源,多反应监测模式(MRM),加热温度450 ℃,喷雾电压为正源5 500 V,负源4 500 V。每个化合物由2对母离子-子离子对共同确定,各化合物的母离子-子离子对及相应的碰撞能量和去簇电压经方法优化后条件见表1。
2 结果与分析
2.1 基质效应的评价方法
农药残留检测过程中基质效应是影响定量准确度的关键因素之一,对待测物的准确定量与定性造成影响。因此,在建立分析方法之前,须对待测物进行基质效应的评估,并采取有效措施进行消除或补偿,提高分析的可靠性。目前常用的基质效应的评价方法是采用基质标准曲线拟合的线性方程斜率与溶剂标准曲线线性方程斜率比(Slope ratio,SR),可以采用SR比值或其百分数表示。若SR=100%(或1),说明无基质效应;若SR<100%,呈基质抑制效应;若SR>100%,呈基质增强效应。当SR为80%~120%时,存在基质效应,但影响不大;当50%
分别配制溶剂标准曲线及基质标准曲线的标准溶液。其中,溶剂标准曲线的标准溶液用甲醇-水(1∶1,V∶V)溶液配制,基质标准曲线的配制则以空白基质代替。分析过程中,分别利用QuChERS和GB/T 20769—2008处理未污染的空白葡萄样品,完成样品前处理过程后,在空白基质中混配不同浓度水平的农药标准溶液,使目标化合物的质量浓度梯度为2、5、10、25、50、100和250 μg·L-1,经LC-MS/MS分析后,以色谱峰面积(Y)对质量浓度(X,μg·L-1)进行线性回归拟合,由此计算基质效应,结果见图1。同时以药物在不同葡萄中基质效应的平均值计,评价2种前处理方法对葡萄基质效应的影响,结果见图2。
2.2 基质效应评价
研究结果表明,葡萄样品经2种前处理方法处理后均存在基质效应,并以基质抑制为主。采用不同的前处理方法时,不同葡萄品种中农药的基质效应存在差异。
GB 20769—2008方法采用乙腈萃取,石墨化碳黑-氨基柱净化,5种葡萄中的农药的SR范围为36%~174%(图1),平均SR为42%~174%(图2)。基质效应较为显著的农药(以平均SR计)为啶虫脒(59%)、噻虫嗪(42%)、灭多威(49%)、矮壮素(36%)、吡虫啉(60%)、多菌灵(60%)、多效唑(151%)和丙环唑(174%)。不同品种葡萄基质间差异较为显著的农药为噻虫嗪(阳光玫瑰和新雅基质效应强)、嘧霉胺(阳光玫瑰和新郁的基质效应强)和丙环唑(白罗莎里奥和新郁的基质效应强),其他农药受基质效应的影响偏差可以控制在20%以内。
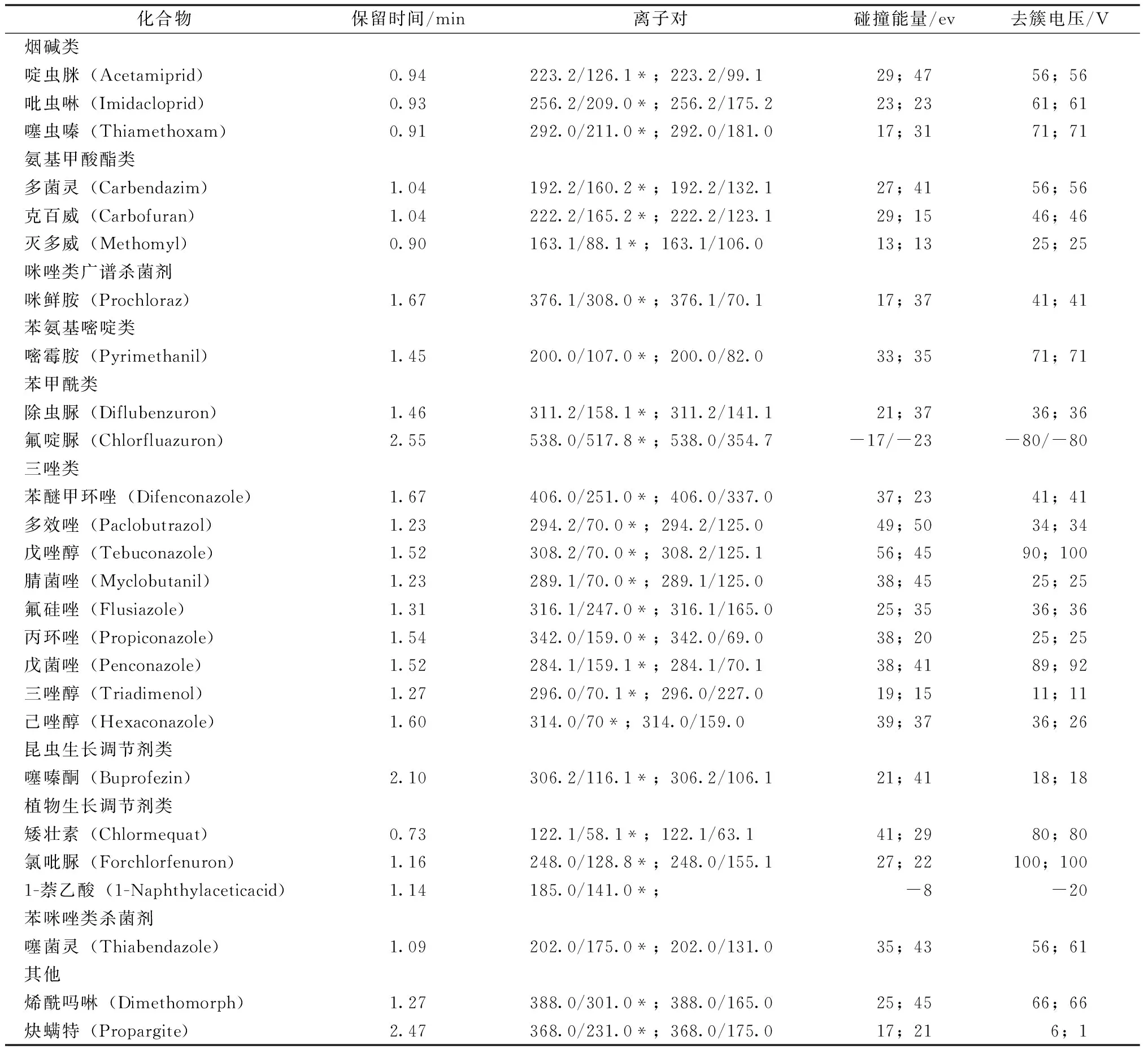
表1 目标化合物的LC-MS/MS参数
注:*为定量离子。
经QuChERS方法处理后,5种葡萄中农药的SR为29%~130%(图1),平均SR为36%~120%(图2);其中基质效应较为显著的农药为啶虫脒(57%)、噻虫嗪(56%)、灭多威(36%)、矮壮素(50%)。除1-萘乙酸外,色泽对基质效应的影响偏差可以控制在15%以内。
基质效应的强度在药物间的差异(RSD为2.3%~26.2%)显著大于葡萄品种间的差异,且QuChERS方法中约73%农药的基质效应小于GB/T 20769—2008中的基质效应。通常认为,GB/T 20769—2008是采用更为严格的净化方法,去除的基体杂质更多,基质效应应该低于QuChERS方法。但由于GB/T 20769—2008在前处理过程中,农药与基质均被浓缩5倍,而QuChERS方法却将样品稀释了2倍,致使同一样品经GB/T 20769—2008处理后,基质效应稍强于QuChERS方法。此外,LC-MSMS分析中的基质效应是极其复杂的多因素交互影响结果,样品的表观色泽度并不会直接反映基质效应的强度。
因此,基于2种前处理方法联合LC-MS/MS分析葡萄中农药残留时,建议通过基质匹配标准溶液进行校正,对于受基质影响显著的药物,建议使用同种葡萄基质进行定量分析。
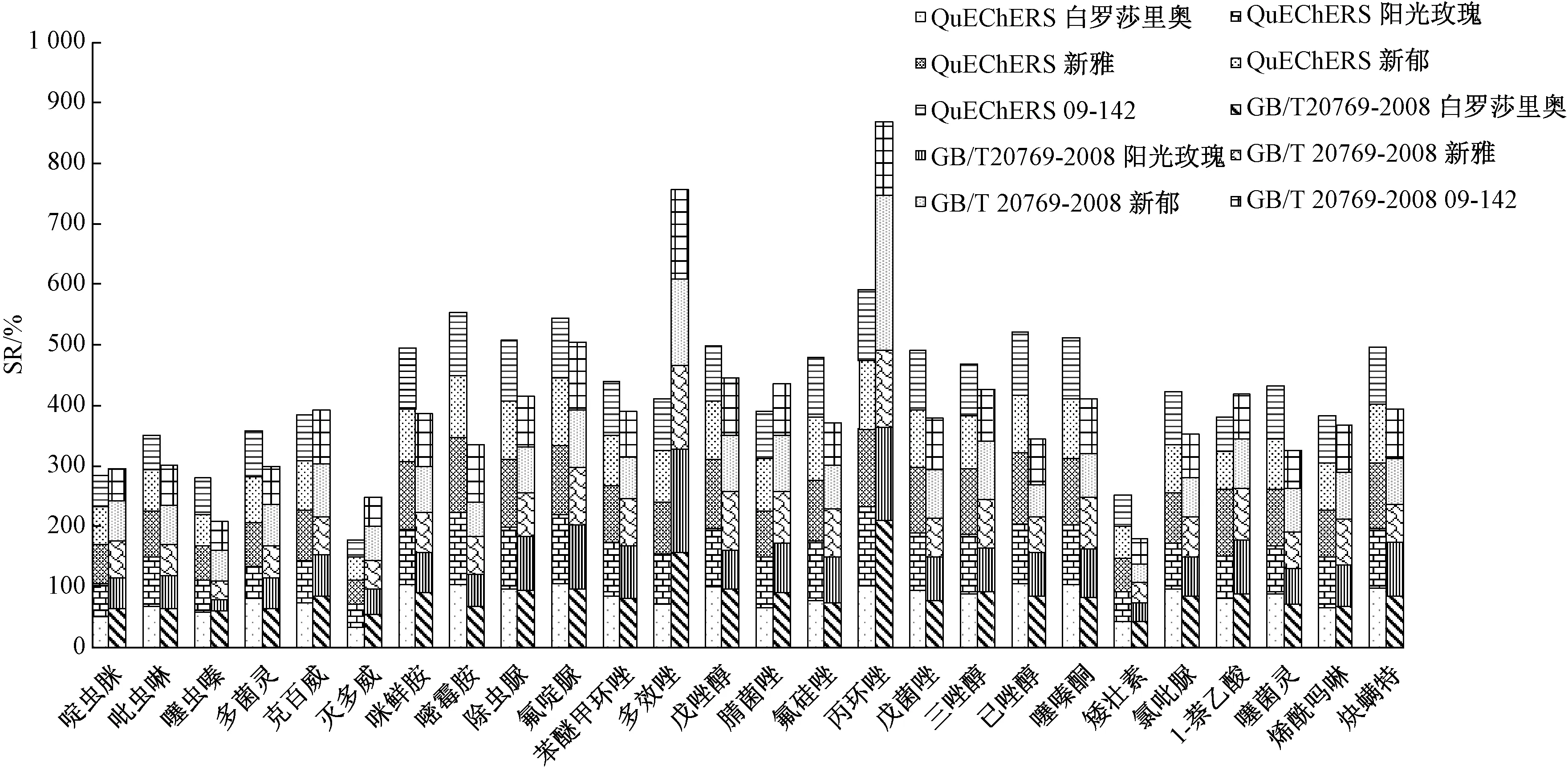
图1 不同葡萄样品经2种方法处理后经LC-MS/MS测定时的基质效应
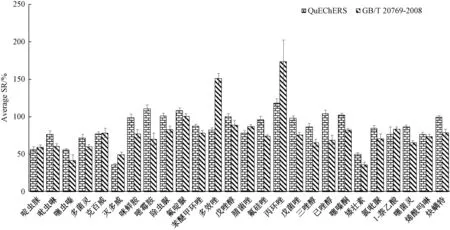
图2 2种前处理条件下农药在葡萄中的平均基质效应
3 小结
本研究对5种葡萄样品中26种农药残留分析时的基质效应进行评价,分别考察前处理方法GB/T 20769—2008和QuChERS进行前处理后,结合LC-MS/MS分析不同农药时的基质效应差异。结果表明,QuChERS方法中约73%农药的基质效应小于GB/T 20769—2008中的基质效应;基质效应的强度在农药种类间的差异显著大于葡萄品种间的差异。LC-MS/MS分析中的基质效应是极其复杂的多因素交互影响结果。因此,在分析葡萄样品中农药残留分析时需通过基质匹配标准溶液进行校正,对于受基质影响显著的药物建议使用同种葡萄基质进行定量分析。

