干旱胁迫及复水对6种园林灌木生理特性的影响
吴雪仪,刘锐敏,潘 澜,谭广文,杨文丽
(1.广州普邦园林股份有限公司,广东 广州 510600;2.华南农业大学林业与风景园林学院,广东 广州 510642)
植物在生长发育过程中会遭受各种生物(虫害、病菌、杂草等)或非生物(干旱、洪涝、盐碱等)胁迫的危害。干旱作为最重要的非生物胁迫之一,会引起植物水分亏缺、细胞水势和膨压降低,造成叶片萎蔫,还会破坏细胞原生质体和生物膜系统,改变细胞膜透性,进而影响植物正常生命活动甚至导致植物死亡[1-2]。但是植物在长期的进化过程中也形成了对干旱胁迫的生理响应机制,包括通过减少水分散失维持叶片组织含水量[3]、进行渗透调节从而降低细胞渗透势[4-5]、提高保护酶活性减缓膜脂过氧化程度以及调节丙二醛(MDA)含量的变化等调节机制以适应干旱胁迫[6-7],所以短期或轻度干旱胁迫对植物的伤害是可逆的[8]。
在城市绿地面积不断增长和城市水资源紧缺的双重背景下,探索既能满足植物正常生长发育需求的同时节约绿化用水成为了近年研究的热点。花叶鹅掌柴(Scheff l era odoratacv.Variegata)、 龙 船 花(Ixora chinensis)、白 蟾(Gardeniajasminoidesvar.fortuniana)、狗牙花(Ervatamiadivaricata)、软枝黄蝉(Allemandacathartica)和红背桂(Excoecaria cochinchinensis)是华南地区园林绿化中常用的灌木,尽管已有学者研究了花叶鹅掌柴在生物胁迫下的生理和荧光特性[9]、干旱胁迫下龙船花生长和光合指标变化[10]、白蟾的抗污染性能[11]、狗牙花和红背桂的盐胁迫适应机制等[12],但尚未发现比较以上6种植物抗旱生理特性的报道。本文通过研究干旱胁迫及复水对花叶鹅掌柴等6种园林灌木生理生化指标的影响,利用主成分分析法对其抗旱能力的强弱进行综合评价,丰富园林植物抗旱性研究数据,为选择适宜的抗旱型园林绿化植物并实现节水灌溉提供理论依据。
1 材料与方法
1.1 试验材料
试验地位于华南农业大学板栗园(113°21′E、23°09′N)。试验苗为花叶鹅掌柴、龙船花、白蟾、狗牙花、软枝黄蝉和红背桂的实生容器苗,挑选健壮、生长整齐一致的植株,每种45株,移栽到规格为15 cm×15 cm的营养袋中,基质中荷兰土与黄土1∶1均匀混合。苗木生长基本情况见表1。

表1 供试6种园林灌木苗木生长情况
1.2 试验方法
2017年10月,采用人工模拟自然干旱胁迫的方法,在试验前1 d浇水至饱和状态,往后11 d内不再浇水,直至12 d时复水(即浇水至饱和状态)。对供试植物进行0(CK)、4、8、12 d及复水后第4 天(R4)5种控水处理,并测定6种植物各项生理指标。干旱胁迫期间6种灌木营养袋中的土壤绝对含水量变化见表2。各指标样品采集于测定当天早上8:00~9:00进行,每次测定选择5株植物进行采样,采其第3~8片大小均一的功能叶,用自来水将叶片表面污物冲洗干净后用蒸馏水冲洗3次,随后用滤纸将叶片表面水分吸干。将叶片剪碎混合后测定指标,重复测定3次。
1.3 指标测定
土壤含水量采用德国IMKO的AZS-100定时定位TDR土壤水分仪测定;叶片组织含水量采用烘干称重法测定、可溶性蛋白采用考马斯亮蓝G-250法[13]测定;叶绿素含量采用分光光度法测定;脯氨酸含量采用酸性茚三酮法[14]测定;叶片质膜透性(相对电导率)采用电导仪法[14-15]测定;SOD活性采用氯化硝基四氮唑蓝(NBT)光化还原法进行测定;MDA含量采用硫代巴比妥酸(TBA)法[16]测定;叶片可溶性糖含量采用蒽酮-浓硫酸法[16-17]测定。
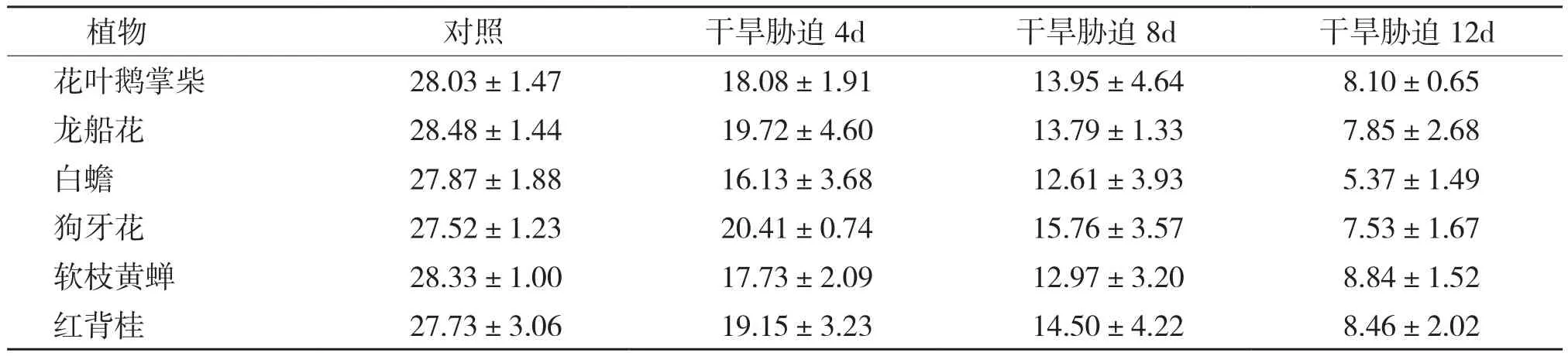
表2 干旱胁迫期间土壤绝对含水量(%)变化
1.4 数据处理
采用SPSS Statistics 19.0软件和Excel对试验数据进行统计分析和作图。用主成分分析法计算各个抗旱指标的得分,评价各灌木的抗旱能力。分析前,利用Z-score法对数据进行标准化处理:
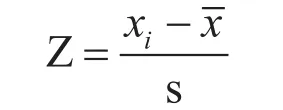
式中,Z为标准化后所得的数据,xi为某项指标的实际观察值,为某项指标的平均值,s为标准差。
2 结果与分析
2.1 干旱胁迫及复水对6种园林灌木叶片组织含水量的影响
干旱胁迫处理期间,龙船花、狗牙花、软枝黄蝉、红背桂的叶片组织含水量在8 d、12 d时显著小于对照,白蟾叶片组织含水量逐渐降低至胁迫12 d时显著低于对照,其中龙船花和白蟾降幅较大,分别为38.11%和29.30%(图1)。花叶鹅掌柴在干旱前期(0~4 d)小幅上升后逐渐降低并在12 d时显著小于对照,其降幅最小(仅9.48%)。复水4 d后6种园林灌木叶片组织含水量均有所上升,其中花叶鹅掌柴、龙船花和红背桂恢复到对照水平,其他植物仍显著低于对照。

图1 干旱胁迫下6种园林灌木叶片组织含水量的变化
2.2 干旱胁迫及复水对6种园林灌木叶片叶绿素含量的影响
从图2可以看出,干旱胁迫处理期间,花叶鹅掌柴和狗牙花叶片叶绿素含量在胁迫4、8和12 d时均显著大于对照。花叶鹅掌柴叶片叶绿素含量持续升高,与其他植物相比增幅最大、达169.79%,而狗牙花叶片叶绿素含量增加后保持稳定、增幅为67.33%。龙船花叶片叶绿素含量在干旱胁迫8 d、12 d时显著大于对照。白蟾和软枝黄蝉叶片叶绿素含量逐渐升高,在干旱胁迫12 d时显著大于对照。红背桂叶片叶绿素含量在干旱胁迫12 d时相比对照增加了28.42%,但无显著差异。复水4 d后6种园林灌木叶片的叶绿素含量均有下降,其中狗牙花、软枝黄蝉和红背桂恢复到对照水平,其余植物仍显著高于对照。

图2 干旱胁迫下6种园林灌木叶片叶绿素含量的变化
2.3 干旱胁迫及复水对6种园林灌木叶片脯氨酸含量的影响
由图3可知,干旱胁迫处理期间,6种园林灌木叶片脯氨酸含量持续上升,其中花叶鹅掌柴、龙船花和红背桂在胁迫4 d开始显著大于对照,白蟾和软枝黄蝉在胁迫8 d、12 d时显著大于对照,狗牙花在胁迫12 d时显著大于对照,6种灌木叶片的脯氨酸含量均在胁迫12 d时达最大值。花叶鹅掌柴叶片脯氨酸含量增幅最大,其次为软枝黄蝉和龙船花,增幅分别为143.72%、114.52%和85.73%,白蟾增幅最小、仅为42.10%。复水4 d后,狗牙花叶片脯氨酸含量恢复到对照水平,其余幼苗仍显著大于对照。
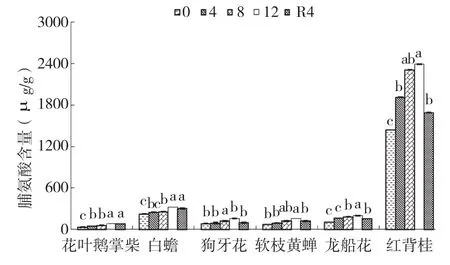
图3 干旱胁迫下6种园林灌木叶片游离脯氨酸含量的变化
2.4 干旱胁迫及复水对6种园林灌木叶片可溶性蛋白含量的影响
干旱胁迫处理期间,6种园林灌木植物叶片的可溶性蛋白含量持续升高,其中花叶鹅掌柴、白蟾和软枝黄蝉在胁迫4 d起显著大于对照,软枝黄蝉的整体增幅最大、为118.64%(图4)。龙船花和红背桂叶片可溶性蛋白含量在胁迫8 d、12 d显著大于对照,而狗牙花在12 d时达到最大值并显著高于对照水平。6种园林灌木中,红背桂可溶性蛋白含量的上升幅度最小,仅为30.54%。复水4 d后,白蟾和狗牙花叶片可溶性蛋白含量显著下降并恢复到对照水平,其余植物显著大于对照。
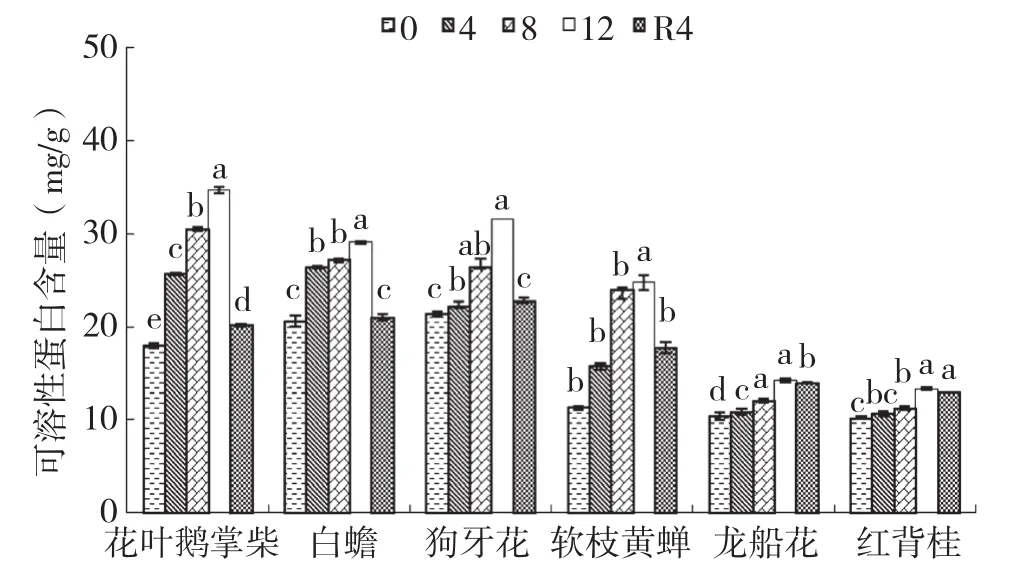
图4 干旱胁迫下6种园林灌木叶片可溶性蛋白含量的变化
2.5 干旱胁迫及复水对6种园林灌木叶片可溶性糖含量的影响
干旱胁迫期间,6种园林灌木叶片可溶性糖含量随着试验时间的延长而逐渐升高,其中花叶鹅掌柴、龙船花、白蟾、狗牙花和红背桂的可溶性糖含量在胁迫8 d、12 d时显著大于对照,软枝黄蝉在12 d时显著大于对照,6种灌木可溶性糖含量均在12 d时达到最大值(图5)。花叶鹅掌柴和白蟾可溶性糖含量增幅最大、分别是对照的15.16倍和5.01倍,狗牙花增幅最小、仅为对照的2.53倍。复水4 d后,花叶鹅掌柴的叶片可溶性糖含量虽有下降,但仍显著高于对照,其余植物均恢复到对照水平。
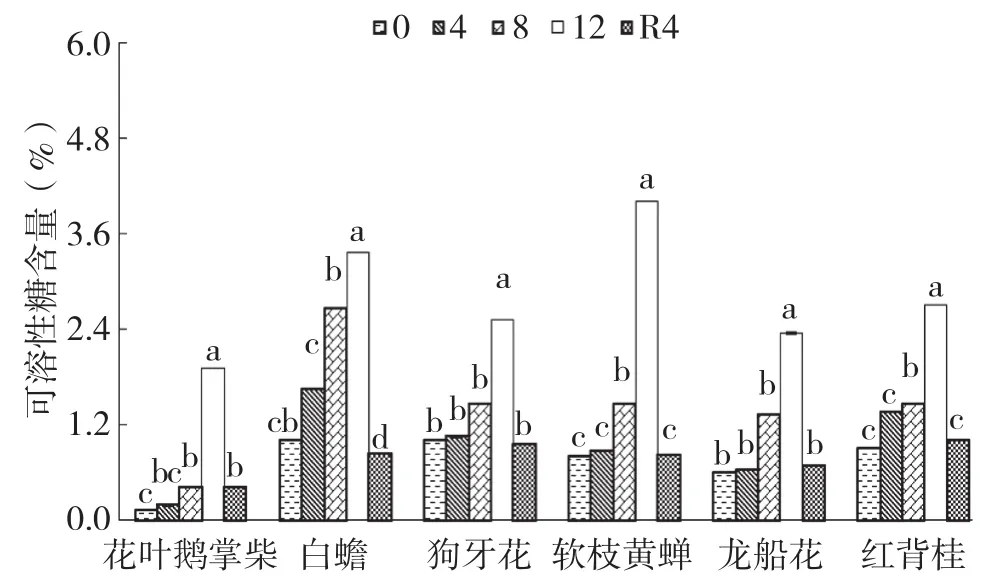
图5 干旱胁迫下6种园林灌木叶片可溶性糖含量的变化
2.6 干旱胁迫及复水对6种园林灌木叶片SOD活性的影响
干旱胁迫处理期间,6种园林灌木叶片的SOD活性随着干旱胁迫程度加重而持续上升。图6显示,花叶鹅掌柴、龙船花、软枝黄蝉和红背桂叶片的SOD活性在干旱胁迫4、8、12 d时显著大于对照,并在12 d时到最大值,其中红背桂升幅高达113.09%。狗牙花叶片SOD活性在干旱8 d和12 d时显著大于对照,白蟾小幅上升后在12 d时显著大于对照,其整体升幅最小、仅8.95%,这两种植物叶片的SOD活性均在12 d时到最大值。复水后,白蟾、狗牙花和红背桂叶片的SOD活性均恢复至对照水平,其他植物仍显著大于对照。
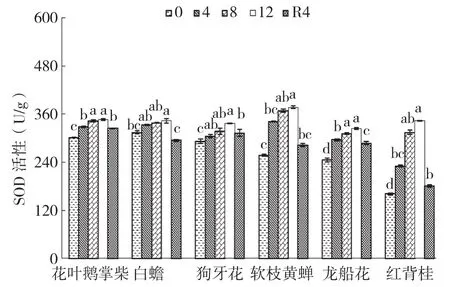
图6 干旱胁迫下6种园林灌木叶片SOD活性的变化
2.7 干旱胁迫及复水对6种园林灌木相对电导率的影响
从图7可以看出,龙船花和白蟾叶片的相对电导率在干旱胁迫第4、8、12 d时显著大于对照,在12 d达到最大值。花叶鹅掌柴、狗牙花、软枝黄蝉和红背桂叶片的相对电导率在干旱胁迫8 d、12 d时显著大于对照。6种植物中以软枝黄蝉叶片的相对电导率增幅最大、为41.73%,花叶鹅掌柴最小、仅3.46%。复水4 d后,软枝黄蝉和龙船花的相对电导率仍显著高于对照,其余植物与对照相比无显著差异。
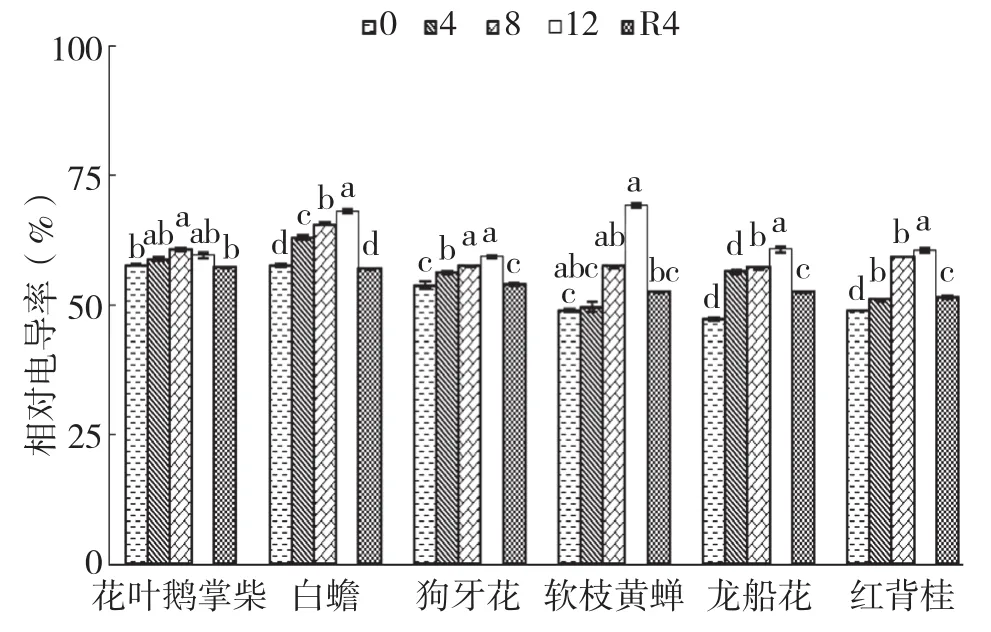
图7 干旱胁迫下6种园林灌木叶片相对电导率的变化
2.8 干旱胁迫及复水对6种园林灌木叶片MDA含量的影响
干旱胁迫处理期间,6种园林灌木叶片的MDA含量持续升高,均在胁迫12 d达到最大值(图8)。花叶鹅掌柴、龙船花、白蟾、软枝黄蝉和红背桂叶片MDA含量在胁迫8 d和12 d时显著大于对照,而狗牙花叶片的MDA含量在胁迫12 d时显著大于对照。龙船花和白蟾叶片的MDA含量在6种灌木中增幅较大、分别是对照的4.45倍和4.44倍,花叶鹅掌柴增幅最小、仅为对照的1.87倍。复水4 d后,龙船花叶片MDA含量恢复到对照水平,其余植物虽有回落但仍显著高于对照。
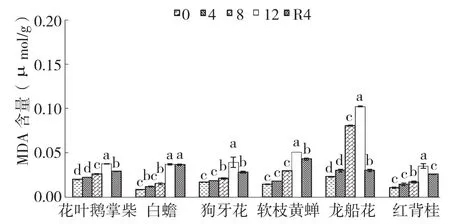
图8 干旱胁迫下6种园林灌木叶片MDA含量的变化
2.9 6种园林灌木的抗旱性综合评价
植物的抗旱性是各指标的综合反映结果,主成分分析法通过系统分析各抗旱指标从而全面准确地评价植物抗旱能力。各主成分得分是其加权值,主成分所对应的贡献率是其权重,根据主成分的特征向量计算出各抗旱指标的得分,按得分多少评定各树种的抗旱能力[18]。对6种园林灌木的8项生理指标进行主成分分析,根据特征值>1的提取原则确定了3个主成分[19],累计贡献率达到95.001%,很大程度上代表了原始指标的信息(表4)。由表5可知,第一主成分特征根为3.554、方差贡献率为44.298%,包括了叶绿素含量、叶片组织含水量、可溶性蛋白含量和MDA含量等指标信息;第二主成分特征根为2.502、方差贡献率为31.276%,主成分系数较大的为相对电导率、可溶性糖含量和SOD活性;第三主成分特征根为1.554、方差贡献率为19.426%,其中脯氨酸含量和MDA含量系数较大。说明叶绿素含量、叶片组织含水量、可溶性蛋白含量、MDA含量、相对电导率、可溶性糖含量和SOD活性是反映供试园林灌木干旱胁迫的重要指标,其次为脯氨酸含量。通过对各项生理指标进行综合评定,6种园林灌木植物抗旱性由强到弱的排序为花叶鹅掌柴>狗牙花>红背桂>软枝黄蝉>白蟾>龙船花(表6)。
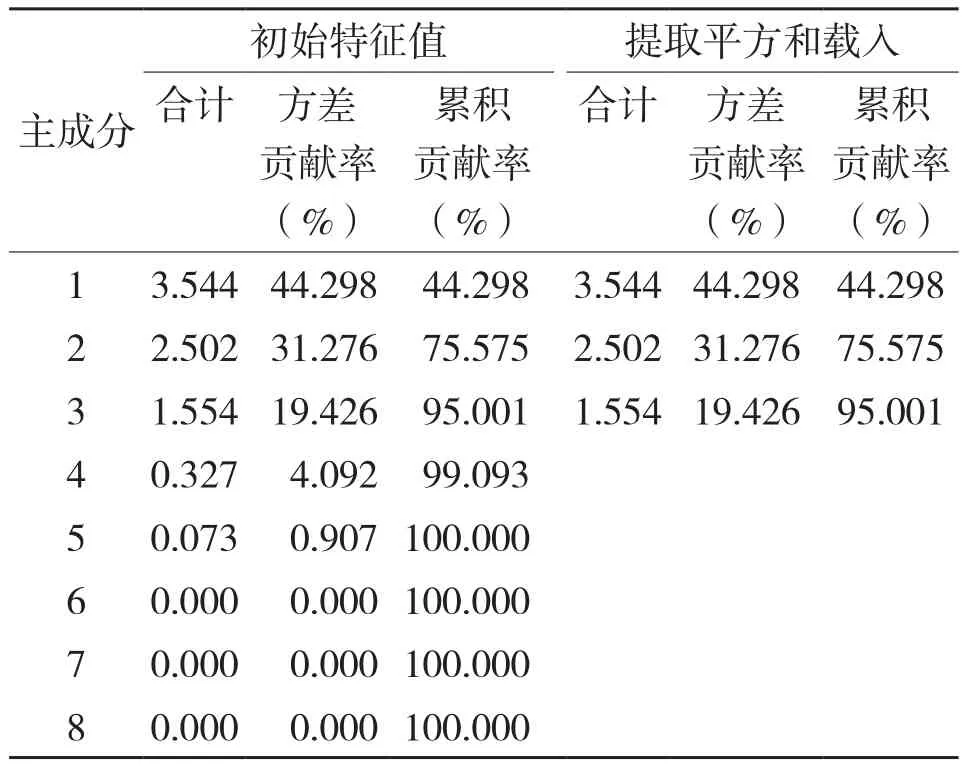
表4 6种园林灌木干旱胁迫生理指标的累计贡献率
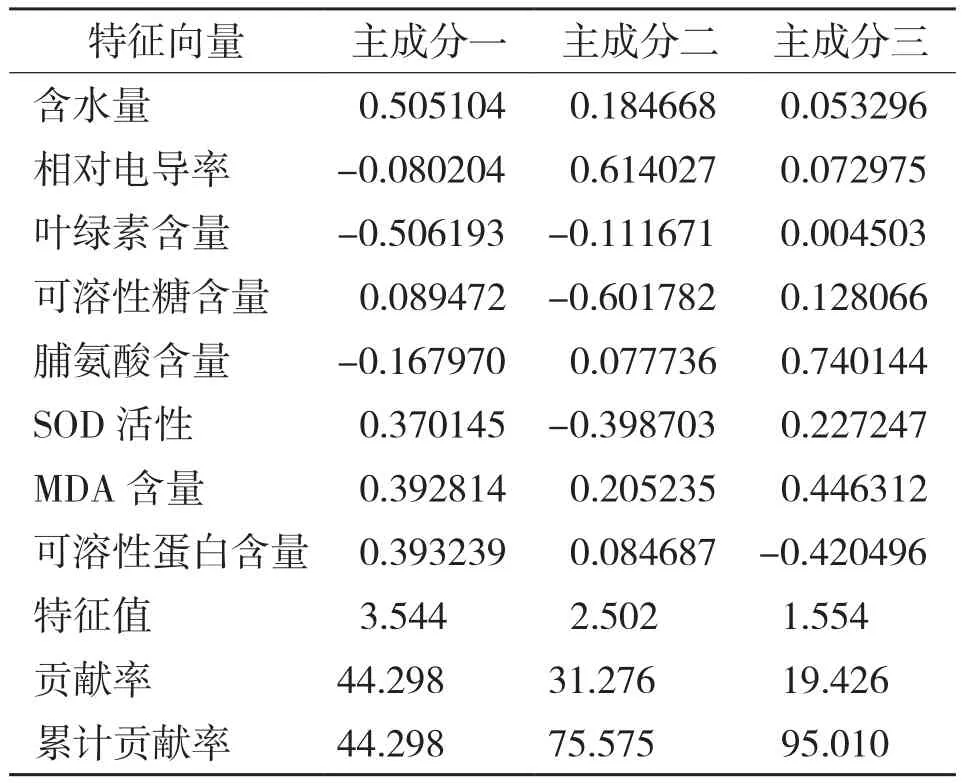
表5 6种园林灌木干旱胁迫生理指标的主成分分析结果
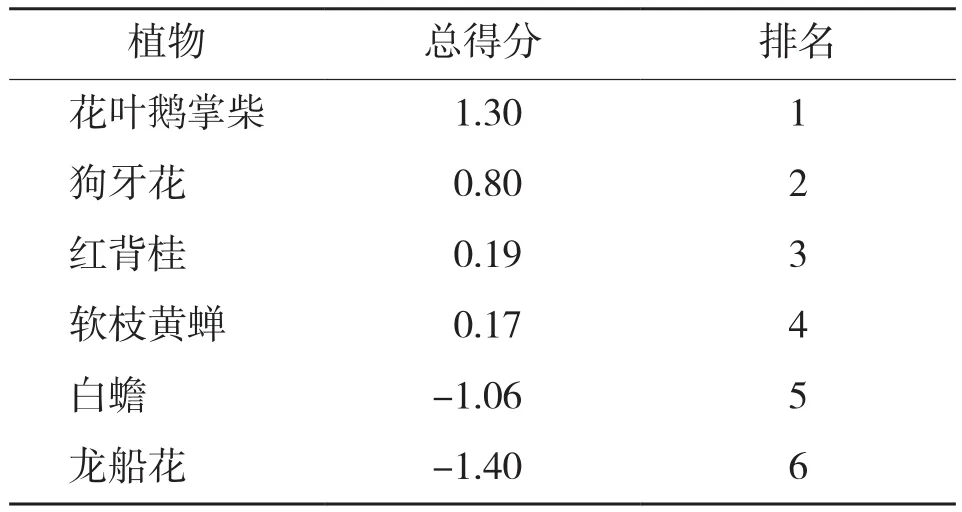
表6 干旱胁迫下6种园林灌木植物的综合评定结果
3 结论与讨论
干旱胁迫下植物叶片组织含水量大幅下降,影响叶绿素的生物合成,并促进已合成叶绿素的分解,导致叶片叶绿素含量减少[20]。有研究表明,抗旱性强的植物叶片结构特征有利于减少水分损失[3],且叶绿素含量减少的幅度较低[21]。在本试验中,6种园林灌木植物叶片组织含水量随着干旱程度的加重而逐渐下降,其中花叶鹅掌柴虽显著下降,但降幅最小,表现出较强的保水能力。而6种灌木叶绿素含量持续上升,可能是由于组织含水量的下降使叶绿素呈相对浓缩的状态,从而提高了叶片单位鲜重中的含量[22],也可能与植物的补偿效应有关[23],或因为叶绿素不降解或降解过程受阻导致植物叶片滞绿[24]等原因造成的,这与桑子阳等[20]研究结果相似。
渗透调节机制有助于降低植物水势,维持细胞膨压。渗透调节的物质种类繁多,其中脯氨酸能为干旱胁迫下的植物提供自由水从而维持正常生命活动[25],可溶性蛋白可显著增强植物细胞的持水力、增加束缚水含量和原生质弹性[26],而可溶性糖有助于维持细胞原生质渗透势、维持细胞膨压,有效保护细胞膜结构从而减轻机械损伤,一般认为抗旱性强的品种透调节物质累积量较多[6,27]。本研究结果表明,6种灌木叶片脯氨酸含量均在胁迫最严重时(12 d)达到最大值,说明脯氨酸的累积量与胁迫程度呈正相关,说明脯氨酸的大量积累有利于植物抵御干旱。6种灌木植物叶片的可溶性蛋白和可溶性糖含量随着干旱胁迫程度的加重而升高,这与胡义等[25]在香樟、任磊等[28]在茶菊上的研究结果一致,说明干旱胁迫下植物通过积累可溶性蛋白和可溶性糖增强渗透调节能力,抵抗干旱胁迫带来的伤害。其中软枝黄蝉和花叶鹅掌柴这两项指标增幅大于其他植物,表明其适应干旱胁迫环境的能力较强,抗旱性较好。植物的6种细胞渗透调节物质相互协同作用,以忍耐干旱胁迫对细胞造成的损害。复水后6种灌木各项渗透调节指标均有下降,其中白蟾可溶性蛋白含量、狗牙花脯氨酸和可溶性蛋白含量、除花叶鹅掌柴外其他植物可溶性糖含量均恢复至对照水平,说明复水后土壤干旱胁迫得以缓解,各植物体内渗透调节物质逐渐向正常水平逆转。
植物体内活性氧(reactive oxygen species,ROS)在逆境胁迫下会大量积累,从而破坏植物叶片细胞膜的结构、功能与透性,所以通常认为叶片膜系统是植物受害的最初和关键部位[29]。SOD作为植物参与清除ROS的关键抗氧化酶,能减轻植物因ROS积累造成的伤害[30]。在本试验中,6种灌木植物叶片的SOD活性持续上升,说明植物修复机制与氧化损伤是同步进行的。植物叶片MDA含量的变化可反映膜脂过氧化和细胞膜损害程度,而相对电导率与细胞质膜透性相关,且抗旱性强的植物MDA和相对电导率增幅较小[31]。6种灌木叶片MDA含量和相对电导率均随着干旱胁迫强度的增加而持续上升,说明MDA含量的大量积累破坏了细胞结构导致渗透势增大。花叶鹅掌柴叶片MDA含量和细胞膜透性增幅较小,表明该植物抗膜脂过氧化能力强,细胞膜受损程度低,抗旱性较强。相反,龙船花两项指标增幅均较大,说明其叶片过氧化程度严重,抗旱性较差。复水4 d后,白蟾、狗牙花和红背桂叶片SOD活性、龙船花的MDA含量以及除龙船花外其余5种灌木相对电导率均恢复至对照水平,其他植物虽下降但仍显著大于对照。这说明复水在不同程度上缓解了干旱胁迫对植物的伤害,植物体内的自由基含量随着水分条件改善而降低。
植物的抗旱性是一个复杂的综合性状,受众多生理因素的共同影响,而各生理指标所提供的信息会有重叠或疏漏,所以利用单一指标去评价植物抗旱性是片面且不可靠的[32]。当涉及多种植物多个指标时,由于各指标所反映的植物抗旱性顺序往往不一致,利用常规的判别方法难以得到准确结果。通过利用主成分分析法对各项生理指标进行综合评定得出,6种灌木抗旱性强弱从高到低的排序为花叶鹅掌柴、狗牙花、红背桂、软枝黄蝉、白蟾、龙船花,为抗旱型园林绿化植物的筛选提供参考。

