乳腺X线AI智能病灶检测
李欣,梁森,黄正南,夏晨,张荣国,吴孝掌,赖原仲
乳腺癌是女性群体中发病率最高的一类肿瘤。乳腺癌的早诊早筛有利于提升患者的5年生存率,具有重大的临床意义[1]。目前《中国抗癌协会乳腺癌诊治指南与规范(2017年版)》建议40~45岁的女性进行一年一次的乳腺癌筛查,45~69岁的女性每1~2年进行一次筛查,70岁以上每2年进行一次筛查,并指定使用钼靶作为主要的影像筛查手段,超声和MRI作为辅助方式[2]。钼靶X线对微钙化敏感,对肿块也具有良好的检测效果,而且还具有性价比高的优点。但就高致密乳腺而言,钼靶影像的病灶检出存在一定的局限[3]。上世纪80年代开始,研究者们陆续提出了一些计算机方法对钼靶图像进行辅助诊断[4-6],此类算法大多基于传统的CAD算法。2014年以来,基于深度学习人工智能逐渐成为计算机视觉的主流方法论,研究者们利用深度学习算法使用大规模数据训练预测模型,在无需手动干预的情况下在包括乳腺钼靶影像[7-9]、眼底影像[10]、皮肤影像[11]、CT影像[12]、病理影像[13]等多个临床场景下实现了疾病的准确预测与分类。
本研究我们首先按照最新版BI-RADS(2013年)国际标准进行人工数据标记[14],主要标记的病灶类型包括肿块、乳腺内淋巴结、圆形钙化、粗糙钙化、还有环形钙化。本文采用最新的深度学习病灶检测算法Faster R-CNN模型作为主要的算法结构[15],训练并验证AI在乳腺X线影像的病灶检测效果。实验结果显示AI智能检测系统对肿块、乳腺内淋巴结、圆形钙化、环形钙化、粗糙钙化的检测敏感度分别达到76.4%,83.1%,71.2%,75.0%和64.9%。
材料与方法
1.病例资料
本文回顾性地分析了2016年6月-2017年6月1年内行乳腺钼靶检查的5765例病例,病例纳入条件:①女性;②影像报告发现病灶;③术前未经放疗或化疗。共纳入2292例病例,年龄24~85岁,中位年龄41岁。所有病例均行常规双侧乳腺轴面(craniocaudal,CC)和平行于胸大肌斜位(mediolateral oblique,MLO)摄影。
2.检查方法
采用GE乳腺X线Senograph设备,型号为ADS 54.10,行常规轴面和斜侧面摄像。设备电压22~49 kV,电流:小焦点40 mA,大焦点100 mA,最大500 mA。本研究中智能检测算法的开发与训练基于深度学习框架Mxnet 1.2版本开发,所有代码基于Python 2.7语言,并在 NVIDIA GPU上运行,该AI智能病灶检测系统在Windows/Linux/Mac等操作系统上均可使用。
3.图像处理和人工标注
2292例乳腺X线病例9168张DICOM影像。每一张影像依次按如下步骤进行图像预处理:①用自适应的方法调整到适合阅片的窗宽窗位;②将图像的像素值归一化到0~255范围内;③将医学DICOM传输协议图像格式转换为适合计算机处理的JPEG图像格式。为了让AI可以智能检测出X线影像中的病灶,由有经验的影像科医生对影像的病灶进行人工标注。通过用标注好的数据训练AI智能病灶检测模型,我们最终得到模型并进行病灶检测效果的验证。
本研究采用最新版的BI-RADS(2013年)标准对病例进行人工标注。每例病例的人工标记流程:①3名放射科副高职称医生分别进行标记;②1名标记质量控制人员统计不一致的标记数据;③3名标记人员一起讨论不一致的标记并达成共识。最后,2292例数据划分为1892例训练数据集和400例测试数据集。训练数据集用来训练我们的AI智能病灶检测模型,测试数据集用来评估我们AI模型的检测效果。
4. 人工智能检测方法
本研究采用深度学习人工智能领域经典的目标检测Faster R-CNN算法[15],相比其它的目标检测算法,它具有高精度的检测优势,目前很多检测算法都是基于该算法发展出来的,比如R-FCN检测网络算法[16]和DeformbleNet算法[17]等。Faster R-CNN是采用卷积神经网络为主体的两阶段目标检测算法(图1)。首先对输入的乳腺X线图片进行多层卷积层和池化层操作从而实现自动特征提取,得到特征图(Feature Map)后将其输入一个区域提出网络(region proposal network,RPN)网络实现感兴趣病灶区域(ROI)自动提取,并将ROI区域映射到特征图上(即ROIPooling操作),最后对映射后的特征图进行预测其病灶的类别和位置。算法流程分为训练阶段和测试阶段。训练阶段使用训练数据集对该算法进行训练,从而得到算法中的参数,此时算法的输入是乳腺X线图片和对应的人工标注的病灶标签。在测试阶段,我们使用测试数据集对算法的检测性能进行测试,将算法检测出来的病灶结果与人工标注的结果进行对比,用来评估AI智能检测病灶的性能。
5.评价方法
本研究使用的敏感度和假阳率两个指标对检测的性能进行评价。假设影像中的病灶有N个,算法检测出了M个病灶,其中TP个病灶是真阳,FP个病灶是假阳,且TP+FP=M。那么敏感度(Sensitivity)和假阳率(False Positive Rate)的定义为,
Sensitivity=TP/N
(1)
False Positive Rate=FP/M
(2)
结 果
本研究对1892例训练数据集进行训练,得到优化后的AI智能病灶检测模型,最后基于400例测试数据集进行病灶检测的效果验证,得到统计结果(表1)。

表1 测试集病灶检测结果
400例测试集的实际病灶分布肿块689个,乳腺内淋巴结1098个,圆形钙化73个,环形钙化692个,粗糙钙化544个。AI智能病灶检测算法分别检测出肿块526个,乳腺内淋巴结912个,圆形钙化52个,环形钙化692个,粗糙钙化353个。AI智能病灶检测算法敏感度分别为76.4%,83.1%,71.2%,75%,649%;假阳率分别为35.7%,38.6%,0.9%,0.6%,18.4%(图2)。
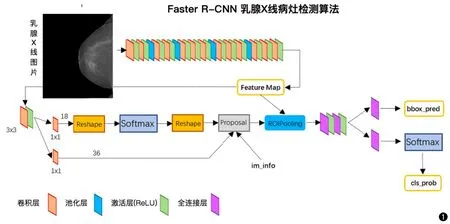
图1 算法的输入为乳腺X线片,然后通过算法的预测,输出病灶的位置(bbox_pred)和对应的类别(cls_prob)。
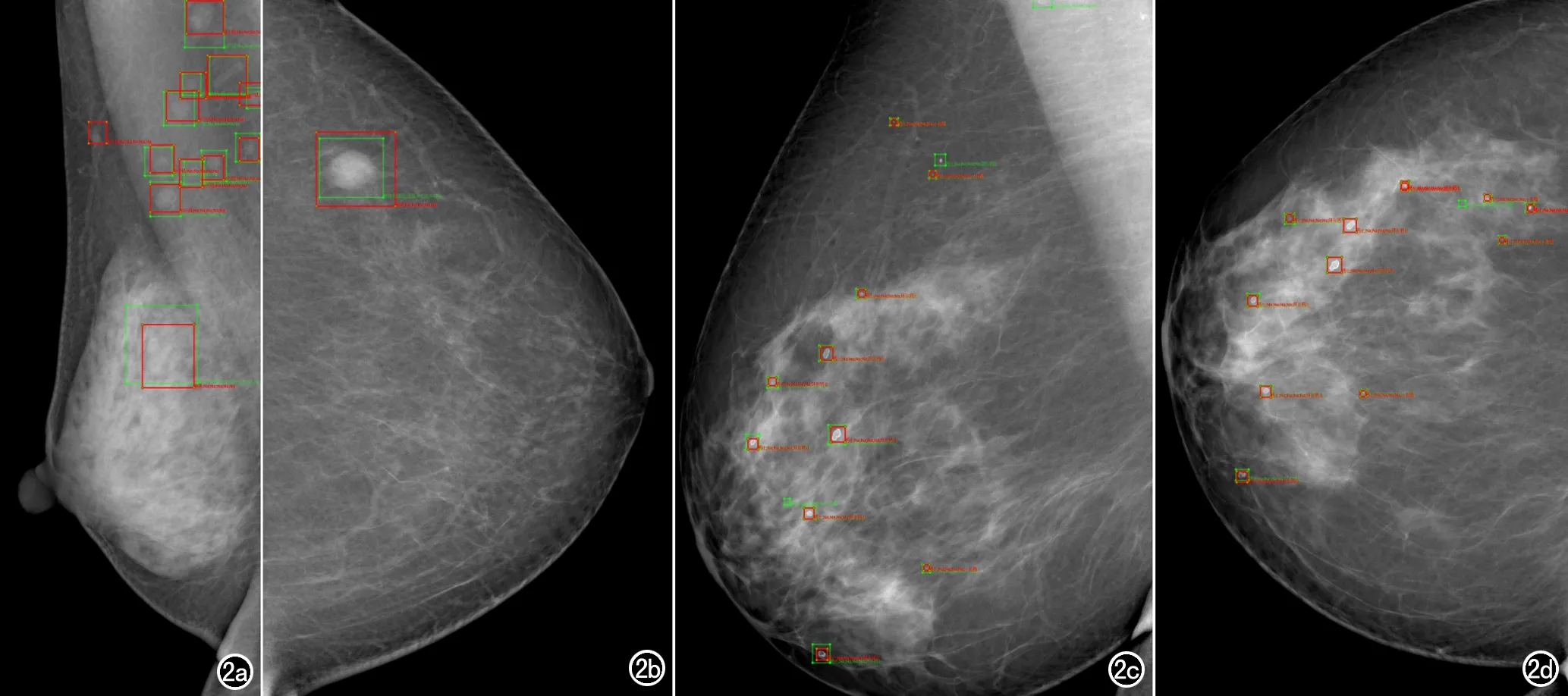
图2 AI智能病灶检测结果。a~d) 分别为不同患者的乳腺X线影像的右乳MLO位,左乳CC位,右乳MLO位和右乳CC位。图框表示病灶,绿框代表真实病灶,红框代表AI智能检测出的病灶。若绿色框和红色框重合在一起表示真实的病灶被检测出。图中大部分病灶都被检测出;若某个病灶仅有绿框,表示AI漏检,c) 漏检了3个病灶,d) 漏检了1个病灶;若某个病灶仅有红框表示病灶是一个假阳,或者是一个医生漏标记的病灶。
讨 论
目前钼靶X线检查为乳腺癌筛查的首选方法。本文使用最新的人工智能方法对乳腺X线影像中的多类病灶进行检测,其中乳腺内淋巴结的检测效果最好,敏感度能达到83.1%,其次是肿块76.4%,但两者的假阳率比较高,分别为35.7%和38.6%。就钙化的检测而言,其整体效果没有肿块和乳腺内淋巴结的效果好,最好的是环形钙化敏感度为75%,最差的是粗糙钙化,敏感度为64.9%,但钙化的整体假阳率非常低,环形钙化的假阳率仅为0.6%。
尝试使用最新的人工智能算法对乳腺X线影像进行智能检测,可以同时对多类别病灶进行检出和类别预测,并且乳腺X线影像可以不需要做复杂的预处理便可以输入模型中进行预测。乳腺内淋巴结检测是本研究的一个亮点,以往的研究基本上都是对钙化或者肿块的检测,很少有对乳腺内的淋巴结肿大情况进行检测。
本研究不足之处:①肿块和乳腺内淋巴结的假阳率较高;②需要大规模的人工标注数据,这需要耗费很多医生时间;③相对传统的CAD系统检测敏感度80%~90%而已。本研究整体的敏感度偏低,但值得注意的是本研究的敏感度评估是针对具体病灶的评估,而传统的CAD评估是针对病例评估,本文研究病例量远远大于传统的CAD方法。
本研究现阶段仅仅只是用AI检测了病灶,然而AI在乳腺钼靶X线的作用远非如此。研究发现乳腺腺体的致密程度与患乳腺癌的风险成正比[18],且对于高致密性腺体,因为病灶可能在致密腺体下面,从乳腺钼靶影像中往往很难发现病灶。然而对于人眼不易分辨的病灶,计算机可能具有比较好的分辨力。在未来,AI可能能在预测乳腺致密程度,以及高致密型腺体的病灶检测上发挥出好的的检测效果。
AI还可通过对病灶进行良恶性鉴别以及识别癌症是否转移等来辅助医生的临床诊断。

