富硒-GSH多形汉逊酵母的制备工艺及其抗氧化活性
钱卫东,刘婵婵,王 婷,*,沈兰芳,李永东
(1.陕西科技大学食品与生物工程学院,陕西西安 710021;2.宁波市疾病预防控制中心,浙江宁波 315010)
硒是人体必需的微量元素之一[1],在维持机体新陈代谢和预防疾病方面发挥重要作用[2-3]。人体缺硒会导致克山病、大骨节病、心血管病、糖尿病、肝病、前列腺病、心脏病和癌症等40多种疾病[4]。硒缺乏者可以通过补充无机硒或有机硒实现人工补硒。其中,无机硒补充剂存在硒吸收率低、毒副作用较强等问题,而有机硒具有生物活性好、吸收效率高、毒副作用小等优点。目前通过在饮食中添加有机硒营养强化剂已成为有效的补硒手段[5-6]。因此,如何将无机硒高效转化为有机硒,并兼顾硒利用率和安全性是目前食品科技工作者研究的热点之一[4]。
目前,无机硒转化为有机硒的途径主要有动物转化法[7]、植物转化法[8]、微生物转化法等[9]。微生物转化法具有高吸收、天然安全、发酵周期短等优点,正逐渐成为有机硒制备的主要转化器[10]。如酿酒酵母和产朊假丝酵母具有良好的富硒能力,通过富硒作用,实现细胞的无机硒转化率为88%~97%[11-14]。多形汉逊酵母(Hansenulapolymorpha)属于真菌门酵母科汉逊酵母属,是美国食品药品监督管理局(FDA)批准的食品级酵母,具有营养要求简单、生长速度快、易于高密度发酵的优点,且耐高温,最高生长温度可达49 ℃[15]。因此,利用多形汉逊酵母制备富硒-GSH的多营养元素复合食品,可实现食品多营养元素的一体化。
本文以食品级多形汉逊酵母为细胞转化器,通过单因素实验和正交试验,优化多形汉逊酵母富集有机硒和GSH的发酵参数,确定富硒-GSH多形汉逊酵母的高效制备工艺,并研究富硒-GSH多形汉逊酵母对SD大鼠的抗氧化活性。以期为利用多形汉逊酵母高效、低成本协同制备有机硒和GSH提供新思路、新途径。
1 材料与方法
1.1 材料与仪器
多形汉逊酵母DL-1(H.polymorphaDL-1) 中国科学院微生物研究所邱并生研究员;富硒酿酒酵母 安琪酵母有限公司(2000 ppm Se/kg、80000800-T);SD雌性大鼠 体重(140±10) g,西安交通大学动物实验中心;抗氧化活性分析试剂盒 南京建成工程研究所;YEPD培养基:葡萄糖20 g/L、蛋白胨20 g/L、酵母浸粉10 g/L、pH6.5、0.1 MPa灭菌20 min;亚硒酸钠 天津市恒兴化学试剂制造有限公司;2-硝基苯甲酸(DTNB)Sigma公司;其余试剂 均为国产分析纯,西安科洛化学试剂有限公司。
Perkin-Elmer402 UV/VIS及紫外分光光度计 上海第三分析仪器厂;高速冷冻离心机 Sigma公司;恒温振荡培养箱 哈尔滨东联电子有限公司。
1.2 实验方法
1.2.1 多形汉逊酵母的基础发酵条件 挑取多形汉逊酵母单菌落,接入5 mL YEPD培养基中,37 ℃活化24 h,以5%的接种量,接入YEPD液体培养基中,在120 r/min、37 ℃条件下培养12 h,获得发酵种子液[20]。再以5%的接种量,将发酵种子液接入Na2SeO3终浓度为20 μg/mL的YEPD液体培养基中,120 r/min、37 ℃条件下继续培养48 h,备用。
1.2.2 富硒-GSH多形汉逊酵母制备工艺的单因素实验
1.2.2.1 亚硒酸钠的添加量 分别配制含有Na2SeO3终浓度为0、10、20、30、40、50 μg/mL的YEPD培养基,其他条件参照1.2.1进行发酵,研究亚硒酸钠添加浓度对多形汉逊酵母的无机硒转化率及其胞内谷胱甘肽产量的影响。
1.2.2.2 亚硒酸钠的添加时间 分别在0、12、24 h不同发酵时间点上,将Na2SeO3添加到发酵培养基中,Na2SeO3终浓度为20 μg/mL,其他条件参照1.2.1进行发酵,研究亚硒酸钠添加时间对无机硒转化率和胞内谷胱甘肽产量的影响。
1.2.2.3 酵母接种量 分别按2%、3%、4%、5%、6%(v/v)接种量将发酵种子液接种至含有Na2SeO3终浓度为20 μg/mL的YEPD培养基中,其他条件参照1.2.1进行发酵,研究接种量对多形汉逊酵母的无机硒转化率及其胞内谷胱甘肽产量的影响。
1.2.3 富硒-GSH多形汉逊酵母制备工艺的正交试验 基于单因素结果,以无机硒转化率和胞内GSH产量为指标,选用L9(34)正交试验表,利用正交试验法,优化多形汉逊酵母的无机硒转化率及其胞内GSH产量最佳的发酵条件。正交试验因素水平如表1所示。

表1 正交试验因素水平表Table 1 Factors and levels table of orthogonal test
1.2.4 有机硒、谷胱甘肽含量的测定
1.2.4.1 有机硒含量 分别取1、2、3、4、5 mL的1 μg/mL Na2SeO3溶液,加入1 mL 0.02 mol/L EDTA、2 mL 0.2 mol/L HCl-KCl的缓冲液、2 mL 0.6 mol/L氯酸钾、2 mL 0.03 mol/L变色酸和1 mL 0.03 mol/L盐酸苯肼,补ddH2O至15 mL进行混匀,100 ℃水浴20 min后,在520 nm波长下测定吸光值,绘制Na2SeO3的标准曲线[16-18]。
取5 mL酵母培养液于4000 r/min离心20 min,收集细胞沉淀置于2 mL Tris-HCL-甘油缓冲液(称取Tris 2.4164 g,加甘油10 mL,加ddH2O至100 mL,用盐酸调pH至8.6)中,再加等量二氧化硅,充分研磨20 min后,置于ddH2O中透析24 h,透析内液浓缩至1 ml后加等量混合酸(浓硝酸∶高氯酸=4∶1,v/v)消化30 min,获得有机硒消化液,依据Na2SeO3的标准曲线方法,测定胞内有机硒含量,无机硒转化率的计算公式如下。
式中,c1:有机硒的浓度(μg/mL);v1:有机硒消化液体积(mL);w:亚硒酸钠添加量(μg)。
1.2.4.2 谷胱甘肽含量 GSH的标准曲线的绘制参考文献操作[19]。取5 mL酵母培养液,于4000 r/min离心20 min,用90%生理盐水洗涤2次后,收集细胞加入等量破壁试剂(1% 十二烷基硫酸钠,0.1 mol/L 醋酸锂)混匀,于100 ℃条件下水浴30 min后于7000 r/min离心10 min,随后在上清液中加入1.5 mL 0.06% NaOH和0.5 mL 0.03%甲醛,静置2 min,再加入2.5 mL DTNB分析液(1 mL 0.01 mol/L DTNB 溶液与99 mL 0.25 mol/L Tris-Hcl 缓冲液混合,pH8.0)于25 ℃条件下水浴5 min,在波长412 nm下测定吸光值,根据GSH标准曲线计算胞内GSH产量。
1.2.5 富硒-GSH多形汉逊酵母对大鼠生长性能的影响 将15只SD雌性大鼠随机分成3组,每组5只。阴性对照组,饲喂出发多形汉逊酵母;阳性对照组,饲喂富硒酿酒酵母;实验组,饲喂富硒-GSH多形汉逊酵母,各组均按0.3 mg干酵母/kg日粮添加,饲养期间每隔7 d对小鼠进行称重,研究富硒-GSH多形汉逊酵母对大鼠生长性能的影响。其中,本实验所用的富硒-GSH多形汉逊酵母粉是利用最佳发酵工艺,液体培养富硒-GSH多形汉逊酵母,发酵结束后于6000 r/min、10 min条件下离心,收集酵母细胞,并将其放入烘箱(60 ℃)中2 h制备所得。
1.2.6 富硒-GSH多形汉逊酵母对大鼠血清和肝脏中硒含量的影响 按照1.2.5中条件饲养42 d后,通过心脏采血方式收集大鼠血液,置于4 ℃,3000 r/min条件下离心20 min,制备血清用于后续分析。同时,收集大鼠肝组织样品,用冷的0.85%生理盐水漂洗2次后,加入3倍体积的TE缓冲溶液(pH8.0)备用。分别取0.5 g肝组织样品和1~10 mL血清样品于不同消化瓶中,各加入10 mL混合酸及玻璃珠消化12 h。当溶液变为清亮无色并伴有白烟时,再继续加热至剩余体积2 mL左右,定容至 50 mL容量瓶中备用。吸取10 mL消化液于15 mL离心管中,加2 mL盐酸和1 mL铁氰化钾溶液,混匀后用原子荧光光谱仪进行检测,研究富硒-GSH多形汉逊酵母的硒源在大鼠血清和肝组织中的富集特点。
1.2.7 富硒-GSH多形汉逊酵母对大鼠血清和肝脏中抗氧化活性的影响 收集血清和肝组织样品后,立即利用试剂盒测定血清和肝脏中谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)活性、超氧化物歧化酶(Superoxide dismutase,SOD)活性、过氧化氢酶(Catalase from micrococcus lysodeikticus,CAT)活性、总抗氧化能力(T-AOC)、GSH和丙二醛(MDA),具体操作方法参考相应的试剂盒说明书,研究富硒-GSH多形汉逊酵母对SD大鼠的抗氧化活性。
1.3 数据统计分析
每个样本设置3个平行生物样本,每次实验设置3次技术平行,实验数据利用SPSS 19.0软件进行统计分析,并以平均数±标准差(Mean±SD)表示,差异显著性检验用方差分析。
2 结果与分析
2.1 亚硒酸钠和谷胱甘肽的标准曲线
Na2SeO3的标准曲线为Y=0.127X+0.025,R2=0.9973,其中,X表示亚硒酸钠的浓度(μg/mL),Y表示吸光度。谷胱甘肽的线性回归方程为Y=0.7154X-0.0004,R2=0.9999,其中,X表示谷胱甘肽的浓度(g/L),Y表示吸光度。
2.2 富硒-GSH多形汉逊酵母制备工艺的单因素实验结果
2.2.1 亚硒酸钠添加量对无机硒的转化率和胞内GSH产量的影响 结果如图1所示。由图1可知,Na2SeO3的添加终浓度为30 μg/mL时,多形汉逊酵母的无机硒转化率最高,为96.62%±2.65%,胞内GSH产量最高,为(88.42±3.01) mg/L。
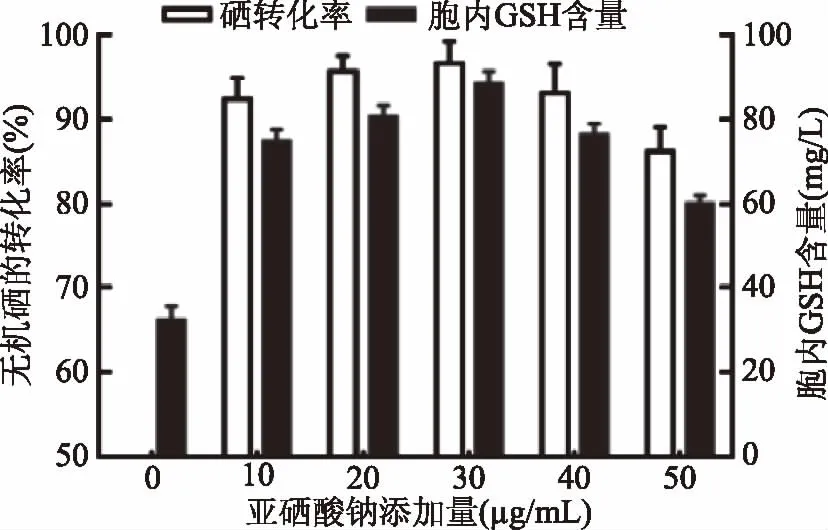
图1 亚硒酸钠添加量对无机硒的转化率和胞内GSH产量的影响Fig.1 Effects of sodium selenite addition amount on inorganic selenium conversion rate and intracellular GSH production
2.2.2 亚硒酸钠添加时间对无机硒的转化率和胞内GSH产量的影响 结果如图2所示。由图2可知,在发酵培养12 h时后,加入终浓度为20 μg/mL Na2SeO3时,多形汉逊酵母的无机硒转化率最高,为94.55%±2.45%,胞内GSH产量最高,为(87.14±2.31) mg/L。

图2 亚硒酸钠的添加时间对无机硒的转化率和胞内GSH产量的影响Fig.2 Effect of adding time of selenite on inorganic selenium conversion rate and intracellular GSH production
2.2.3 接种量对无机硒的转化率和胞内GSH产量的影响 结果如图3所示。由图3可知,当接种量为4%时,多形汉逊酵母的无机硒转化率最高,为96.44%±1.71%,胞内GSH产量最高,为(86.02±1.92) mg/L。
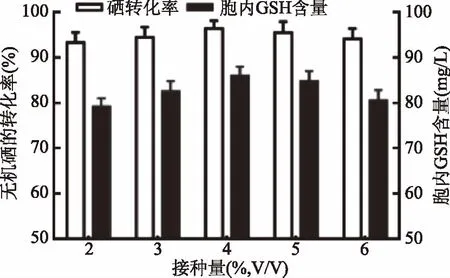
图3 接种量对无机硒的转化率和胞内GSH产量的影响Fig.3 Effect of inoculation amount on inorganic selenium conversion rate and intracellular GSH production
2.3 富硒-GSH多形汉逊酵母制备工艺的正交试验结果
正交试验结果如表2所示。以无机硒的转化率为考察指标,直观分析法分析结果显示,Na2SeO3添加量对无机硒的转化率影响最大(R=4.67),其次是接种量(R=3.54),Na2SeO3添加时间对无机硒的转化率影响最小(R=2.01);K值结果显示最佳发酵工艺为A2B2C3,即Na2SeO3添加量为30 μg/mL,接种量为4%,添加时间为12 h。以胞内GSH产量为考察指标,直观分析结果显示,Na2SeO3添加量对胞内GSH产量影响最大(R=70.25),其次是接种量(R=52.00),Na2SeO3添加时间对胞内GSH产量影响最小(R=42.43);K值结果显示最佳发酵工艺为A2B2C3,即Na2SeO3添加量为30 μg/mL,接种量为4%,添加时间为12 h。
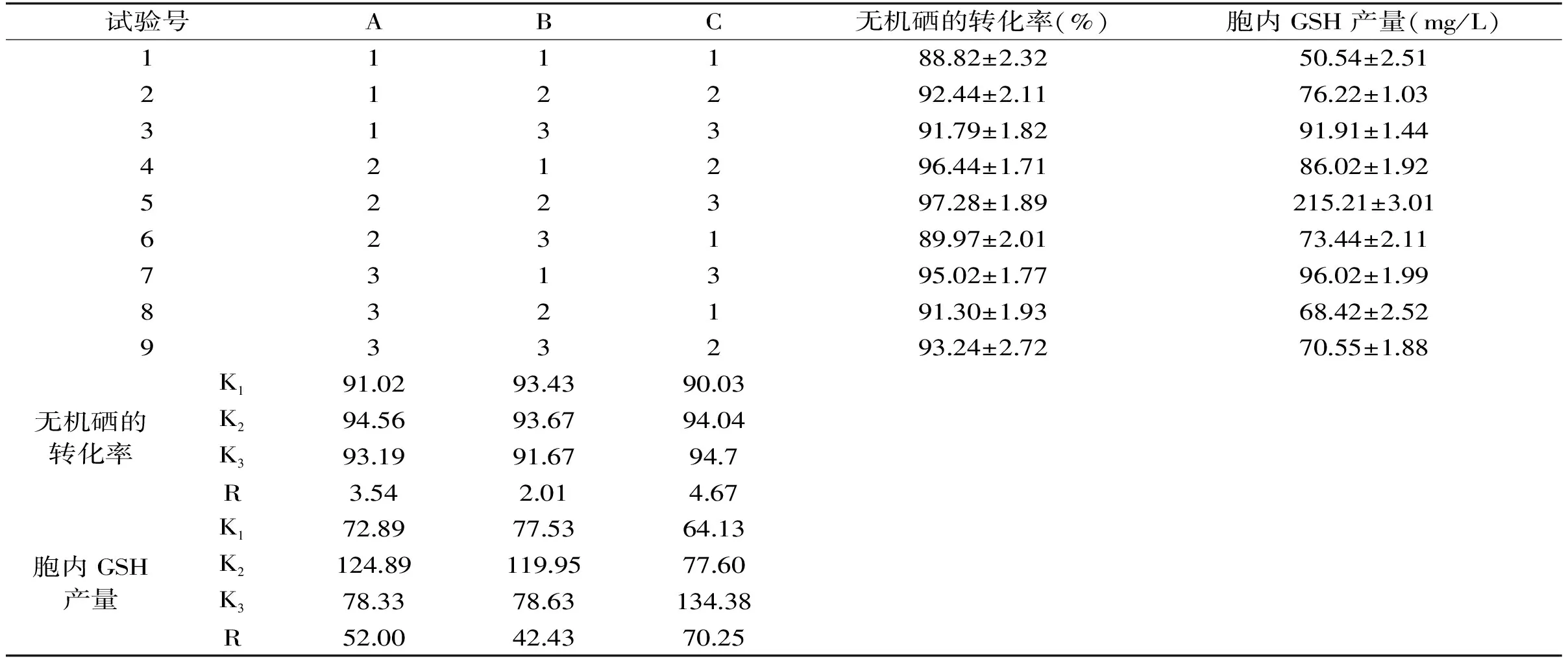
表2 正交试验结果Table 2 Results of orthogonal experiment
由于不同考察指标的极差分析结果均与正交表中5号最佳组合A2B2C3一致,因此正交实验的最佳发酵工艺为Na2SeO3添加量为30 μg/mL,接种量为4%,添加时间为12 h,此时无机硒转化率高达97.28%±1.89% ,胞内GSH产量达到(215.21±3.01) mg/L。宋照军等[22]选取嗜热链球菌为富硒菌种,通过优化其富硒条件实现嗜热链球菌的无机硒转化率为72.80%。项驷文等[23]通过优化产朊假丝酵母的培养条件及培养基成分后,产朊假丝酵母的无机硒转化率为86%。由此可知,食品级多形汉逊酵母在无机硒转化方面有一定优势,加上其营养要求简单、高密度发酵工艺成熟等优点,使其成为在富硒微生物应用开发方面潜力明显。
2.4 富硒-GSH多形汉逊酵母对SD大鼠生长性能的影响
通过给SD大鼠饲喂含不同酵母添加剂的饲料,结果如图4所示。3种饲料均能促进SD大鼠的生长,但添加富硒-GSH多形汉逊酵母组的SD大鼠平均体重为(329.7±10.6) g,极显著高于添加出发多形汉逊酵母组的SD大鼠平均体重(285.6±8.7) g(p<0.01),而添加富硒酿酒酵母组的SD大鼠平均体重(308.1±9.4) g(p<0.05),仅显著高于添加出发多形汉逊酵母组,表明富硒-GSH多形汉逊酵母对SD大鼠无明显的毒副作用,可显著促进SD大鼠的生长。
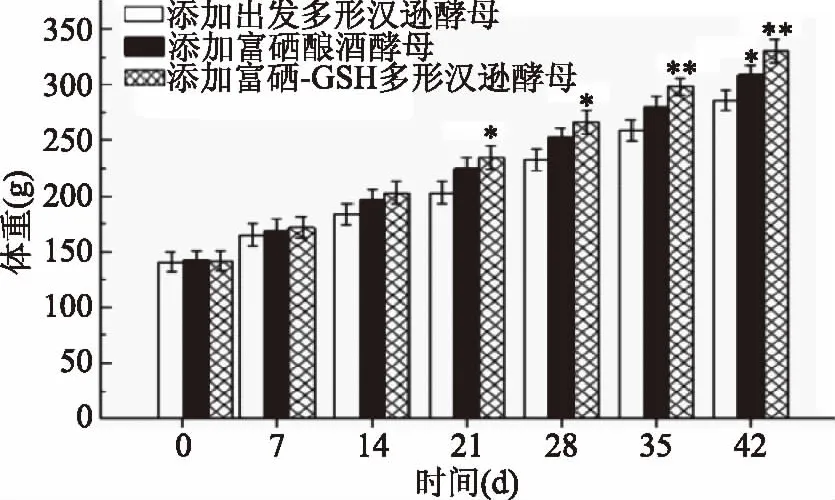
图4 不同添加剂对SD大鼠生长性能的影响Fig.4 Growth variables of rats fed with or without selenium-enriched yeast diet注:* p<0.05差异显著,** p<0.01差异极显著,*** p<0.001差异高度显著。
2.5 富硒-GSH多形汉逊酵母对大鼠血清和肝脏中硒含量的影响
由表3可知,与出发多形汉逊酵母组相比,富硒酿酒酵母组和富硒-GSH多形汉逊酵母组的SD大鼠血清硒水平分别提高了50.0%(p<0.01)、84.4%(p<0.001),SD大鼠肝脏中硒含量分别提高了34.8%、69.6%(p<0.001)。同时,富硒-GSH多形汉逊酵母对SD大鼠血清和肝脏的富集硒的作用比富硒酿酒酵母的作用优势明显(p<0.01),表明源自富硒-GSH多形汉逊酵母的硒源能明显改善SD大鼠体内的硒水平。

表3 有机硒在大鼠血清和肝脏中的含量Table 3 Selenium variables of rats with or without selenium-enriched yeast diet
2.6 富硒-GSH多形汉逊酵母对SD大鼠抗氧化活性的影响
通过给SD大鼠饲喂不同酵母添加剂的饲料,分析其对SD大鼠的抗氧化活性的影响,结果如表4所示。与出发多形汉逊酵母组相比,富硒-GSH多形汉逊酵母组的SD大鼠血清和肝脏中,GSH水平分别提高39.5%(p<0.01)、45.2%(p<0.001),T-AOC增加46.3%(p<0.01)、45.2%(p<0.05),GSH-Px增加48.3%(p<0.001)、52.3%(p<0.01),SOD增加68.4%(p<0.01)、45.1%(p<0.05),CAT增加39.5%(p<0.01)、49.6%(p<0.001),MDA降低21.3%(p<0.05)、38.5%(p<0.01)。结果表明富硒-GSH多形汉逊酵母可提高大鼠血清和肝脏中GSH-Px、CAT和SOD酶活性,增强大鼠的总抗氧化能力(T-AOC),并显著降低有害物质MDA的含量。
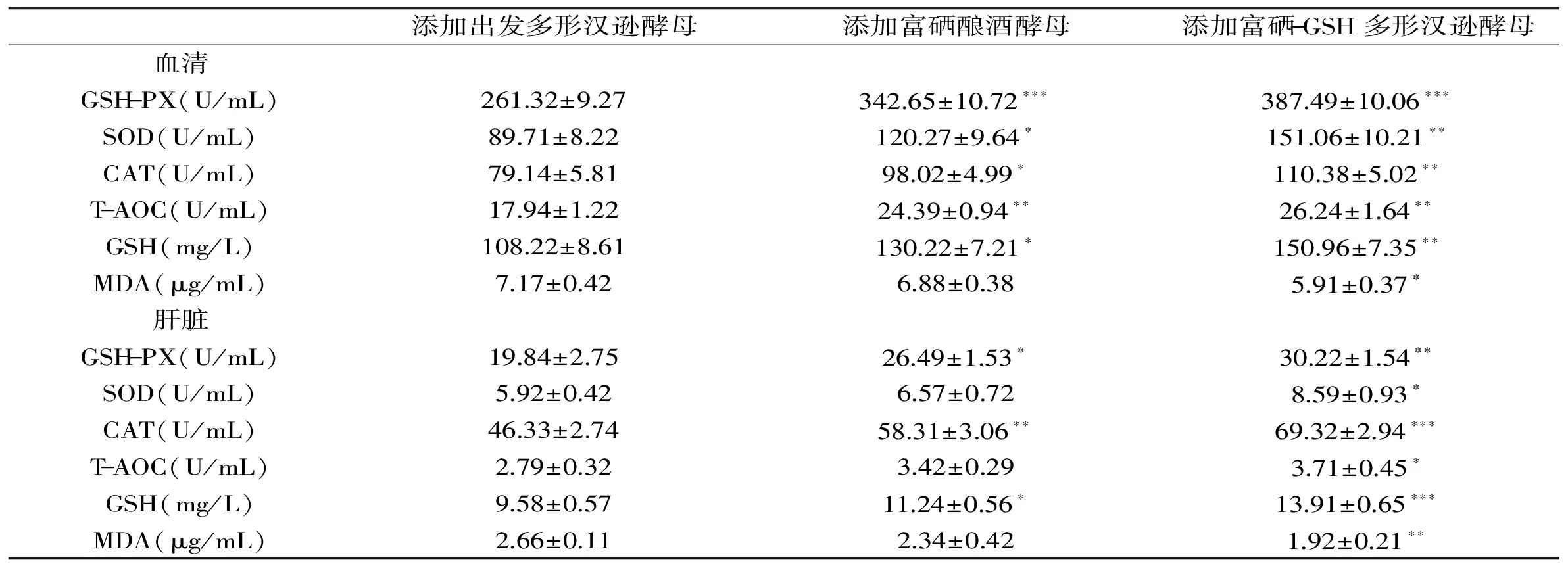
表4 不同酵母添加剂对大鼠抗氧化指标的影响Table 4 Antioxidant variables of rats fed with diverse supplements in the diet
与富硒酿酒酵母组相比,富硒-GSH多形汉逊酵母组大鼠血清和肝脏中SOD和CAT酶活性更高,从而更利于清除体内过氧化氢,对抗自由基对细胞造成的损害。同时,富硒-GSH多形汉逊酵母组大鼠血清和肝脏中MDA含量低于富硒酿酒酵母组,从而保护细胞膜免受脂质过氧化的损伤,对于维持细胞膜的完整性意义明显。此外,富硒-GSH多形汉逊酵母组大鼠体内GSH含量较高,其可以有效维持大鼠体内适宜的氧化还原环境[24]。综上可知,富硒-GSH多形汉逊酵母优势明显,应用前景广阔。
3 结论
本研究以多形汉逊酵母为富硒反应器,对其富集硒和GSH的最佳工艺及其抗氧化活性进行了研究。结果如下,在最佳发酵条件下,多形汉逊酵母的无机硒转化率为97.28%±1.89%,胞内GSH产量为(215.21±3.01) mg/L。同时,与出发多形汉逊酵母组相比,富硒-GSH多形汉逊酵母组中SD大鼠平均体重极显著提高(p<0.01),为(329.7±10.6) g,同时SD大鼠血清和肝脏中的硒水平分别提高84.4%(p<0.001)、69.6%(p<0.001),血清和肝脏中的GSH水平提高了39.5%(p<0.01)、45.2%(p<0.001),T-AOC提高了46.3%(p<0.01)、45.2%(p<0.05),GSH-Px提高了48.3%(p<0.001)、52.3%(p<0.01),SOD提高了68.4%(p<0.01)、45.1%(p<0.05),CAT提高了39.5%(p<0.01)、49.6%(p<0.001),而MDA降低了21.3%(p<0.05)、38.5%(p<0.01)。结果表明,富硒-GSH多形汉逊酵母能促进SD大鼠生长和提高大鼠的抗氧化活性。研究结果为利用多形汉逊酵母高效、低成本协同制备有机硒和GSH提供新思路、新途径,为开发新型富硒食品或饲料添加剂提供技术支撑。
--先进无机材料论坛例记(Ⅰ)

