上调微小RNA-200 a表达对非小细胞肺癌紫杉醇化疗敏感度的影响及其机制
王亚飞,宋小天,宋长亮,张磊,万良刚,杜雪菲
1邯郸市中心医院肿瘤科,河北 邯郸056000
2河北医科大学基础医学院免疫教研室,河北 邯郸056000
3冀中能源峰峰集团有限公司总医院骨科,河北 邯郸056000
在中国,肺癌的发病率和病死率均较高,其中,病死率位居恶性肿瘤的首位。根据组织学特征和临床特点,肺癌可分为小细胞肺癌和非小细胞肺癌,后者占肺癌的85%以上[1]。早期肺癌患者多无自觉症状,大多数患者确诊时已属于晚期,错失了最佳的手术治疗时机,故放疗和化疗是肺癌的主要治疗手段。术后放化疗能够有效减少肺癌的复发和转移,但部分患者常常在一线治疗后对化疗药物表现出较低的化疗敏感度,如何增强化疗药物的敏感度是化疗面临的重要难题。化疗是利用化学药物杀死肿瘤细胞,从而抑制肿瘤的生长,达到治疗肿瘤的目的。紫杉醇是从红豆杉科植物中提取的一种抗肿瘤二萜类化合物,是一种细胞周期特异性药物,在乳腺癌和肺癌等多种肿瘤的化疗中得到广泛应用,但患者常常出现抗药性和耐药性。如何实现紫杉醇在治疗过程中增敏、增效的作用是临床亟需解决的问题。微小RNA(miroRNA,miRNA)是一类具有组织特异性、高度保守性和时序性等特征的小分子非编码小RNA,在肿瘤基因表达的调控过程中具有重要的作用。miRNA-200家族是miRNA的重要组成部分,是近年来研究的热点。miRNA-200a作为miRNA-200家族中的重要一员,参与肝癌、乳腺癌和子宫内膜癌等多种肿瘤细胞的增殖、侵袭、迁移和凋亡等过程[2-4]。有研究发现,miRNA-200a在非小细胞肺癌组织及细胞中低表达,上调其表达后能够抑制肿瘤细胞的增殖、侵袭和迁移等[5-7]。但目前未见关于miRNA-200a是否参与肺癌治疗过程中紫杉醇耐药机制的相关研究,本研究以体外实验的方式采用脂质体法干扰miRNA-200a在非小细胞肺癌细胞中的表达,观察其对非小细胞肺癌细胞紫杉醇化疗敏感性的影响,并探讨其可能的作用机制,为逆转肺癌化疗耐药性提供新的方向和理论依据,现报道如下。
1 材料与方法
1.1 材料
正常人肺上皮16HBE细胞株和人肺癌A549细胞株均购自美国ATCC公司,miRNA-200a模拟物(miRNA-200a mimics)、miRNA-200a阴性对照(mimics NC)和聚合酶链反应(polymerase chain reaction,PCR)引物均购自上海吉玛公司,RNA逆转录试剂盒、荧光定量逆转录聚合酶链反应(quantitative reverse transcription polymerase chain reaction,qRT-PCR)试剂盒和荧光定量PCR仪均购自美国TaKaRa公司,胎牛血清购自杭州四季青公司,RPMI-1640培养基、胰蛋白酶、青霉素、链霉素、LipofectamineTM2000和电化学发光(electrochemiluminescence,ECL)试剂均购自美国Invitrogen公司,紫杉醇(纯度99.5%)购自西安天丰生物科技有限公司,噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)检测分析试剂盒、二喹啉甲酸(bicinchoninincacid,BCA)蛋白浓度检测试剂盒、放射免疫沉淀法(radioimmunoprecipitation assay,RIPA)裂解液和Trizol试剂均购自上海碧云天生物技术有限公司,二甲基亚砜(dimethyl sulphoxide,DMSO)、十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)和聚偏二氟乙烯(polyvinylidene fluoride,PVDF)均购自美国 Sigma公司,β-连环蛋白(β-catenin)抗体、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体和辣根过氧化物酶标记的IgG-HRP二抗均购自北京中杉金桥生物技术有限公司,酶标仪和凝胶成像系统均购自美国Bio-rad公司。
1.2 方法
1.2.1 细胞培养将复苏后的正常人肺上皮16HBE细胞和肺癌A549细胞接种于含10%胎牛血清、100 μg/ml链霉素和 100 U/ml青霉素的 RPMI-1640培养基上,置于5%CO2、95%湿度和37℃的恒温培养箱中进行培养,隔1天换液1次,待细胞几乎铺满整个培养瓶时,以0.25%胰蛋白酶进行消化传代。收集对数生长期的细胞进行后续实验。
1.2.2 qRT-PCR检测采用qRT-PCR法检测miRNA-200a的相对表达量。收集对数生长期的正常人肺上皮16HBE细胞和A549细胞,采用Trizol法提取两种细胞中的总RNA,采用紫外分光光度计检测所提取的总RNA浓度及纯度。采用RNA逆转录试剂盒将总RNA逆转录为cDNA。以cDNA为模板,根据miRNA-200a特异性引物、内参U6引物及相应的组分配成20 μl的反应体系(Master mix10 μl、上下游引物各0.8μl,DNA模板2μl,ddH2O 6.4 μl),以95℃ 5 min(1个循环)、95℃ 30 s(35个循环)、58℃ 30 s(35个循环)、72℃ 2 min(35个循环)和72℃6 min(1个循环)的反应条件进行PCR扩增。以U6为内参。应用2-△△Ct法计算miRNA-200a的相对表达量。实验重复3次。
1.2.3 细胞转染及分组取对数生长期的A549细胞,将其分为空白对照组、mimics NC组和miRNA-200a mimics组,按照LipofectamineTM2000转染试剂说明书的实验步骤将miRNA-200a模拟物和转染试剂混合物转至miRNA-200a mimics组细胞中,miRNA-200a阴性对照和转染试剂混合物转至mimics NC组细胞中,空白对照组中只加入转染试剂。其中,miRNA-200a模拟物和miRNA-200a阴性对照的浓度均为25 μmol/L。转染48 h后,按照1.2.2中的步骤检测各组细胞的转染效果。
1.2.4 MTT法检测收集对数生长期的A549细胞,调整细胞浓度为105/ml,以每孔1 ml接种至96孔细胞培养板上。将其随机分为紫杉醇组和miRNA-200a+紫杉醇组。其中,miRNA-200a+紫杉醇组细胞先以脂质体法转染miRNA-200a模拟物,紫杉醇组细胞不进行转染,转染6 h后,继续培养24 h。当细胞融合度达到80%左右时,两组细胞分别加入终浓度为2、4、8、16、32 nmol/L的紫杉醇溶液,处理反应24 h后,加入浓度为5 g/L的MTT溶液10 μl,避光孵育4 h后,弃培养液,加入DMSO溶解结晶物后,采用全自动酶标仪于490 nm处检测两组细胞的吸光度值,计算两组细胞相应浓度的细胞增殖抑制率,并计算出半抑制浓度(half maximal inhibitory concentration,IC50)。其中,每个浓度重复3次。
1.2.5 蛋白质印迹法(Western blot)检测取对数生长期的A549细胞,制成细胞悬液后,以105/ml细胞接种至96孔板上,将其随机分为空白对照组、miRNA-200a mimics组、紫杉醇组和miRNA-200a+紫杉醇组。按照1.2.3中的实验方法转染miRNA-200a模拟物至miRNA-200a mimics组和miRNA-200a+紫杉醇组细胞,空白对照组和紫杉醇组细胞不进行处理,4组细胞继续培养48 h后,以8 nmol/L的紫杉醇处理紫杉醇组和miRNA-200a+紫杉醇组细胞,处理24 h后,收集各组细胞,以RIPA提取细胞总蛋白,BCA蛋白定量检测试剂盒检测其纯度及浓度。取变性后的50 μg样品蛋白,注入SDSPAGE凝胶中进行电泳分离,转至PVDF膜上后,置于5%的脱脂奶粉封闭液中处理1 h,加入稀释浓度为1∶1000的β-catenin抗体和GAPDH抗体,4℃下孵育过夜。次日,洗膜后加入稀释浓度为1∶2000的IgG-HRP二抗,于37℃下孵育2 h,以ECL显色。以GAPDH为内参,计算目的蛋白的相对表达量。
1.3 统计学方法
采用SPSS 21.0软件对数据进行统计分析。计量资料以均数±标准差(±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析(one-way ANOVA),两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 miRNA-200 a在非小细胞肺癌 A549细胞中的相对表达量
非小细胞肺癌A549细胞中miRNA-200a的相对表达量为(0.26±0.08),明显低于正常人肺上皮16HBE细胞的(1.02±0.03),差异有统计学意义(t=15.407,P<0.01)。
2.2 转染后 A549细胞中miRNA-200 a的相对表达量
转染48 h后,空白对照组、mimics NC组、miRNA-200a mimics组细胞中miRNA-200a的相对表达量分别为(1.06±0.12)、(1.18±0.25)和(5.02±0.16),3组细胞中miRNA-200a的相对表达量比较,差异有统计学意义(F=445.487,P<0.01)。mimics NC组细胞中miRNA-200a的相对表达量与空白对照组比较,差异无统计学意义(t=0.795,P>0.05);miRNA-200a mimics组细胞中miRNA-200a的相对表达量明显高于空白对照组,差异有统计学意义(t=26.239,P<0.01)。miRNA-200a mimics组细胞中miRNA-200a的相对表达量明显高于mimics NC组,差异有统计学意义(t=22.408,P<0.01)。
2.3 miRNA-200 a对紫杉醇化疗药物敏感度的影响
MTT法检测结果显示,随着紫杉醇浓度的增加,A549细胞受到的增殖抑制作用明显增强,且呈一定的浓度依赖性;与紫杉醇组相比,转染miRNA-200a mimics后,随着紫杉醇浓度的增加,A549细胞受到的增殖抑制作用增强(t=4.279、5.968、4.107、3.801、2.825,P< 0.05)。miRNA-200a+紫杉醇组的IC50为5.90 nmol/L,紫杉醇组的IC50为 9.57 nmol/L。(表1)
表1 不同浓度紫杉醇溶液处理后 A549细胞增殖抑制率的比较(%,±s)

表1 不同浓度紫杉醇溶液处理后 A549细胞增殖抑制率的比较(%,±s)
注:*与紫杉醇组比较,P<0.05
组别紫杉醇组miRNA-200a+紫杉醇组紫杉醇浓度(nmol/L)2 18.2±1.4 25.7±2.6*48 23.1±3.0 37.3±2.8*43.8±5.2 58.7±3.5*16 62.4±3.8 75.8±4.9*32 71.2±5.1 84.7±6.2*
2.4 转染联合紫杉醇对Wnt/ β-catenin信号通路相关的 β-catenin蛋白的影响
空白对照组、紫杉醇组、miRNA-200a mimics组和miRNA-200a+紫杉醇组细胞中β-catenin蛋白的相对表达量分别(0.78±0.03)、(0.62±0.05)、(0.48±0.05)和(0.25±0.04),4组细胞中β-catenin蛋白的相对表达量比较,差异有统计学意义(F=73.12,P<0.01)。与空白对照组相比,紫杉醇组、miRNA-200a mimics组和miRNA-200a+紫杉醇组细胞中β-catenin蛋白的相对表达量均明显降低(t=4.526、8.485、14.991,P<0.01);与紫杉醇组相比,miRNA-200a+紫杉醇组细胞中β-catenin蛋白的相对表达量明显降低,差异有统计学意义(t=10.465,P<0.01)。(图1)
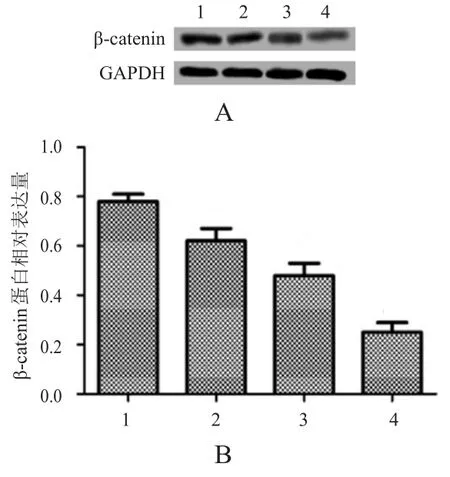
图1 转染联合紫杉醇处理后 A549细胞β -catenin蛋白的表达情况
3 讨论
miRNA-200家族通过抑制上皮-间质转化在肿瘤转移的过程中扮演着重要的角色。miRNA-200a是miRNA-200家族的重要成员,在多种肿瘤组织中表达水平较低,以抑癌基因的角色参与肿瘤细胞的增殖、凋亡等生理过程[8]。有研究表明,miRNA-200a还参与多种肿瘤化疗药物的耐药过程,如Liu等[9]研究发现,过表达miRNA-200a可能通过调控与耐药相关的ABC家族基因的表达,增加卵巢肿瘤细胞对紫杉醇的敏感度;沈阿灵等[10]研究发现,上调miRNA-200a表达可逆转大肠癌细胞对5-氟尿嘧啶的耐药性。目前,关于miRNA-200a对非小细胞肺癌化疗药物敏感度的研究较少,本实验通过脂质体法上调肺癌A549细胞中miRNA-200a的表达后,加入紫杉醇药物进行处理,采用MTT法检测miRNA-200a对紫杉醇处理的A549细胞的增殖抑制情况的影响。结果发现,miRNA-200a+紫杉醇组细胞的IC50为5.90 nmol/L,紫杉醇组的IC50为9.57 nmol/L,表明上调miRNA-200a表达能够增强A549细胞对紫杉醇化疗药物的敏感度。
Wnt/β-catenin信号通路是经典的Wnt通路,是机体正常生长发育的重要途径。Wnt/β-catenin信号通路的异常表达与非小细胞肺癌细胞增殖、分化及凋亡等过程密切相关[11-13]。β-catenin作为Wnt/β-catenin信号通路调控的核心因子,是Wnt/βcatenin通路激活的重要标志。有研究表明,紫杉醇可调控多种肿瘤细胞中的Wnt/β-catenin信号通路,如Fu等[14]研究发现,卵巢癌对化疗药物紫杉醇的治疗可产生耐药性,这种耐药性与Wnt/β-catenin信号通路有关,在人卵巢癌细胞株A2780和SKOV3中,紫杉醇能够诱导β-catenin表达;涂雪松等[15]研究指出紫杉醇可能通过阻断Wnt/β-catenin信号通路抑制人鼻咽癌细胞株HONE1的增殖,并促进其凋亡。侯峰强等[16]研究发现,紫杉醇通过抑制胆管癌QBC939细胞内β-catenin蛋白的表达,阻断Wnt/β-catenin信号通路。Wnt/β-catenin信号通路中βcatenin蛋白的表达还受miRNA-200a的调控。Su等[17]指出,miRNA-200a通过与β-catenin相互作用,可阻断胃癌SGC790细胞和胶质瘤U251细胞中的Wnt/β-catenin信号通路。为了进一步探讨过表达miRNA-200a能够增强A549细胞对紫杉醇化疗药物敏感度的作用机制,本研究上调肺癌A549细胞中miRNA-200a的表达后,加入紫杉醇药物进行处理,并采用Western blot检测肺癌A549细胞中Wnt/β-catenin信号通路相关蛋白β-catenin的表达,结果发现,与空白对照组相比,紫杉醇组、miRNA-200a mimics组和miRNA-200a+紫杉醇组细胞中βcatenin蛋白的相对表达量均有所降低,并且miRNA-200a+紫杉醇组细胞中β-catenin蛋白的相对表达量明显低于紫杉醇组(P<0.01)。结果提示,上调miRNA-200a表达可通过阻断Wnt/β-catenin信号通路增强A549细胞对紫杉醇化疗药物的敏感度。
总之,本研究通过体外实验证实上调miRNA-200a表达能够增强A549细胞对紫杉醇化疗药物的敏感度,其作用机制与抑制Wnt/β-catenin信号通路有关,也提示miRNA-200a可能是提高紫杉醇放疗敏感度的潜在靶点,为治疗非小细胞肺癌提供了新的线索。

