孕鼠注射海洛因对仔鼠小脑组织和 抗氧化物酶活性的影响
俞诗源,何玲慧,朱嘉宁,陈 诚,王小勇*
(西北师范大学生命科学学院,甘肃兰州 730070)
海洛因(Heroin),学名二乙酰吗啡(Diacetylmorphine hydrochloride),具有吗啡的镇痛和麻醉功能,易成瘾.海洛因溶于水,脂溶性强,吸收、扩散快,进入体内作用强、起效快,能很快透过血脑屏障与脑内相应的受体结合而产生强烈的毒性反应.海洛因可导致呼吸抑制引起脑缺血缺氧,发生脑水肿而致神经元损伤和消失[1].如果妊娠期女性或哺乳期女性吸食海洛因有可能影响胎儿或婴幼儿的生长发育,如果子宫内海洛因暴露可引起新生儿发育迟缓和神经行为损伤,导致机体认知行为缺陷[2-3].
有研究显示海洛因可使小鼠下丘脑和海马组织结构受损[4],但阿片类毒品是否通过母鼠胎盘影响仔鼠小脑组织结构和抗氧化应激系统鲜有研究.为了研究妊娠期女性或哺乳期女性吸食兴奋剂对婴幼儿小脑组织结构及抗氧化酶活力的影响,文中以昆明小鼠为模型,给孕鼠注射不同剂量的海洛因溶液,通过观察其仔鼠小脑组织结构和过氧化氢酶活性以及谷胱甘肽、丙二醛含量的变化,分析探讨孕鼠使用兴奋剂后对仔鼠器官功能的影响.
1 材料和方法
1.1 实验试剂
盐酸海洛因(甘肃省公安厅提供)用蒸馏水配制成2,4和6 g·L-1浓度梯度的水溶液(根据小鼠半数致死剂量和成瘾剂量配制而成[4]),4 ℃下保存备用,谷胱甘肽(GSH)、过氧化氢酶(CAT)和丙二醛(MDA)测定试剂盒购于南京建成生物工程研究所.
1.2 实验动物及给药
选昆明小鼠96只(兰州大学医学动物中心提供,体重30~40 g),按雌雄小鼠1∶1合笼交配,次日早晨做雌鼠阴道检查,出现阴栓或精子涂片观察到精子即记为妊娠第1 d.48例受孕小鼠随机分为4组(对照组和海洛因1,2,3组,每组12只).各海洛因组孕小鼠从受孕第9天开始腹腔分别注射2,4,6 g·L-1的海洛因溶液0.2 mL,每天2次(9:30,16:30),直到孕鼠分娩后第15 d,对照组注射等量生理盐水.分别在仔鼠出生后第5,10,15 d用电子天平称量仔鼠体重后,断头处死[5],再迅速取仔鼠小脑在预冷的生理盐水中漂洗后称重,左半小脑入-20 ℃冰箱冻存,右半小脑入15%的福尔马林液中固定备用.
1.3 酶活性测定
分别取上述冻存的各组仔鼠小脑组织块,精确称重后,滴加小脑组织重量9倍的生理盐水,冰浴匀浆5 min,制成10%的组织匀浆,用高速冷冻离心机(TGL.16 M型,Beckman公司,美国)3 000 r·min-1离心10 min,用微量移液器吸取上清液,按照试剂盒的操作要求,用V-5000可见分光光度计(上海元析仪器有限公司)在420,405,532 nm检测GSH、CAT及MDA的吸光度值.
1.4 小脑组织观察
将福尔马林液中固定的各组仔鼠小脑组织块常规石蜡包埋,连续切片(厚度6 μm),HE染色,光学显微镜(Nikon HFX-ⅡA)下观察并摄片.
1.5 数据处理
用SPSS 15.0统计学软件对实验数据进行分析,结果以均值±标准差表示.
2 结果与分析
2.1 仔鼠体重和小脑重及小脑指数的变化
由图1和图2(不同小写字母表示组间差异显著,下同)可知,孕鼠注射海洛因后,仔鼠的体重、小脑重均有不同程度降低.海洛因剂量越大,仔鼠体重、小脑重下降越多,与对照组相比差异显著(P<0.05).由图3知,孕鼠注射海洛因后,仔鼠出生5 d时小脑指数略有升高,但10 d,15 d时均低于对照组(P<0.05).

图1 海洛因对仔鼠体重的影响
2.2 仔鼠CAT活性和GSH、MDA含量的变化
由图4~6可知,孕鼠注射海洛因后,仔鼠小脑组织CAT活性及GSH含量均有不同程度的降低,与对照组相比差异显著(P<0.05),而仔鼠小脑组织MDA含量则升高,与对照组相比差异显著(P<0.05).
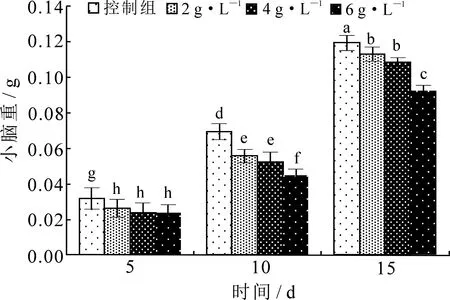
图2 海洛因对仔鼠小脑重的影响
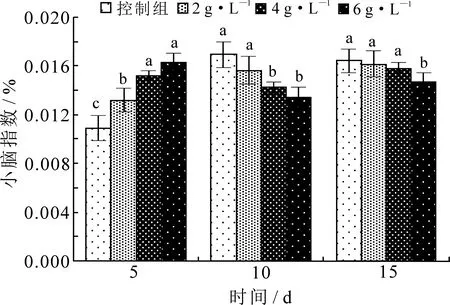
图3 海洛因对仔鼠小脑指数的影响

图4 海洛因对仔鼠小脑组织过氧化氢酶活性的影响
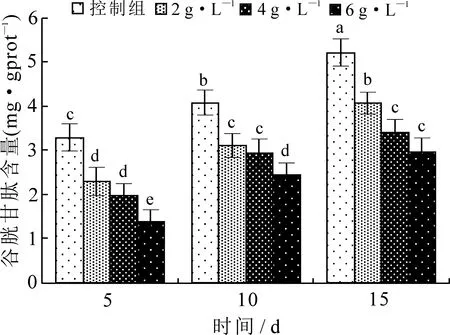
图5 海洛因对仔鼠小脑组织谷胱甘肽含量的影响

图6 海洛因对仔鼠小脑组织丙二醛含量的影响
2.3 仔鼠小脑组织结构的变化
给孕鼠注射海洛因后对仔鼠小脑组织结构的影响见图7.研究结果显示,对照组仔鼠小脑组织结构完整清晰,界限分明,细胞排列整齐,染色正常(图7A).孕鼠连续注射海洛因后,仔鼠小脑组织出现不同程度的病理性变化,细胞排列疏松而凌乱,细胞界限不清,浦肯野细胞形态不规则,出现细胞核固缩、凝集等异常改变或细胞空泡化和凋亡等现象(图7B~D).
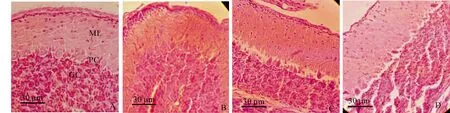
A.对照组10 d小脑皮层,HE染色,下同;B.2 g·L-1海洛因组10 d小脑皮层;C.4 g·L-1海洛因组10 d小脑皮层;D.6 g·L-1海洛因组15 d小脑皮层, 标尺=30 μm;ML.分子层;PC.浦肯野细胞层;GC.颗粒细胞层,标尺=30 μm
图7 仔鼠小脑组织结构的变化
Fig 7The changes of cerebellum histological structure in newborn mice
3 讨论
3.1 海洛因对仔鼠小脑重、体重及小脑指数的影响
小脑参与调节躯体平衡和肌肉张力、协调机体的随意运动,如果损伤小脑,机体就会出现供给失调、步态不稳等多种症状[6],海洛因作用于阿片受体通过释放内源性阿片样物质或形成复合物,可造成脑部多个区域损伤[7].长期使用兴奋剂机体内分泌系统及其功能将受到极大的影响,激素分泌受到抑制,造成机体生长迟缓[7],影响动物下丘脑摄食中枢的发育及功能,影响动物的食欲,导致食量减少,影响机体的发育和体重及器官重量[8].本实验各期海洛因组仔鼠体重和小脑重均低于对照组,可能是因为海洛因通过胎盘屏障或乳汁进入仔鼠体内,再通过血脑屏障,直接作用于发育中的神经细胞,影响神经细胞的发育和仔鼠的行为,导致小鼠兴奋性增强,疲劳感消失,睡眠减少,活动量加大,增加了机体物质的消耗,使得动物生长迟缓,海洛因的毒性作用亦可能干扰了体内能量代谢过程,造成代谢紊乱[9],影响动物的食欲,使得动物营养物质摄入不足,导致体重和器官重量下降及器官指数下降.
3.2 海洛因对仔鼠小脑抗氧化物酶的影响
GSH、CAT是机体抗氧化系统的重要组成部分.CAT具有清除氧自由基、保护细胞免受氧化损伤的作用,GSH可与H2O2反应生成H2O,通过减少H2O2含量来消除·OH的生成,对机体细胞结构和功能完整有重要的保护作用.MDA是脂质过氧化反应过程中不饱和脂肪酸氧化分解释放出的反应性醛,可严重破坏细胞膜结构,导致细胞肿胀、坏死,其含量的高低反映机体细胞遭受自由基攻击的程度[14].海洛因、可卡因及安非他明等可诱导细胞凋亡的发生,引起神经细胞变性、坏死[7,15,16].有研究显示麻黄素可使肺组织[17]、心肌细胞[18]、肝[19]、卵巢[20]、肾[21]组织发生脂质过氧化损伤使组织中的抗氧化物酶活性降低,MDA含量升高.本实验结果显示,给孕鼠注射海洛因后仔鼠小脑组织CAT活力和GSH含量下降,MDA含量上升,表明孕鼠注射海洛因影响仔鼠小脑组织的抗氧化能力,会影响小脑的结构与功能.
3.3 海洛因对仔鼠小脑组织结构的影响
海洛因可与体内内源性阿片样物质竞争结合阿片受体,如果长时间使用海洛因会导致机体兴奋剂依赖.海洛因可通过血脑屏障,直接抑制呼吸中枢,造成机体呼吸抑制,导致机体缺氧,出现全身缺血缺氧,促使机体器官损伤,损害脑细胞,影响人的学习、记忆、情感、情绪等功能活动[22-24],有研究显示麻黄素可使小鼠下丘脑、海马[25]、大脑额叶[26]组织结构受损.本实验显示孕鼠注射海洛因影响仔鼠的体重和小脑重量及小脑指数,仔鼠小脑组织出现不同程度的病理性变化,细胞排列疏松而凌乱,细胞界限不清,浦肯野细胞形态不规则,出现细胞核固缩、凝聚等异常改变或细胞空泡化和凋亡现象等,这可能是孕鼠注射海洛因后,后者通过胎盘屏障或乳汁进入仔鼠体内影响了仔鼠脑的结构与功能,表明母鼠使用海洛因影响仔鼠小脑的组织结构.
综上所述,母鼠注射海洛因,可能通过胎盘屏障或乳汁进入仔鼠体内,再通过血脑屏障,直接作用于发育中的神经细胞,使仔鼠机体重量、器官重量及器官指数降低,影响仔鼠脑组织抗氧化酶活性,对仔鼠脑组织有明显的损伤作用,其具体机制有待进一步研究和探讨.

