LHX6基因在肝癌转移中的作用机制及临床预后意义
袁堂战,蒋珂,程海涛,朱湘南
(1.南昌大学第四附属医院普外科,江西 南昌 330003;2.南昌大学第四附属医院消化内科,江西 南昌 330003)
人类LHX6(LIM homeobox domain 6)基因定位在9号染色体的q33.2位置,是编码LIM同源域的一类转录因子[1]。已有研究表明,LHX6参与了胚胎发育过程和多器官系统的形态发生,包括头部发育、颅颌面发育和生殖细胞分化等过程,尤其在皮层和海马中的神经元迁移和分化中具有重要功能[2-3]。近些年来,有研究认为LHX6基因甲基化可以作为一个识别头颈癌的甲基化标记物,而在乳腺癌、宫颈癌、结肠癌等多种癌症中则可能具有重要的早期诊断价值[4-5]。最近的研究显示,LHX6在肺癌中是一个潜在的受DNA甲基化调控的典型抑癌基因[6]。
肝细胞癌(以下简称肝癌)是世界上最常见、恶性程度最高的肿瘤之一,位居全球恶性肿瘤发病率的第6位,死因的第3位[7]。在我国,肝癌(HCC)仅次于肺癌,是位列第2位的恶性肿瘤杀手,占我国全部恶性肿瘤死亡人数的18.8%。截至目前,已确定了以手术治疗为核心的肝癌综合治疗方案[8],但目前肝癌的总体治疗效果仍难令人满意,术后5年复发率高达60%(小肝癌也达40%~50%)[9]。因此,我们有必要探寻新的肝癌分子生物学标记物,为肝癌的靶向治疗提供有效的药物靶点。
LHX6基因在肝癌中的具体抑癌分子机制以及在临床预后中的意义目前还不清楚。前期实验中,我们通过对54例肝癌组织标本检验,发现LHX6在肝癌组织中呈显著低表达,并且其表达水平与肝癌临床病理因素相关,包括病理分级、肿瘤大小等。本次研究,我们收集80例肝癌组织标本,通过免疫组织化学染色观察肝癌侵袭指标的表达状况,同时,通过体外和体内的肝癌细胞培养,探索LHX6基因在肝癌转移中的表达、作用、机制及可能的临床预后意义。
1 材料与方法
1.1 材料
1.1.1 试剂与仪器 人肝癌细胞株HepG2由本实验室保存;pcDNA3.1(+)/LHX6重组质粒、siRNA-LHX6由本实验室构建;MTT试剂盒、反转录试剂盒、RT-PCR试剂盒(美国Bio-Rad Laboratories公司);DMEM培养基、Opti-MEM、胰蛋白酶、胎牛血清、双抗、PBS(美国Gibco公司);E-cadherin多克隆抗体、Vimentin多克隆抗体、Snail多克隆抗体(英国Abcam公司)、荧光染料标记的680驴抗兔第二抗体、荧光染料标记的780羊抗鼠第二抗体、荧光素标记兔抗鼠第二抗体(美国LI-COR公司);免疫组织化学试剂盒、二胺基联苯胺(DAB)显色盒(北京中杉金桥生物技术有限公司),ABC试剂盒(美国Vector Lab)。
1.1.2 实验动物 BALB/C裸小鼠购自南昌大学动物实验中心,鼠龄6周,体质量18~25 g,于室温22~26℃,相对湿度40%~60%的SPF级动物实验室饲养,垫料、水及饲料均经高压灭菌处理,每3天更换一次,笼具浸泡在1∶1 000的新洁尔灭中消毒。
1.1.3 临床标本 80例临床肝癌标本收集来自于南昌大学第四附属医院,标本收集取得患者同意,所有标本均经病理学检查证实。
1.2 方法
1.2.1 免疫组织化学染色观察侵袭指标的表达状况
(1)LHX6基因免疫组化染色:将临床肝癌标本,经4%多聚甲醛固定,常规石蜡包埋,制成5 μm厚的连续切片。常规二甲苯脱蜡,梯度乙醇水化,经甲醇配置的1%H2O2和3%胎牛血清处理;加入LHX6 37℃孵育1 h,置4℃环境下过夜,PBS洗涤;滴加生物素标记第二抗体37℃孵育1 h,PBS洗涤;加ABC 37 ℃ 1 h;DAB显色,脱水、透明、干燥、封片。
(2)侵袭指标免疫组化染色:将临床肝癌标本,经4%多聚甲醛固定,常规石蜡包埋,制成5 μm厚的连续切片。ECadherin、Vimentin、Snail抗体工作液浓度分别为1∶50、1∶100、1∶50。免疫组织化学SP法进行染色,具体步骤:放置组织切片于烤箱,68℃20 min;常规二甲苯脱蜡,梯度乙醇脱水;0.01 mmol/L枸橼酸缓冲液高温抗原热修复15 min,冷却至室温,3%H2O237℃孵育20min,正常羊血清工作液封闭30 min;依次滴加第一抗体4℃过夜,滴加生物素标记第二抗体37℃孵育20 min;滴加辣根过氧化物酶标记的链霉素卵白素工作液37℃孵育30 min;DAB显色,苏木素复染,常规脱水、透明、干燥、封片。
1.2.2 体外肝癌细胞培养
(1)细胞培养:人肝癌细胞株HepG2用含10%胎牛血清的DMEM培养基,置于37℃、5%CO2平衡湿度培养箱中培养,每隔3天换1次液。当观察到细胞生长处于对数期时(细胞生长铺满度约为80%时),然后向培养基内加入用0.25%的胰蛋白酶消化约3 min后,使用倒置显微镜对消化细胞形态进行观察,若发现细胞回缩、细胞间期变大,停止消化。制成细胞悬液后进行传代培养,当细胞铺满器皿的底面后方可应用。
(2)LHX6:质粒转染及siRNA转染从NCBI数据库中调取LHX6全基因序列,GI号:55958142。根据LHX6基因序列设计引物,见表1。
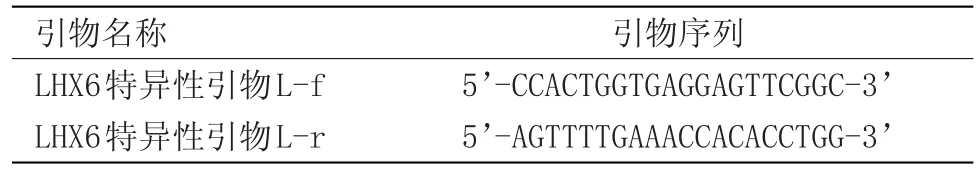
表1 LHX6基因引物名称Table 1 LHX6 gene primer name
将所需要的转染试剂和质粒或siRNA按照固定比例加入无血清培养液中,轻敲拍打混匀,室温避光孵育20 min。将转染混合物均匀逐滴加入细胞培养板中孵育。在培养箱中进行培养约6 h,然后再用含有10%的小牛血清完全培养基进行培养。
(3)RT-PCR法:按美国Bio-Rad Laboratories公司的实时定量PCR试剂盒说明书提取细胞总RNA,微量核酸分析仪测定RNA浓度和纯度;DEPC水将RNA浓度稀释成1μg/μl,取2 μl行反转录合成cDNA;按试剂盒进行PCR扩增。PCR反应条件:95℃4 min进行预变性,95℃20 s进行变性,65℃20 s进行退火,75℃15 s进行延伸,共进行40个循环扩增。以GAPDH作为内参。用2-ΔΔCt法计算LHX6基因的相对表达量。
(4)MTT法检测细胞增殖:收集感染后24 h的细胞,将细胞重悬,以每孔5×103个接种于96孔板,每孔200 L,并设置5个复孔。继续培养细胞0、24、48及72 h,采用MTT法检测细胞生长活性(以490 nm波长处的吸光度值表示),待测孔加入20 L MTT,4 h后弃去旧培养基,每孔加入150 L DMSO后水平摇床上轻摇10 min使结晶充分溶解,在酶标仪上于490 nm波长处测定吸光度值,以MTT比色值为纵坐标,时间为横坐标绘制出各组细胞的生长曲线。
(5)细胞划痕实验检测细胞迁移侵袭能力:将处理后的转染细胞,按照2×105/ml的密度,接种入含有玻片的24孔的板内,然后将l ml的细胞悬液加入每孔内,轻轻的混匀。在完全培养基上孵育48 h后,然后更换1%的胎牛血清的DMEM培养液,继续孵育。然后用100 μl的无菌tip头在玻片上垂直划2条平行线,后用PBS清洗1次;分别在培养0 h和48 h时取玻片观察。用PBS清洗取出的玻片3次,然后将玻片放进用甲醇∶乙酸(3∶1比例)的固定液中约固定30 min后,取出玻片后用PBS清洗3次并晾干。然后使用吉姆萨染液对玻片进行染色15 min后,使用清水清洗玻片,晾干后放置在显微镜下拍照观察。计算划痕修复率。
划痕修复率=(0 h的划痕宽度-48 h的划痕宽度)/0 h的划痕宽度×100%。
1.2.3 小鼠肝癌移植模型及肿瘤进展观察
(1)原位肝癌模型(肝门静脉注射组):将小鼠分为3组,即空白对照组、LHX6基因低表达组以及LHX6基因高表达组,空白对照组每组10只小鼠,其余两组每组15只小鼠,雄性。收集处于生长对数期的转染细胞,按照LHX6基因高低表达将两组细胞分别稀释至2×106cells/ml,在无菌条件下各取250 μl细胞悬液对LHX6基因低表达组以及LHX6基因高表达组小鼠进行肝门静脉接种,各接种12只。对照组小鼠在肝门静脉接种等量的生理盐水。每周观察1次,连续观察4周,观察瘤块大小、皮下浸润、远处转移和腹腔播散情况,记录皮下肿瘤生长曲线。
(2)皮下肝癌模型(腋部皮下注射组):皮下动物模型则将细胞悬液接种于腋部皮肤皮下,分组情况、观察情况与原位肝癌模型一致。
(3)观察指标:接种肝癌细胞后,观察小鼠的精神状态、饮食饮水等一般状况及死亡情况。在种植肝癌细胞后的7天、10天、13天、16天、19天、22天、25天、28天,用游标卡尺测量每次观察时皮下肿瘤大小,按下列公式计算肿瘤体积(tumor volume,TV),TV=0.5×a×b2(其中a、b分别表示长、宽)。
(4)解剖学及组织病理学观察:4周后,采用颈椎脱臼法处死实验动物,进行大体解剖观察,肉眼观察瘤体的大小、形态、有无胸腹水及各脏器表面有无转移性结节,称取瘤体质量;分离肿瘤组织,置于40 g/L甲醛中固定,然后进行石蜡包埋切片,HE染色,光镜下观察瘤组织形态。
1.3 统计学方法 本研究数据均用SPSS 22.0统计软件处理,计量资料数据用“”表示,组间比较采用单因素方差分析,多组间均数的两两比较采用q检验,P<0.05为差异具有统计学意义。
2 结果
2.1 免疫组织化学染色表达状况
2.1.1 LHX6基因、E-cadherin、Vimentin、Snail在肝癌组织及癌旁组织的表达 LHX6基因在肝癌组织中表达荧光强度值为(0.177±0.086),表达强度低,而在癌旁组织中表达量为(0.475±0.212),强度明显增高,差异具有统计学意义(P<0.05)。E-cadherin在肝癌组织表达荧光强度值为(0.093±0.022),较癌旁组织相对表达量(0.177±0.127)显著降低,差异具有统计学意义(P<0.05)。Vimentin在肝癌
组织表达荧光强度值为(0.702±0.452),较癌旁组织相对表达量(0.436±0.115)显著增高,差异具有统计学意义(P<0.05)。Snail在肝癌组织表达荧光强度值为(0.633±0.215),较癌旁组织相对表达量(0.376±0.201)显著增高,差异具有统计学意义(P<0.05)。LHX6基因的表达与E-cadherin的表达呈正相关,与Vimentin、Snail的表达呈负相关。
2.1.2 免疫组化检测LHX6基因、E-Cadherin、Vimentin、Snail在肝癌组织及癌旁组织的表达 通过镜下观察可见LHX6在肝癌组织中表达较为低下,而相邻的癌旁组织中呈现较高表达,表达主要部位在细胞核,可见肿瘤细胞核中大量棕黑色颗粒;E-Cadherin在肝癌组织中几乎不表达,而相邻的癌旁组织中呈现高表达,表达主要部位在细胞膜,可见红棕色颗粒围绕细胞;Vimentin在肝癌组织中呈现高表达,而在相邻的癌旁组织中基本不表达,表达主要部位在细胞质内,可见棕黄色颗粒;Snail同样在肝癌组织中呈现高表达,而在癌旁组织中基本不表达,表达主要部位在细胞核中,可见核内富有棕黄色染色颗粒。
2.1.3 LHX6基因、E-Cadherin、Vimentin、Snail与临床病理特征和预后间关系 利用方差分析检验可知,肝癌组织中LHX6基因的表达与包膜侵袭、远处转移、肿瘤直径有关(P<0.05);E-Cadherin的表达与门脉侵袭、包膜侵袭、远处转移、病理分级有关(P<0.05);Vimentin的表达与门脉侵袭、包膜侵袭、远处转移、肿瘤直径有关(P<0.05);Snail的表达与门脉侵袭、包膜侵袭、转移有关(P<0.05)。在预后方面,LHX6基因、E-Cadherin的高表达与Vimentin、Snail的低表达是促进肝癌预后的保护因素,反之LHX6基因、E-Cadherin的低表达与Vimentin、Snail的高表达则是肝癌预后的危险因素。
2.2 体外细胞培养
2.2.1 转染LHX6在HepG2肝癌细胞系中的表达情况 运用RT-PCR方法测定转染LHX6在HepG2肝癌细胞系中的表达情况,发现质粒转染组与空白对照组、siRNA转染组中的LHX6的表达水平比较结果差异显著(P<0.05),这表明,质粒转染可以上调LHX6表达,而siRNA转染可以下调LHX6表达,见图1。2.2.2 转染LHX6对HepG2肝癌细胞系增殖的影响 运用MTT方法测定转染LHX6对HepG2肝癌细胞系增殖的影响,发现质粒转染组与空白对照组、siRNA转染组中的肝癌细胞增殖情况比较结果差异显著(P<0.05),这表明,高表达LHX6可以抑制肝癌细胞增殖,而低表达LHX6可以促进肝癌细胞增殖,见图2。
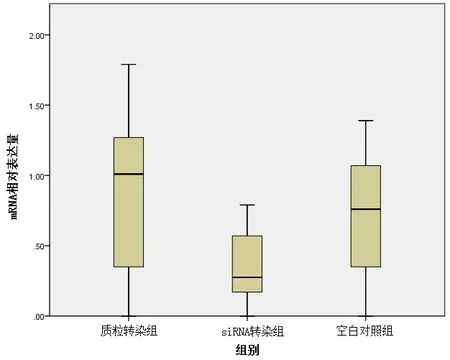
图1 转染LHX6在HepG2肝癌细胞系中的相对表达量Figure1 The Relative Expression Level of Transfected LHX6 in HepG2 Liver Cancer Cell Lines

图2 转染LHX6对HepG2肝癌细胞系增殖的影响Figure 2 Effect of transfection of LHX6 on the proliferation of HepG2 hepatocellular carcinoma cell line
2.2.3 转染LHX6对HepG2肝癌细胞系迁移侵袭能力的影响 运用细胞划痕实验测定转染LHX6对HepG2肝癌细胞系迁移侵袭能力的影响,发现质粒转染组与空白对照组、siRNA转染组中的肝癌细胞迁移侵袭能力比较结果差异显著(P<0.05),这表明,高表达LHX6可以抑制肝癌细胞的转移,而低表达LHX6可以促进肝癌细胞的转移,见图3。
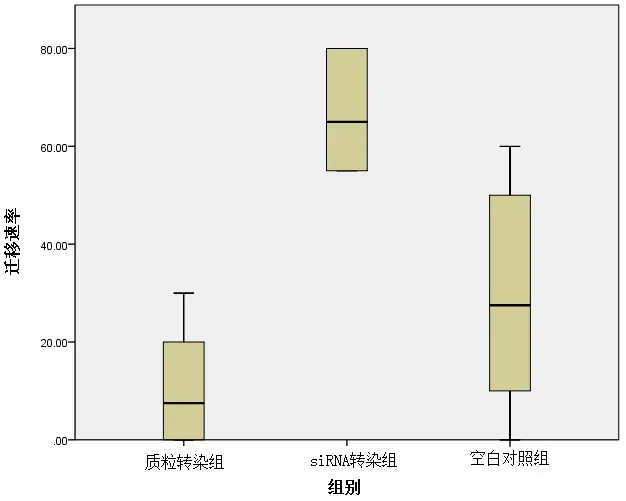
图3 转染LHX6对HepG2肝癌细胞系迁移侵袭能力的影响Figure 3 Effect of transfected LHX6 on migration and invasive ability of HepG2 hepatoma cell line
2.3 小鼠肝癌移植模型及肿瘤进展观察
2.3.1 原位肝癌模型(肝门静脉注射组)
(1)移植肿瘤模型成模情况:15只LHX6基因低表达组小鼠全部移植成功,成瘤率100%;15只LHX6基因高表达组小鼠中有11只移植成功,成瘤率73.3%;10只对照组小鼠中无移植成功者,成瘤率0%。实验按照计划完成,无小鼠死亡。LHX6基因低表达组小鼠实验结束时肿瘤最大长度已达18.4 mm;LHX6基因高表达组小鼠肿瘤生长速度较为缓慢,实验结束时肿瘤最大长度为11.2 mm。
(2)肿瘤生长情况:实验结束时称取两组小鼠肿瘤质量,经过分析发现LHX6基因低表达与LHX6基因高表达所形成的肿瘤质量有统计学意义(P<0.05),LHX6基因低表达组的肿瘤质量明显高于LHX6基因高表达组,见表2。
表2 各组皮下肝癌模型肿瘤质量()Table 2 The tumor quality of subcutaneous hepatocellular carcinoma models in each group()

表2 各组皮下肝癌模型肿瘤质量()Table 2 The tumor quality of subcutaneous hepatocellular carcinoma models in each group()
肿瘤质量(g)1.606±0.132 0.832±0.064 0组别名称LHX6基因低表达组LHX6基因高表达组空白对照组
(3)远处转移和腹腔播散情况:实验晚期,LHX6基因低表达组15只小鼠中,出现肝内、皮下、腹腔等广泛腹腔淋巴结转移例的10例,转移率为66.7%;出现血性腹水者有4例,占26.7%。LHX6基因低表达组15只小鼠中,出现肝内、皮下、腹腔等广泛腹腔淋巴结转移的有3例,转移率为20%;出现血性腹水者有1例,占6.7%。
(4)解剖学及组织病理学情况:在本实验中,瘤体形态较为规则,圆形或椭圆形,周围有完整或不完整的包膜,整体呈现大小不等的结节状改变,外周有明显增粗的血管,较大的瘤体中心则出现干酪样坏死;晚期则可见肝内、皮下及腹腔的广泛转移。HE染色后可见肿瘤组织呈弥散样,间质内有丰富的肿瘤血管,肿瘤边缘已开始浸润肝组织;肿瘤细胞核大,圆形,双核仁结构明显,游离核糖体显著增多,部分内质网扩张,与人肝癌细胞类似。与LHX6基因高表达组相比,LHX6基因低表达组的瘤体及镜下形态都更为完整典型,远处转移和浸润情况都更为严重,说明在本实验研究条件下,LHX6基因的低表达是抑制肝癌侵袭、转移的一个因素。
2.3.2 皮下肝癌模型(腋部皮下注射组)
(1)移植肿瘤模型成模情况:15只LHX6基因低表达组小鼠全部移植成功,成瘤率100%;15只LHX6基因高表达组小鼠中有7只移植成功,成瘤率46.7%;15只对照组小鼠中无移植成功者,成瘤率0%。实验按照计划完成,无小鼠死亡。LHX6基因低表达组小鼠肿瘤生长较快,实验结束时肿瘤最大长度已达12.4 mm;而LHX6基因高表达组小鼠肿瘤生长速度较为缓慢,实验结束时肿瘤最大长度为7.9 mm。
(2)肿瘤生长情况:根据实验数据计算肿瘤体积TV(mm3),并绘制肿瘤生长曲线(图4),可以发现:LHX6基因低表达组肿瘤体积增长速度较快,LHX6基因高表达组肿瘤体积增长速度较慢,并且随着实验进程的发展,肿瘤增长速度也在增加。经方差分析,两组之间的差异有统计学意义(F=10.87,P<0.01)。实验结束时称取两组小鼠肿瘤质量,经过分析发现LHX6基因低表达与LHX6基因高表达所形成的肿瘤质量有统计学意义(P<0.05),LHX6基因低表达组的肿瘤质量明显高于LHX6基因高表达组,见表3。
(3)皮下浸润和远处转移情况:实验晚期,LHX6基因低表达组15只小鼠中,出现皮下浸润和淋巴结转移例的有10例,转移率为66.7%;LHX6基因高表达组15只小鼠中,出现皮下浸润和淋巴结转移的有4例,转移率为26.7%。皮下肝癌的转移主要沿淋巴系统转移。
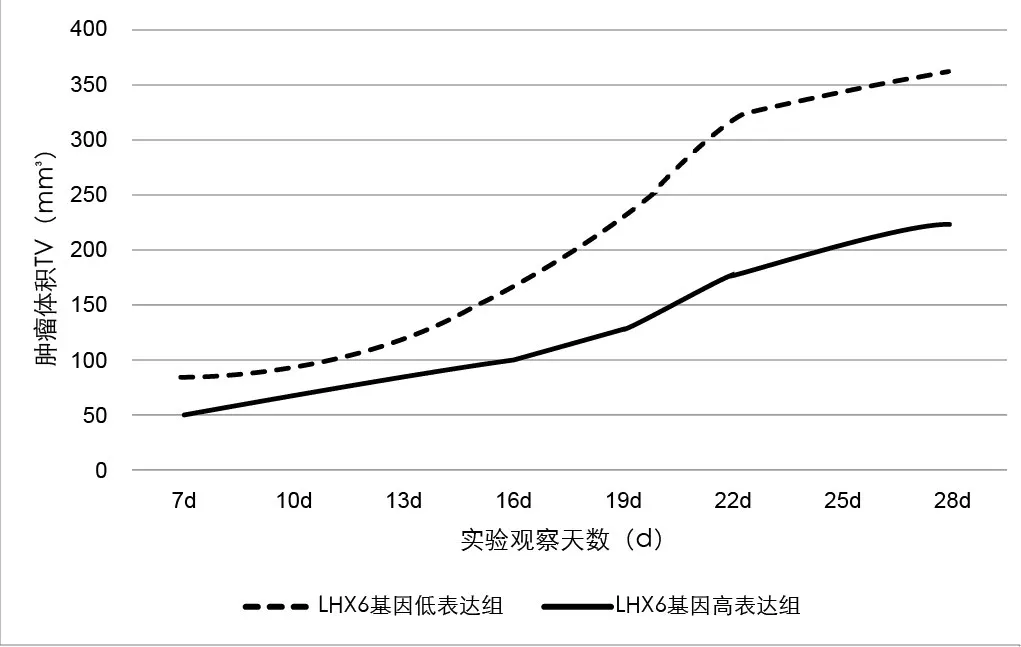
图4 皮下肝癌模型肿瘤生长曲线Figure 4 Subcutaneous hepatocellular carcinoma model tumor growth curve
表3 各组皮下肝癌模型肿瘤质量()Table 3 The tumor quality of subcutaneous hepatocellular carcinoma models in each group()

表3 各组皮下肝癌模型肿瘤质量()Table 3 The tumor quality of subcutaneous hepatocellular carcinoma models in each group()
肿瘤质量(g)0.514±0.055 0.397±0.081 0组别名称LHX6基因低表达组LHX6基因高表达组空白对照组
(4)解剖学及组织病理学情况 在本实验中,瘤体呈圆形或类圆形,周围有完整或不完整的包膜,整体呈大小不等的颗粒状或结节状改变,部分瘤体可见干酪样坏死;晚期则出现皮下浸润和远处淋巴转移。HE染色后可见肿瘤细胞形态多样,大部分形状不规则,有1个或多个核仁,核仁结构明显,病理性核分裂像多见,部分细胞伴有炎症细胞浸润,与人肝癌细胞类似。与LHX6基因高表达组相比,LHX6基因低表达组的瘤体及镜下形态都更为完整典型,皮下浸润和远处转移都更为严重,说明在本实验研究条件下,LHX6基因的低表达是抑制肝癌侵袭、转移的一个因素。
3 讨论
LHX6基因位于人染色体9q33.2位置,全称是Homo sapiens LIM homeobox 6。其产物属于LIM蛋白家族,可结合DNA和蛋白质,作为转录因子存在,在胚胎发育过程中有重要作用,同时还与牙齿发育、神经细胞迁徙定位有关[10-11]。近些年来新研究表明LHX6基因很可能是头颈癌的相关基因[12],并且在宫颈癌、肺癌、结肠癌等肿瘤的诊断中可能有重要价值。尽管如此,LHX6基因在肝癌中的具体分子机制以及在临床预后中的意义目前还不清楚。
前期实验中,我们通过对54例肝癌组织标本检验发现,LHX6在肝癌组织中呈显著低表达,并且其表达水平与肝癌临床病理因素相关,包括病理分级、肿瘤大小等。本次实验中,我们收集80例肝癌组织标本,通过免疫组织化学染色观察肝癌侵袭指标的表达状况,同时进行了体外和体内的肝癌细胞培养,从多方面探索LHX6基因在肝癌转移中的表达、作用以及可能的临床意义。
肝癌动物模型是进行肝癌实验研究的重要手段,目前已经建立的模型有动物自发性肝癌模型、诱发性肝癌模型、移植性动物肝癌模型、人类肝癌的异种移植模型以及转基因动物肝癌模型,本次实验采用的是移植性肝癌模型。移植性肝癌模型是指能够在同系、同种或异种动物体内传代生长的肝癌,他的组织学类型、生长特性较稳定,侵袭、转移以及对化疗药物的敏感程度比较容易确定,是目前进行肿瘤发生发展和抗癌药物研究的有效方式[13]。本次实验室用的人肝癌细胞株HepG2,已经广泛用于相关药物与基因对肝癌细胞诱导凋亡以及生物学性状的研究,取得了一定的进展[14]。同时有关研究表明[15],在肝癌移植模型中,雄性动物比雌性动物更易引发肝癌,为了提高肿瘤的形成率,实验中我们全部使用了雄性小鼠。
通过实验我们发现,LHX6基因、E-Cadherin的高表达与Vimentin、Snail的低表达是促进肝癌预后的保护因素。高表达LHX6可以抑制肝癌细胞的增殖和转移,而低表达LHX6可以促进肝癌细胞的增殖和转移,两者呈负相关关系。这说明,LHX6与上皮细胞向间质细胞的转变各指标具有相关性,通过促进LHX6基因、E-Cadherin的表达和抑制Vimentin、Snail的表达有助于提高肝癌的总体治疗效果。在未来的肝癌治疗中,LHX6基因有可能成为肝癌靶向治疗的有效药物靶点,通过药物治疗上调LHX6的表达,抑制肝癌细胞的增殖和转移,为肝癌治疗提供一种新途径,同时可根据肿瘤细胞中LHX6基因表达的高低判断预后情况,调整治疗方案,提高肝癌患者的生存周期及生活质量。由于LHX6基因在肝癌发生发展上的作用仍不十分明确,其机制有待进一步探究。

