混合盐碱胁迫下接种丛枝菌根真菌和根瘤菌对紫花苜蓿生长的影响
刘 倩,高娅妮,柳 旭,周文楠,王佺珍
西北农林科技大学动物科技学院草业科学系,杨凌 712100
世界上约有10亿hm2的土壤受到盐渍的影响,严重抑制着作物的生长,尤其在干旱和半干旱地区仍呈不断恶化的趋势[1-2]。土壤盐化与碱化常常同时发生,而很多研究将盐碱胁迫笼统地称为盐胁迫,忽略了碱胁迫的存在[3]。实际上,碱性盐除了盐度外还伴随着高pH,由NaHCO3和Na2CO3引发的碱性盐要比由NaCl和Na2SO4引发的中性盐对植物的伤害更大,是两种不同的非生物胁迫[4-5]。近年来,随着气候变化和人类生产活动的影响,土壤盐碱化日趋扩大,严重威胁着农牧业生产和生态环境的建设。紫花苜蓿(MedicagosativaL.)是多年生豆科牧草,具有一定的固氮和抗胁迫能力,是国际公认的最优质蛋白质牧草,在世界上广泛种植[6]。而在盐碱地上其生长受阻,产量下降,限制了苜蓿的推广与应用。丛枝根菌真菌(arbuscular mycorrhizal fungi, AMF)与植物根系可以形成互惠共生体,改善植物的矿质营养及土壤的物理结构[7]。根瘤菌可以与豆科植物共生固氮,提高苜蓿的产量和品质。而盐胁迫会降低结瘤率和固氮酶活性,对植物固氮产生影响[8]。双接种AMF和根瘤菌不仅可以促进其营养物质的吸收,增强植物的抗逆性,还可以使苜蓿结瘤固氮,促进其生长[9]。同时,这种双接种方法在生化和生理上提高抗氧化酶活性及渗透调节能力来提高植物的抗盐性[8]。与单独接种根瘤菌相比,盐胁迫下同时接种两种根际促生菌更能提高甘草产量及其茎和根中的氮含量[10]。
正交试验设计是利用正交表安排部分多因素实验来代替全面实验。不仅可以确定影响因素的主次效应顺序,还可以研究因素间的交互效应,找出优化条件或实验最优组合[11]。目前有很多关于盐胁迫下植物接种AMF或/和根瘤菌的研究及混合盐碱胁迫下植物单独接种AMF或根瘤菌的研究,而混合盐碱胁迫下紫花苜蓿同时接种AMF和根瘤菌的研究却鲜有报道。因此,本研究采用正交设计的方法,避免了常规实验设计规模大、限制因素多、操作繁琐、效率低等缺点[11]。探讨了苜蓿可以耐受的盐碱浓度以及AMF和根瘤菌混合接种对盐碱胁迫下紫花苜蓿生长及生理的影响。该结果以期将为缓解盐碱地对苜蓿生长的伤害,为提高苜蓿抗盐碱性及农业生产实践提供决策参考和理论依据。
1 材料与方法
1.1 实验材料
1.1.1 寄主植物
紫花苜蓿(金皇后,MedicagosativaL. ‘Jinhuanghou’)种子由酒泉大业种业有限公司提供。苜蓿种子经10% H2O2浸泡10 min灭菌,再用70%的乙醇灭菌3分钟,用无菌蒸馏水冲洗干净后置于铺有滤纸的培养皿(680 mm×315 mm×170 mm)中。在人工气候培养箱(光25℃/暗25℃ 各12 h,70%湿度)中萌发,每天用无菌蒸馏水补充水分,待幼苗长出两片子叶时,将其移到花盆中。
1.1.2 供试菌种
丛枝菌根真菌摩西管柄囊霉(Funneliformismosseae)购自北京市农林科学院植物营养与资源研究所,接种物为内含摩西球囊霉孢子、侵染根段及根外菌丝的沙土混合物;根瘤菌(Sinorhizobiummeliloti)由西北农林科技大学草业科学实验室提供,接种物为由液体菌种摇菌后得到的液体菌剂。
1.2 实验设计
根据中国东北地区盐碱土的特点,实验将两种中性盐(NaCl、Na2SO4)和两种碱性盐(Na2CO3、NaHCO3)按照一定的比例和浓度模拟出4种盐浓度(25,75,100,150 mmol/L,盐胁迫)、16种pH(7.67—10.52,碱胁迫)梯度[4](表1)。

表1 各处理液的盐分组成、盐浓度、摩尔比及pH值
SAS: 盐碱胁迫 Saline-alkaline stress
实验采用混合正交设计表L16(161×22)。盐碱胁迫(因素X2)包括4个水平(25、75、100、150 mmol/L);pH(因素X1)包括16个水平;根瘤菌(因素X3)包括两个水平(接种和不接种);摩西管柄囊霉(因素X4)包括两个水平(接种和不接种)。共有32个处理,每个处理重复3次。以没有盐碱和菌剂处理为对照组,设4个对照也是3次重复,共计108个花盆。
1.3 盆栽实验
每个花盆装3 kg用15%工业NaClO消毒过的石英砂(粗砂20—40目∶细沙40—70目=1∶3,m:m)。挑选长出三片子叶且生长整齐一致的紫花苜蓿幼苗移栽于混有摩西管柄囊霉接种物的石英砂中(层播,5 g/盆)。根瘤菌菌剂采用根灌法接种,用注射器把配制好的菌悬液注射在幼苗根部(10 mL/株)。在西北农林科技大学草业科学系全自动日光温室进行花盆实验,隔一天浇一次营养液,65 d后进行盐碱胁迫处理,隔1 d浇1次盐碱混合液,胁迫处理14 d后分别收获苜蓿地上地下部分。收获当天,每个花盆中选取3株苜蓿用镊子取下其根瘤,统计根瘤数及根瘤重,检测AM真菌侵染状况。然后将样品放入-80℃超低温冰箱中保存以进行后续指标测定。
1.4 测定项目及方法
株高用刻度尺准确度量,精确至mm;地上干重用电子天平称量(0.01 g);POD活性测定参考Zhang等[12]的方法,用愈创木酚法显色法测定;SOD活性的测定参考Beyer和Fridovich[13]的方法;丙二醛(MDA)和脯氨酸(proline)参照Madhava和Sresty[14]的方法,分别采用硫代巴比妥酸法测定和茚三酮法测定;可溶性蛋白含量测定参照Bradford[15]的方法;采用计数法统计根瘤菌数;用电子天平称量根瘤菌干重,采用根段法镜检[16]AM菌根侵染状况。
1.5 数据处理
采用Excel 2010软件进行数据统计及正交分析,采用SPSS 21.0 软件进行各处理组间差异显著性分析,测定结果用平均值±标准误表示。将根瘤菌、AMF及pH作为自变量Xi,各项指标作为因变量Yi,固定离散变量根瘤菌,采用SAS(V20.0)建立因变量Yi与自变量Xi的二元三次回归模型[17-18],其关系方程如下:
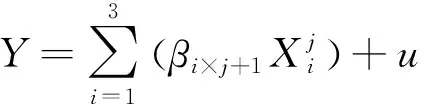
式中,β是常量。
2 结果分析
2.1 AMF和根瘤菌对盐碱胁迫下紫花苜蓿株高及茎高净增长量的影响
除盐碱类型外,pH、根瘤菌、AMF以及4个因素间两两交互作用都对紫花苜蓿株高有显著影响(表2)。与对照相比,正交处理组第3、6、23、28、29组中紫花苜蓿株高都有一定程度的降低,而这几组都未接种根瘤菌或摩西管柄囊霉,其他处理组中紫花苜蓿株高都大于对照。第7组(B盐100 mmol/L,pH 8.56,同时接种根瘤菌和摩西管柄囊霉)处理组株高最高,第23组(B盐100 mmol/L,pH 8.56,不接种根瘤菌或摩西管柄囊霉)处理组株高最低(表3)。第7组和第19组差异不显著,与其他处理组差异显著,第23组和第1、7、13、19组差异显著,与其他处理组差异都不显著。处理中四类盐对应的株高顺序依次是D>C>B>A(表3)。在整个植物生长过程中,没有植株死亡,但随着胁迫时间的延长,D盐胁迫下的处理组出现叶片萎焉失绿,甚至凋落现象,其他处理组长势较好。而茎高净增长量分别在第1组(A盐25 mmol/L,pH 7.67,接种摩西管柄囊霉)和第6组(B盐75 mmol/L,pH 8.21,不接种根瘤菌或摩西管柄囊霉)出现最大值和最小值,但这两组差异不显著。由极差R值及正交实验结果得出(表3),不同因素对紫花苜蓿株高的影响程度依次是AMF+根瘤菌>pH>AMF>盐碱类型>根瘤菌,对茎高的净增长量影响程度依次是pH>盐碱类型>AMF+根瘤菌>AMF>根瘤菌(表4、表5)。该结果表明,pH对紫花苜蓿的抑制生长作用大于盐胁迫,同时接种摩西管柄囊霉和根瘤菌对紫花苜蓿的促进生长作用大于单独接种摩西管柄囊霉或根瘤菌,而单独接种摩西管柄囊霉的作用又大于单独接种根瘤菌的作用。
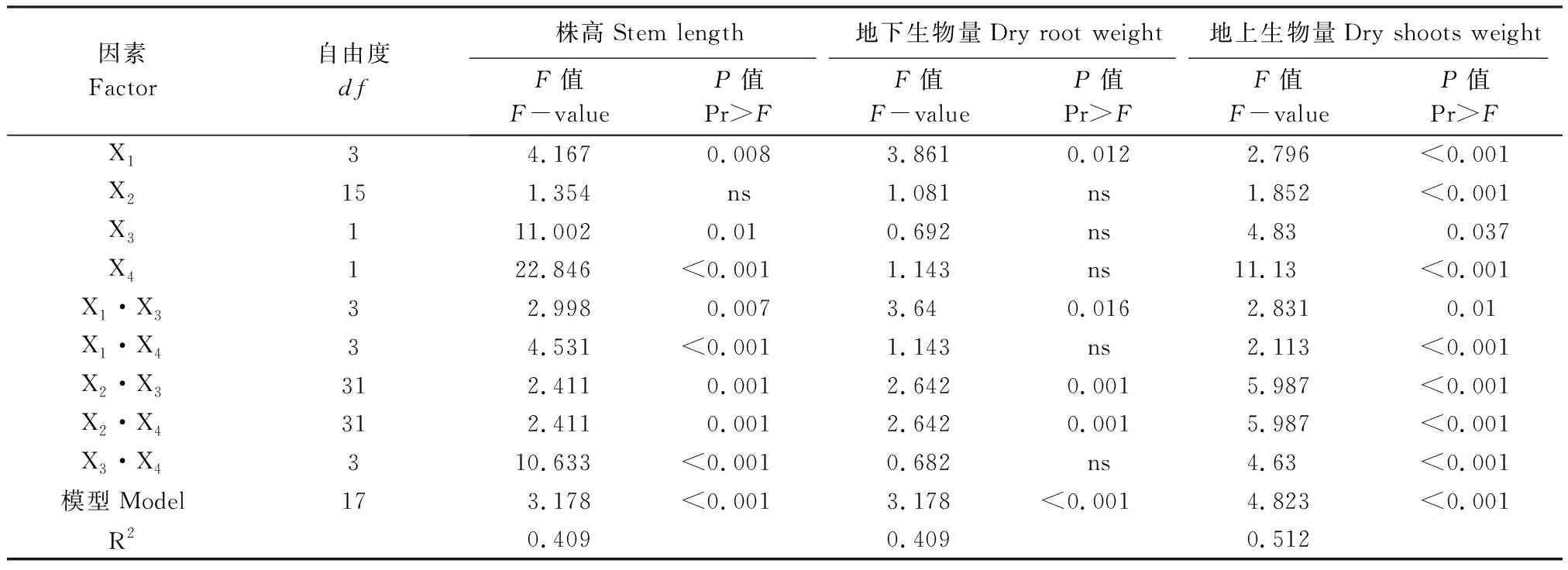
表2 盐碱类型、pH、根瘤菌及AMF对紫花苜蓿株高、地下生物量及地上生物量影响的方差分析
X1: pH;X2: 盐碱类型,Saline-alkaline stress;X3:根瘤菌,rhizobia;X4:AMF;ns: 无显著影响 No significant difference
表3 株高的正交试验结果
Table 3 Shoot length of alfalfa in orthogonal matrix experiment
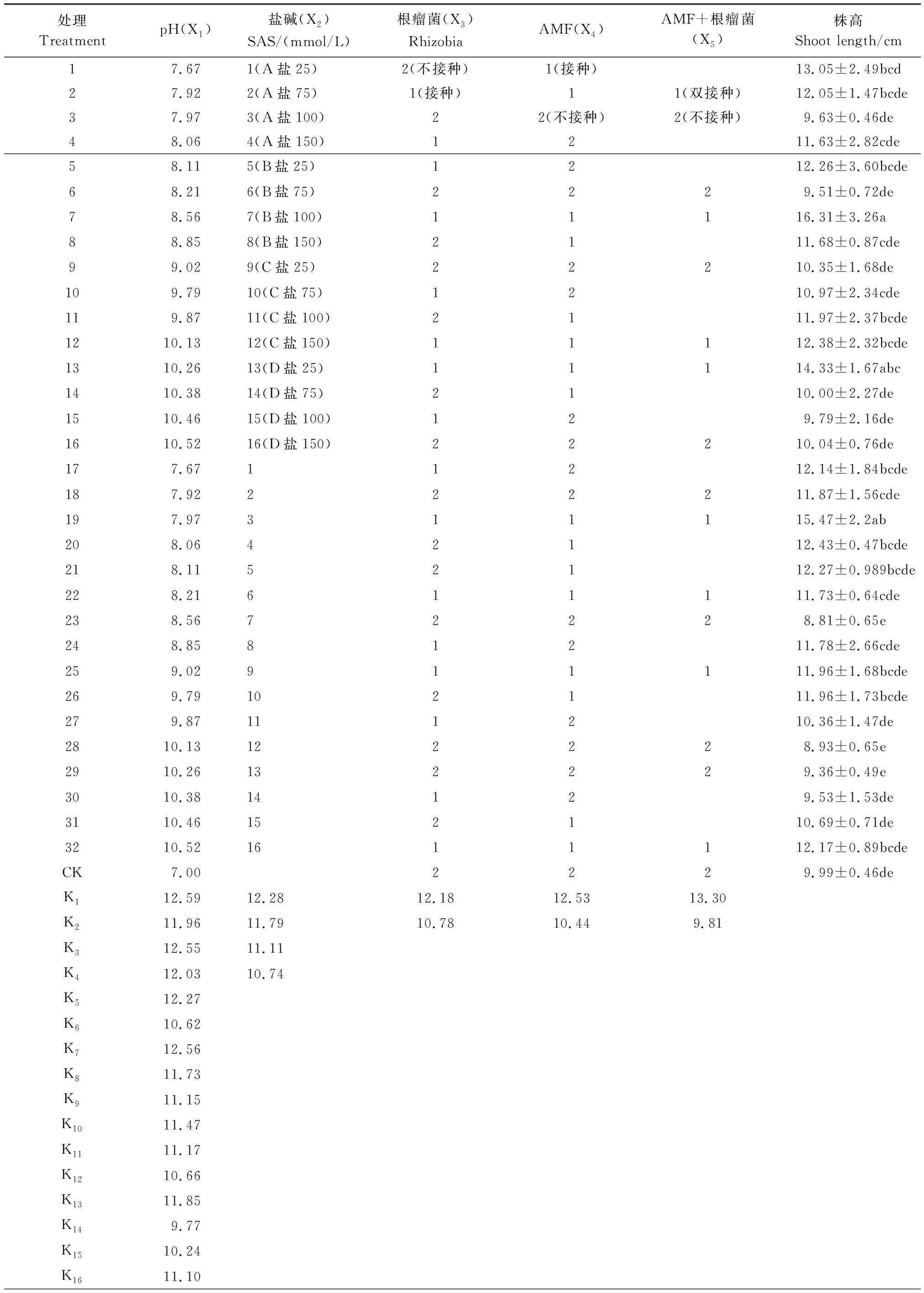
处理TreatmentpH(X1)盐碱(X2)SAS/(mmol/L)根瘤菌(X3)RhizobiaAMF(X4)AMF+根瘤菌(X5)株高Shoot length/cm17.671(A盐25)2(不接种)1(接种)13.05±2.49bcd27.922(A盐75)1(接种)11(双接种)12.05±1.47bcde37.973(A盐100)22(不接种)2(不接种)9.63±0.46de48.064(A盐150)1211.63±2.82cde58.115(B盐25)1212.26±3.60bcde68.216(B盐75)2229.51±0.72de78.567(B盐100)11116.31±3.26a88.858(B盐150)2111.68±0.87cde99.029(C盐25)22210.35±1.68de109.7910(C盐75)1210.97±2.34cde119.8711(C盐100)2111.97±2.37bcde1210.1312(C盐150)11112.38±2.32bcde1310.2613(D盐25)11114.33±1.67abc1410.3814(D盐75)2110.00±2.27de1510.4615(D盐100)129.79±2.16de1610.5216(D盐150)22210.04±0.76de177.6711212.14±1.84bcde187.92222211.87±1.56cde197.97311115.47±2.2ab208.0642112.43±0.47bcde218.1152112.27±0.989bcde228.21611111.73±0.64cde238.5672228.81±0.65e248.8581211.78±2.66cde259.02911111.96±1.68bcde269.79102111.96±1.73bcde279.87111210.36±1.47de2810.13122228.93±0.65e2910.26132229.36±0.49e3010.3814129.53±1.53de3110.46152110.69±0.71de3210.521611112.17±0.89bcdeCK7.002229.99±0.46deK112.5912.2812.1812.5313.30K211.9611.7910.7810.449.81K312.5511.11K412.0310.74K512.27K610.62K712.56K811.73K911.15K1011.47K1111.17K1210.66K1311.85K149.77K1510.24K1611.10

续表处理TreatmentpH(X1)盐碱(X2)SAS/(mmol/L)根瘤菌(X3)RhizobiaAMF(X4)AMF+根瘤菌(X5)株高Shoot length/cmR2.821.541.42.093.49顺序Order24531
CK: 对照处理 Control;R:正交极差值;K:4种因素各水平的均值;不同小写字母表示不同处理间在95%置信水平下差异显著
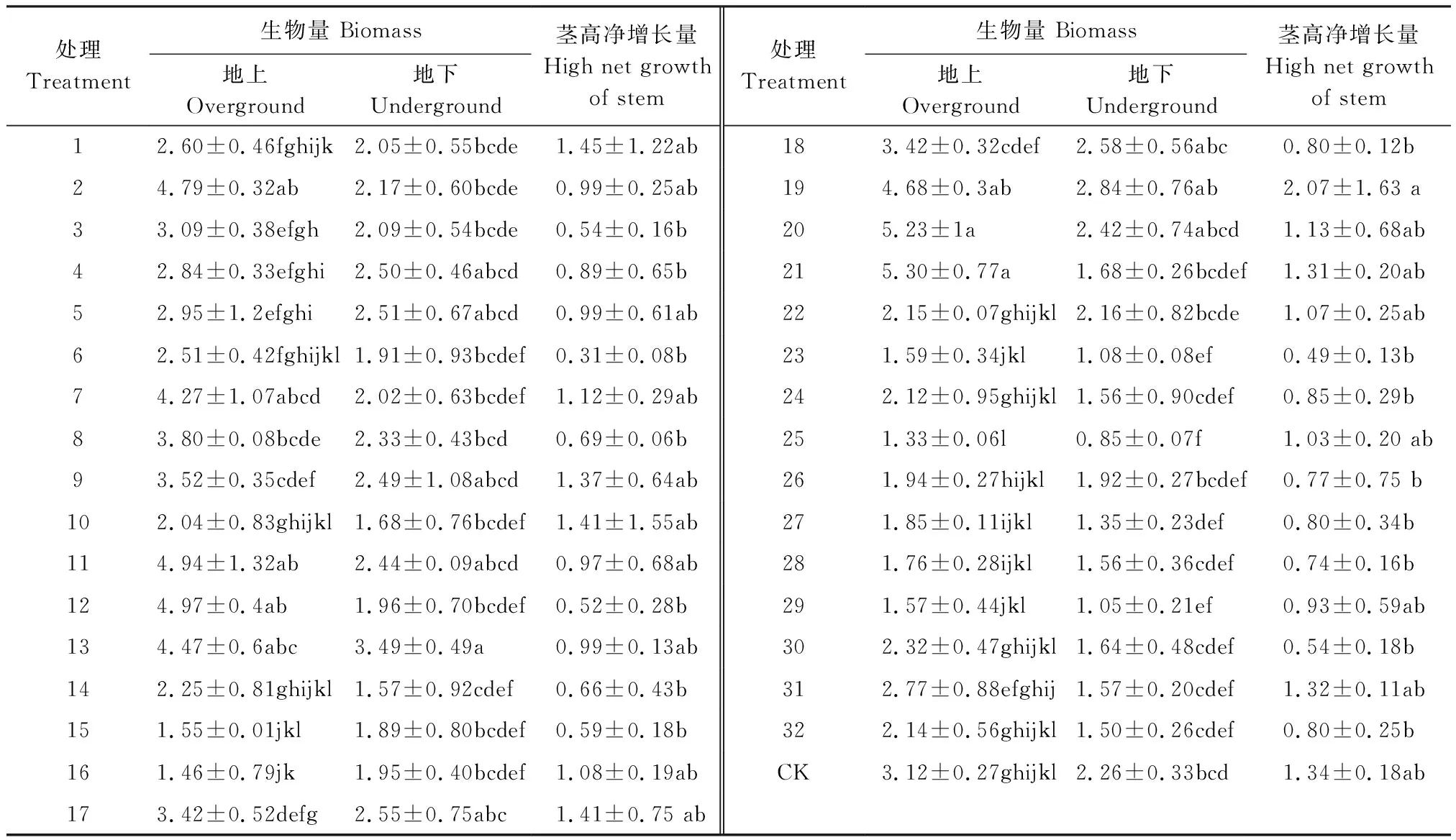
表4 盐碱胁迫及根瘤菌、摩西球囊霉处理下紫花苜蓿生物量和茎高净增长量的正交实验结果
CK: 对照处理 Control; 不同小写字母表示不同处理间在95%置信水平下差异显著,图中值为平均值±标准差
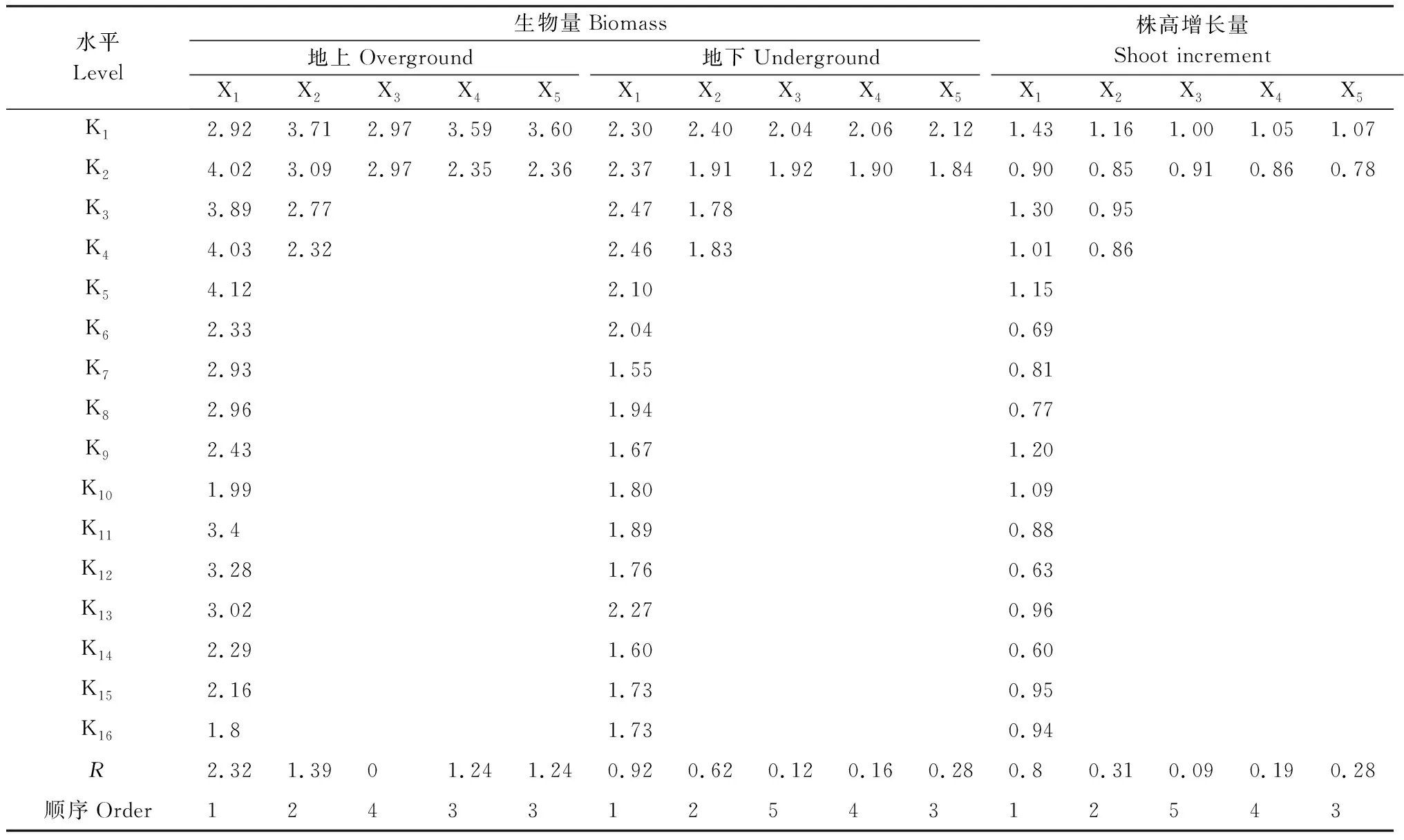
表5 各因素每个水平的平均值和极差
2.2 AMF和根瘤菌对盐碱胁迫下紫花苜蓿生物量的影响
4种因素及其两两间的交互作用都对紫花苜蓿的地上生物量有显著影响。pH、pH与根瘤菌的交互作用、盐碱类型与根瘤菌的交互作用及盐碱类型与AMF的交互作用对植株地下生物量影响显著(表2)。正交处理组中紫花苜蓿地上及地下生物量的最小值都出现在第25组(C盐25 mmol/L,pH 9.02,同时接种根瘤菌和摩西管柄囊霉)即地上部与地下部生物量在相同条件下达到最小值。而地上、地下生物量分别在在第21组(B盐25 mmol/L,pH 8.1,单接摩西管柄囊霉)、第13组(D盐25 mmol/L,pH 10.26,同时接种根瘤菌和摩西管柄囊霉)出现最大值。地上生物量中第21组与第2、7、11、12、13、19、20组差异不显著,与其他处理组都差异显著。地上生物量中第13组与第4、5、9、11、17—10组差异不显著,与其他处理组都差异显著(表4)。从正交处理结果和极差R来看(表4、表5),不同因素对紫花苜蓿地上、地下生物量的影响程度相似,顺序依次是pH>盐碱类型>AMF+根瘤菌≥AMF>根瘤菌,盐碱类型对其的影响程度依次是D>C>B>A。该结果表明盐碱引发的pH对紫花苜蓿生物量的影响要大于盐碱类型,且大于AMF和根瘤菌的作用。
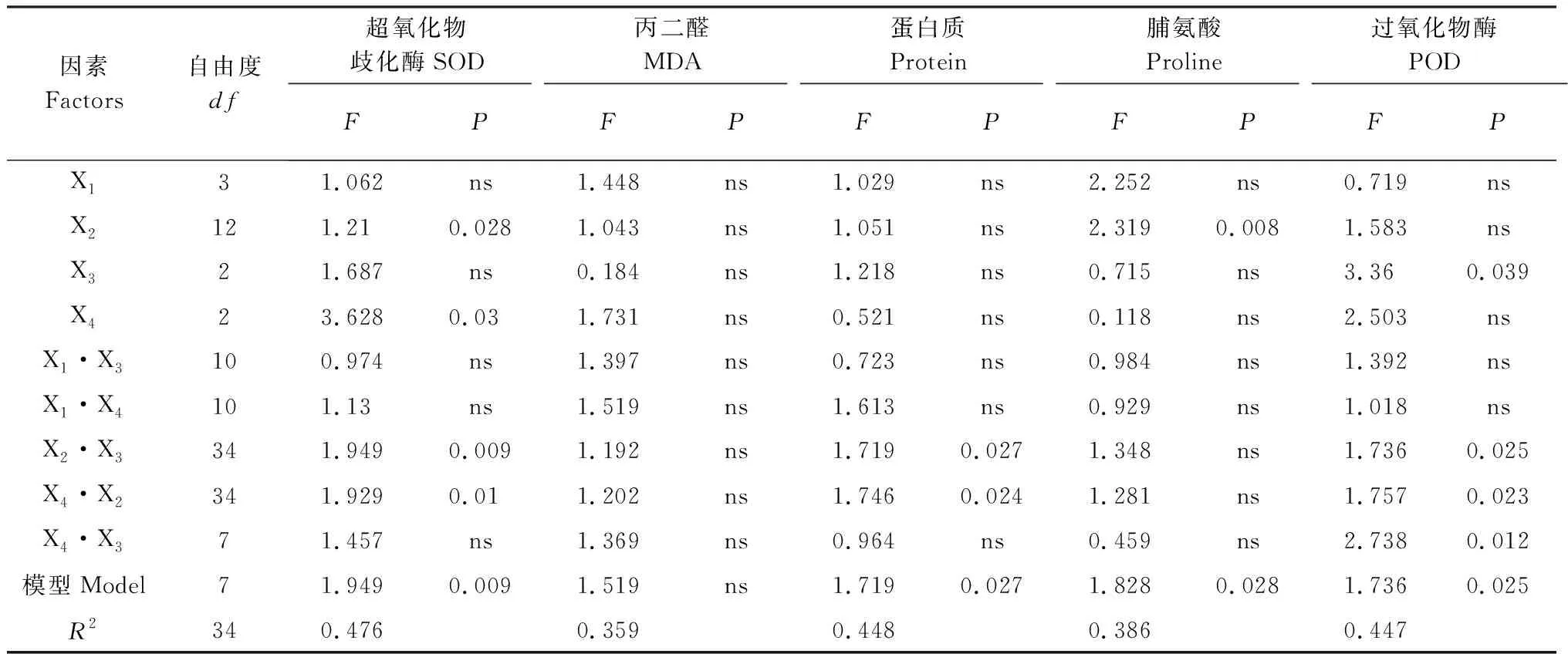
表6 盐碱类型、pH、根瘤菌及AMF对紫花苜蓿SOD、MDA、蛋白质、脯氨酸及POD影响的方差分析
2.3 AMF和根瘤菌对盐碱胁迫下紫花苜蓿丙二醛(MDA)和脯氨酸含量的影响
盐碱类型对紫花苜蓿脯氨酸含量有显著影响,而其他因素及其交互作用对MDA和脯氨酸的影响都不显著(表6)。不同的处理对紫花苜蓿中MDA和脯氨酸积累量影响不同。MDA在第15组(D盐75 mmol/L,pH 10.46,单接摩西管柄囊霉)和第23组(B盐100 mmol/L,pH 8.56,不接菌)分别出现最小值和最大值。脯氨酸在第24组(B盐100 mmol/L,pH 8.85,单接根瘤菌)和29组(D盐25 mmol/L,pH 10.26,不接菌)分别出现最大值和最小值。MDA在第15组除和第4组、第23组差异显著外,与其他组差异都不显著(表7)。由正交处理结果和极差R值得出(表7、表8),不同因素对紫花苜蓿MDA和脯氨酸含量影响程度相同,依次是pH>盐碱类型>AMF+根瘤菌>AMF>根瘤菌。该结果表明,盐碱胁迫是引发植物MDA和脯氨酸积累的主要因素,其影响要大于AMF和根瘤菌的作用。
2.4 AMF和根瘤菌对盐碱胁迫下紫花苜蓿SOD和POD的影响
盐碱类型、AMF、盐碱类型与根瘤菌的交互作用及盐碱类型与AMF的交互作用都对SOD有显著影响。根瘤菌、盐碱类型与根瘤菌的交互作用、盐碱类型与AMF的交互作用及根瘤菌与AMF的交互作用对POD影响显著(表6)。pH与不同处理对紫花苜蓿中SOD、POD活性的影响不同。SOD在第19组(A盐100 mmol/L,pH 7.97,同时接种根瘤菌和摩西管柄囊霉)和29组(D盐25 mmol/L,pH 10.26,不接菌)分别出现最小值和最大值。POD在第7组(B盐100 mmol/L,pH 8.56,同时接种根瘤菌和摩西管柄囊霉)和第11组(C盐100 mmol/L,pH 9.87,单接摩西管柄囊霉)分别出现最大值和最小值。SOD在第29组和第11组、第15组、第19组、第23组差异显著(表7)。由正交处理结果和极差R值得出(表7、表8),不同因素对紫花苜蓿SOD的影响程度依次是pH>AMF+根瘤菌>盐碱类型>AMF>根瘤菌,对POD的影响程度依次是pH>AMF+根瘤菌>根瘤菌>AMF>盐碱类型。该结果表明盐碱胁迫引发的pH是影响植物酶活性的主要因素,AMF+根瘤菌处理明显提高SOD和POD活性。
2.5 AMF和根瘤菌对盐碱胁迫下紫花苜蓿可溶性蛋白的影响
总体来看,可溶性蛋白含量在所有处理组中变化不大。盐碱类型与两种菌间的交互作用对可溶性蛋白影响显著(表6)。在第11组(C盐100 mmol/L,pH 9.87,单接摩西管柄囊霉)和30组(D盐75 mmol/L,pH 10.38,单接根瘤菌)分别出现最大值和最小值。第11组与第26组(C盐75 mmol/L,pH 9.87,单接根瘤菌)、30组差异显著,与其他处理组差异都不显著,而30组除与26组差异不显著外,与其他处理组都差异显著(表7)。由极差R(表7、8)得出,不同因素对紫花苜蓿可溶性蛋白含量的影响程度依次是pH>盐碱类型>根瘤菌>AMF+根瘤菌=AMF。该结果表明盐碱胁迫及其引发的高pH值对紫花苜蓿可溶性蛋白含量的影响强于根瘤菌和摩西管柄囊霉。
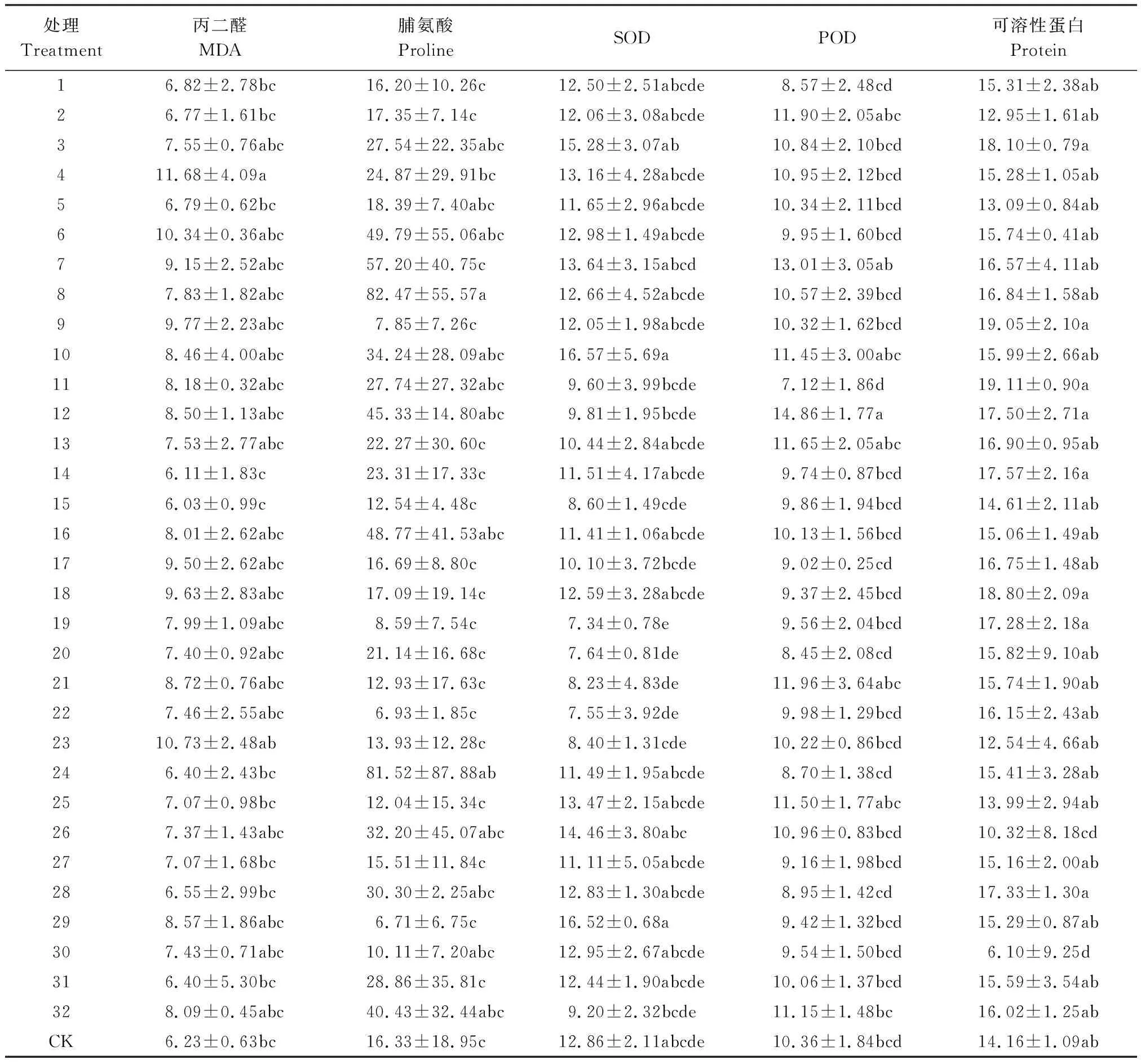
表7 盐碱胁迫及根瘤菌、摩西球囊霉处理下紫花苜蓿丙二醛、脯氨酸、SOD、POD及可溶性蛋白含量的正交实验结果
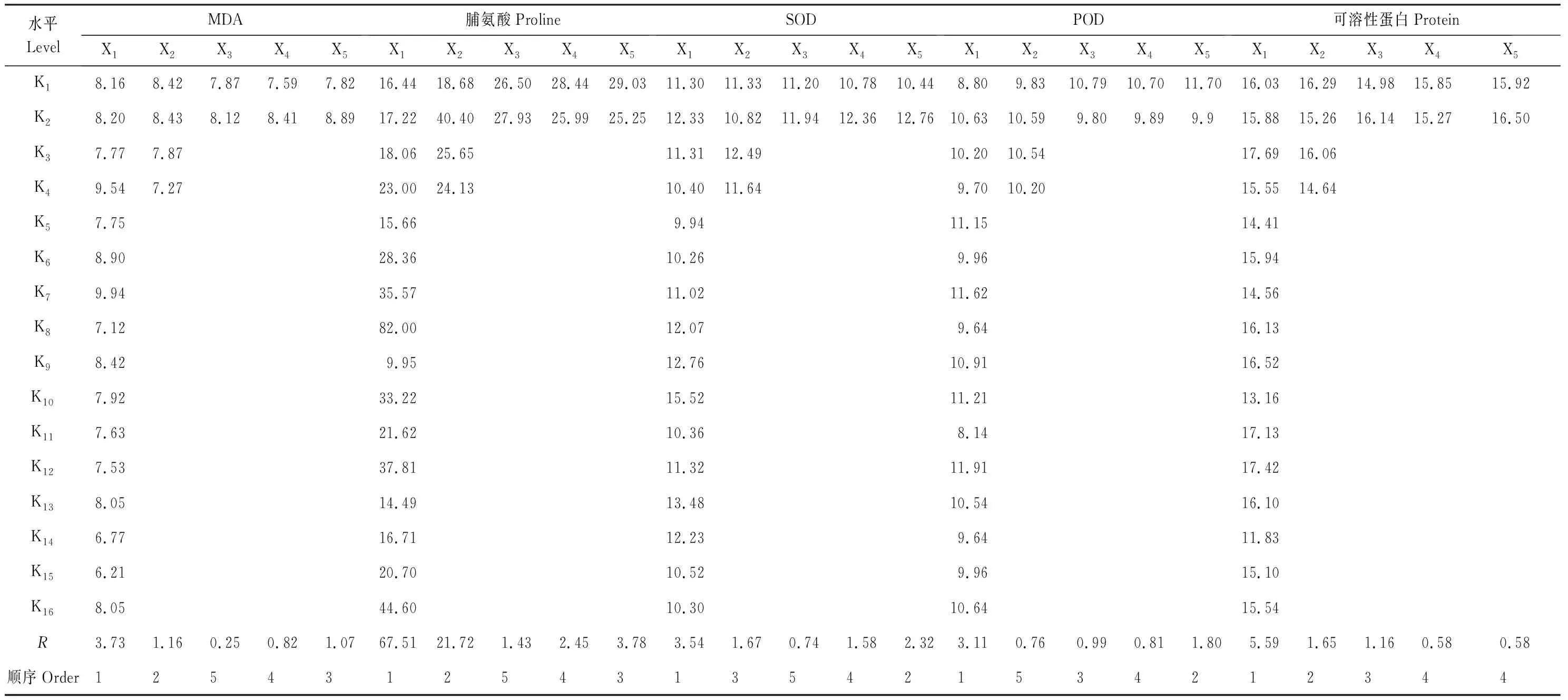
表8 各因素每个水平的平均值和极差
2.6 AMF及根瘤菌对紫花苜蓿根部的侵染状况
在AMF接种处理的石英砂中菌根均有侵染紫花苜蓿根部,而未做AMF接种处理的石英砂中没有检测到AMF侵染苜蓿根部。接种了根瘤菌的紫花苜蓿,根部均结有灰褐色根瘤。在有单独接种根瘤菌的处理中根瘤数是960个,重0.433 g, 双接种处理中根瘤数是1162个,重0.452 g。双接种处理中的根瘤数和根瘤重都略高于单独接种根瘤菌的处理,但差异不显著。
2.7 模型分析
通过正交结果分析发现,5种不同因素对紫花苜蓿地上生物量、地下生物量、茎高净增长量、脯氨酸含量及MDA含量的影响程度相同,都为pH>盐碱类型>AMF+根瘤菌>AMF>根瘤菌。根瘤菌的影响最小,因此,将根瘤菌固定,拟合出这3个指标关于pH和AMF的二元三次回归曲线。方差分析表明,模拟项的P<0.05,方差显著,说明在实验范围内模型与实际情况吻合。随盐碱胁迫程度加剧或pH的增大,地上生物量和MDA含量基本呈现出一个U型轨迹,而茎净增长量却呈现出一个倒U型的轨迹。与对照相比,单独接种根瘤菌和同时接种AMF和根瘤菌的处理对紫花苜蓿地上部生物量都有显著的促进作用。而对于茎净增长量这种促进生长作用却不明显,盐碱胁迫对其的抑制生长作用表现更明显。这与正交分析结果一致。pH<9或在9附近时,保护酶系统在短期内仍能维持活性氧产生及清除的动态平衡,茎生长速率虽然减缓但茎仍能保持生长,而pH超过这一临界范围,动态平衡被破坏,紫花苜蓿生长受到严重抑制(图1)。表明接种根瘤菌和AMF可以提高紫花苜蓿耐盐碱性,使其在pH 约为9 (C盐,25—75 mmol/L)的土壤中仍能正常生长。
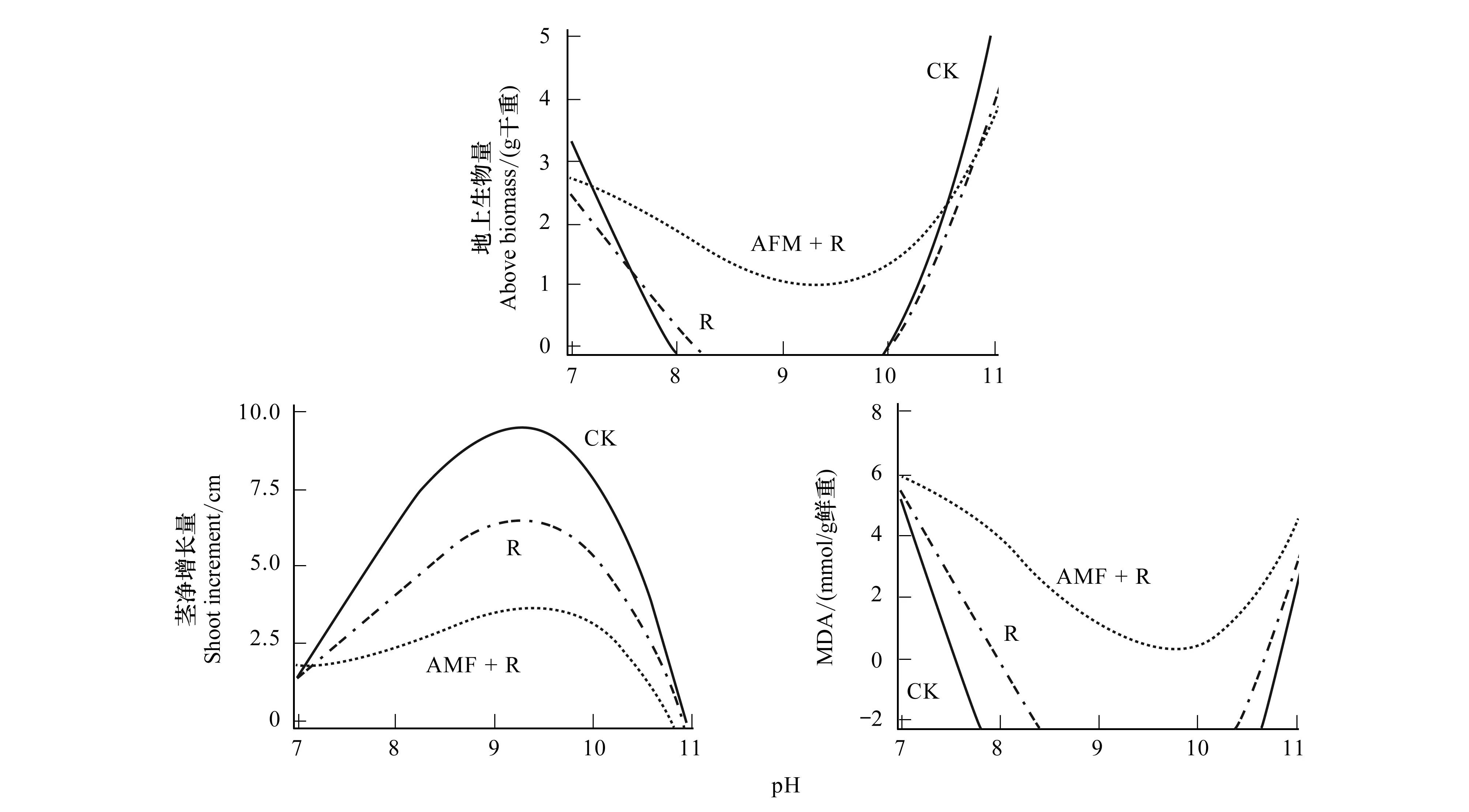
图1 紫花苜蓿地上生物量、茎净增长量、MDA含量随pH的变化Fig.1 The variance of above biomass, shoot increment and MDA content with pH CK:对照组 Control;R:接种根瘤菌处理组 Rhizobium;AMF+R:双接种AMF和根瘤菌处理组;MDA:丙二醛 Malonaldehyde
3 讨论
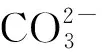
混合盐碱胁迫下接种根瘤菌与摩西管柄囊霉对紫花苜蓿的影响也可以通过其地上、地下的生物量来反映。地上与地下生物量的分配是紫花苜蓿适应盐碱的一种方式,当苜蓿受到胁迫时,根瘤菌和摩西管柄囊霉就近保护的是植株根部,所以对地下生物量影响较小,而地上部光合作用减弱,生物量积累下降。在高浓度盐碱胁迫下(pH 10.5—11),接种AMF和根瘤菌的苜蓿干重比对照要低,可能菌根化植物具有更高的水势能,在盐碱胁迫中增加了植物含水量。这与Feng等[24]研究结果一致。根瘤菌、摩西管柄囊霉与紫花苜蓿是互惠共生的,Kbdei-Lateif等[25]发现根瘤菌能促进豆科植物根部类黄酮的排出,有利于AMF孢子萌发、菌丝分枝和次生孢子的形成。必要条件下,植物还可以把这些植物生长促生菌当做营养物质的来源[26]。本实验研究结果表明,在高浓度盐碱胁迫下,两种菌不能完全抵消盐碱对植物的抑制作用。植物细胞内离子失衡,代谢紊乱,苜蓿营养不良停止生长,AMF和根瘤菌不能从苜蓿中获得足够的碳源,互惠作用受限[27]。
盐碱抑制植物的生长主要有两个阶段,第一个阶段主要是由高浓度的盐引起的水分亏缺造成的[28]。随着胁迫时间的延长,进入第二个阶段,离子毒害成为抑制植物生理代谢的主要因素[1]。盐碱胁迫下紫花苜蓿最先受到伤害的是细胞膜,MDA是膜质过氧化的产物,可以反映细胞的受损程度。许多研究表明,随着胁迫强度的增大,植物中MDA含量呈先升高后下降的趋势[29-30]。而本研究结果正好与此相反,随着盐碱胁迫程度的加大,pH值升高,MDA含量一开始呈下降趋势。其原因是AMF和根瘤菌提高了植物的抗逆性,使保护酶系统在短期内仍能维持活性氧的动态平衡,后随着盐碱胁迫程度的加大,体内活性氧的产生及清除的动态平衡受到破坏,MDA含量明显回升。这与Li等[31]的结果一致。双接种处理的紫花苜蓿中,大量渗透调节物质如脯氨酸、甜菜碱、可溶性蛋白质等积累,维持细胞内低渗透势来减轻盐碱胁迫对植物的伤害[32]。
盐碱引发的pH影响着叶片中酶的活性,同时接种根瘤菌和摩西管柄囊霉促使抗氧化酶基因AtAPX3和OsAPX4表达量上升,降低土壤pH对抗氧化酶(包括SOD、POD及CAT)活性的影响,缓解氧化应激对植物细胞造成的伤害[33]。这在本研究结果中也得到了生理水平的证实。根瘤菌可以通过调节植物的有机酸含量来减小盐碱对植物的伤害,AMF还通过吸收K+排出Na+、Cl-,增加叶片相对含水量,降低细胞膜渗透性等多种方式来参与调控植物缓解盐胁迫的机制[34-36]。不同因素对POD和可溶性蛋白的影响程度不同,这种差异可能是由于两种菌和盐碱离子的交互作用产生的。Zhang等[37]发现碱胁迫会导致杂交榛中Zn、B和Ca含量的降低,使细胞伸长和分裂受到抑制、细胞膜稳定性降低,这也是盐碱胁迫抑制植物生长的另一个因素。高浓度盐碱胁迫下,植物菌根侵染率下降, Na+积累[38]。幼叶通过光合作用可以维持低Na+和高K+含量,老叶通过加强氨基酸(如缬氨酸、丝氨酸、氨基丁酸等)的合成来进行渗透调节及维持细胞稳定[39],但比较缓慢滞后。大多数植物在NaCl溶液浓度达到150 mmol/L时就不能存活[40-41],而本实验中150 mmol/L混合盐碱胁迫未有植株死亡,这可能与植株的品种基因有关,但也说明了接菌处理增强了紫花苜蓿对盐碱溶液的抗性,3种接种方式都有利于紫花苜蓿抵抗盐碱胁迫,但从总体来看,双接种>单接摩西管柄囊霉>单接根瘤菌。这与相关研究结果一致[42]。“AMF+根瘤菌-紫花苜蓿-盐碱地”体系对提高紫花苜蓿抗盐碱性,有效利用盐碱地及农业的可持续发展有一定的重要意义。
4 结论
(1) 紫花苜蓿接种根瘤菌或/和摩西管柄囊霉后对盐碱胁迫(盐浓度<75 mmol/L,pH 7.0—9.79)耐受性提高,但根瘤菌或/和摩西管柄囊霉的促进作用不能完全抵消盐碱胁迫(盐浓度100—50 mmol/L,pH 9.87—10.52)对植物的抑制作用。盐碱胁迫对地上生物量、地下生物量、茎高净增长量、MDA、脯氨酸及可溶性蛋白的影响要大于摩西管柄囊霉和根瘤菌。
(2) 紫花苜蓿同时接种根瘤菌和摩西管柄囊霉对其株高、生物量及渗透调节能力都有所提高,且这种作用优于单接一种菌。不同接种方式对植物的影响程度为摩西管柄囊霉+根瘤菌>摩西管柄囊霉>根瘤菌。
(3)盐碱混合胁迫对紫花苜蓿的生长发育造成严重伤害,且其伤害程度要大于盐胁迫。盐碱胁迫引发的pH对植物的伤害要大于盐碱类型,接种根瘤菌和 AMF后的紫花苜蓿不仅有利于自身产量的提高,还能有效利用盐碱地。

