非灌注区域MR T2WI信号评估HIFU消融子宫肌瘤的疗效
寸江平,范宏杰,赵 卫,姚瑞红,汤蕊嘉,姜永能
(昆明医科大学第一附属医院医学影像科,云南 昆明 650032)
作为治疗症状性子宫肌瘤的一种无创性热消融技术,HIFU目前已广泛应用于临床[1],相较于传统的手术治疗方法,具有可重复性好、安全、有效、术后恢复快、一次消融多个病灶等优点。MR是术前诊断妇科肿瘤的常用方法,也是子宫肌瘤HIFU术后评价疗效最有效的手段,可清晰显示肌瘤位置、大小及术后肌瘤变化情况[2]。本研究通过分析HIFU术后第3天MR增强非灌注区域内T2WI信号特征,探讨T2WI信号在评估子宫肌瘤消融术后转归中的价值。
1 资料与方法
1.1一般资料 收集2011年11月—2017年6月于我院接受HIFU治疗的90例子宫肌瘤患者,年龄 31~43岁,平均(37.2±5.8)岁,于术前和术后第3天、3个月、6个月均接受MR平扫+增强扫描。
1.2仪器与方法
1.2.1消融治疗 采用JC200聚焦超声肿瘤治疗系统(重庆海扶技术有限公司),术中全程对患者进行镇静镇痛。首先行超声检查,以确定治疗方案。采用单点消融方法,超声监控显示单点消融区域内出现斑片状灰度变化后,调整探头进行下一点消融,经CEUS确认消融满意后结束手术。记录术中辐照时间、辐照功率及手术时间,并通过相关治疗参数计算能效因子(energy-efficiency factor, EEF):EEF=ηPt/1 000V1(η=0.7);P为治疗功率;t为辐照时间;V1为非灌注区体积)[3]。对多发子宫肌瘤患者只消融可能引起症状的优势肌瘤。
1.2.2MR扫描 采用Philips Achieva 3.0T MR扫描仪及GE Signa HDxt 3.0T超导型MR扫描仪。扫描参数:T1W,TR 400~600 ms,TE 8 ms;T2W,TR 3 000~5 000 ms,TE 90 ms;轴位矩阵320×224,层厚5 mm,层间距2 mm;矢状位和冠状位矩阵228×192,层厚5 mm,层间距1 mm。增强扫描对比剂采用钆双胺注射液(0.5 mmol/ml),采用高压注射器经肘静脉注射,流率1.5~2.0 ml/s,剂量0.2 ml/kg体质量。注入对比剂5 min后采集T1WI,参数同平扫。
术前由2名有10年及以上泌尿生殖系统影像学诊断经验的医师采用盲法评估术前MR图像,意见有分歧时经协商后达成共识。观察子宫肌瘤的位置、大小、类型及T2WI信号特征,于T2WI上分别测量子宫肌瘤的前后径(D1)、左右径(D2)和上下径(D3),计算肌瘤体积(V),V=4π×D1×D2×D3/3。消融术后第3天、3个月和6个月复查MR,根据消融术后第3天MR增强图像中非灌注区域内的T2WI信号[2]将患者分为低信号组(信号强度与骨骼肌相似,n=9)、等信号组(信号强度低于子宫肌层但高于骨骼肌,n=15)、混杂信号组(信号多样,n=40)或高信号组(信号强度等于或高于子宫肌层,n=26)。测量并计算术后第3天时的消融率,消融率=术后第3天非灌注区域体积/消融前肌瘤体积×100%。于术后第3天、3个月和6个月随访时计算肌瘤体积和残余肌瘤体积,残余肌瘤体积=消融后肌瘤体积-非灌注区域体积,体积计算公式同前。记录术中出现的不良反应。
1.3 统计学分析 采用SPSS 17.0统计分析软件。服从正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。计数资料用频数表示,多组间比较采用行×列表χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 基线资料比较 低信号组、等信号组、混杂信号组与高信号组间术前肌瘤T2WI信号和术后第3天消融率差异均有统计学意义(P均<0.05),年龄、子宫肌瘤体积、肌瘤类型、EEF和手术时间差异均无统计学意义(P均>0.05,表1)。
2.2 肿瘤残余体积比较 术后第3个月和6个月,4组间肿瘤残余体积总体差异有统计学意义(P<0.05);两两比较,高信号组肌瘤残余体积高于低信号组、等信号组和混杂信号组(第3个月:P=0.022、0.044、0.029;第6个月:P<0.001、P=0.004、0.003);低信号组、等信号组和混杂信号组间两两比较差异均无统计学意义(P均>0.05)。见表1、图1~4。
2.3 不良反应 所有患者均顺利完成手术。术中出现的不良反应主要包括骶尾部疼痛、治疗区疼痛、下肢麻木等,通过暂停消融或移动探头消融其他治疗计划区域而获得改善。术后部分患者出现下腹痛、阴道少量流血等轻微症状,均未经特殊处理而自行好转。无神经损伤、皮肤烧伤、肠道穿孔及膀胱损伤等严重并发症出现。
3 讨论
MRI可有效评价消融术后子宫肌瘤是否完全消融,从而判断患者预后,指导下一步治疗方案。既往研究[4]发现,HIFU治疗肿瘤后3天,MRI各参数与组织学的相关性最高,此时T1W、T2W和DWI是评价有无活性肿瘤残余的最佳序列。有学者[5-7]推荐采用非灌注区域体积推测消融效果,但增强图像中显示的无强化区不一定代表细胞死亡。Hectors等[4]指出,HIFU治疗后非灌注区域与组织学完全凝固性坏死区域的一致性较差,非灌注区往往大于真正凝固性坏死区域,肿瘤中心部分由于热量沉积效应导致蛋白质变性、水分丧失、新陈代谢停止等导致细胞死亡,而外周部分则主要由于热量传导作用使血管暂时性闭塞,而非真正坏死。因此,单纯以非灌注区域评价治疗效果,往往会低估有活性的肿瘤组织。有研究[8]采用MR增强扫描预测具有T2边缘征(消融治疗后在肌瘤周围即刻出现T2WI高信号)的子宫肌瘤的消融率,结果表明当肌瘤内存在T2边缘征时,基于MR增强的预测模型高估实际消融率,且消融率与T2WI高信号面积具有一定相关性。本研究中4组在术后第3天的消融率差异有统计学意义(P=0.042),可能与术前肌瘤T2WI信号特征不同(P=0.008)有关。不同T2WI信号强度代表肌瘤内组织密度、结构及含水量存在差异,T2WI低信号表示肌瘤内含丰富的胶原纤维组织,导致声阻抗较大,从而增加热能沉降效率,可能导致其消融率较高[9]。本研究中,术后第3个月和第6个月,高信号组的肌瘤残余体积分别为(20.17±9.72)cm3和(37.47±15.91)cm3,均大于其他3组,且术后随时间推移,残余肌瘤体积有所增加,提示非灌注外周区域部分细胞并未发生真正的凝固性坏死,后期因侧支循环建立或暂时闭塞的血管再通,使肌瘤残余、复发,即非灌注区域内的T2WI高信号与肌瘤残余或复发有一定关联。
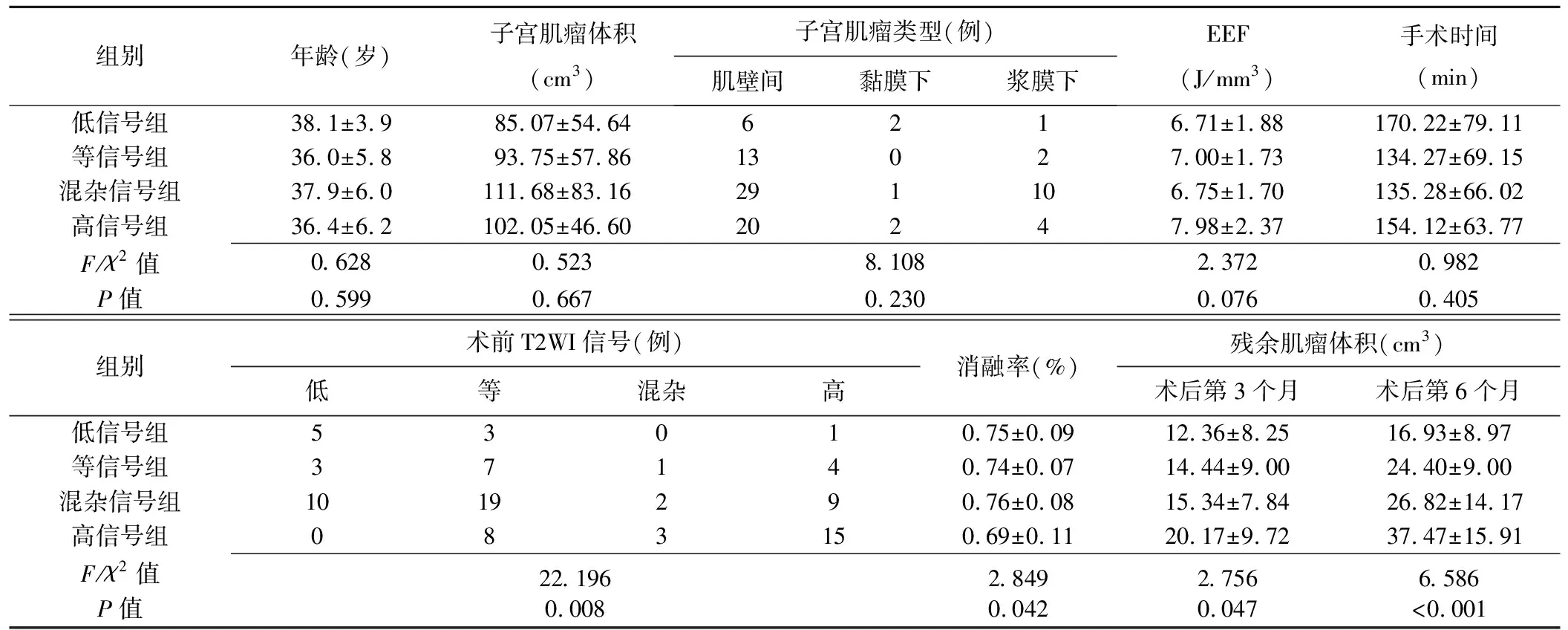
表1 4组患者消融前和消融术后资料比较
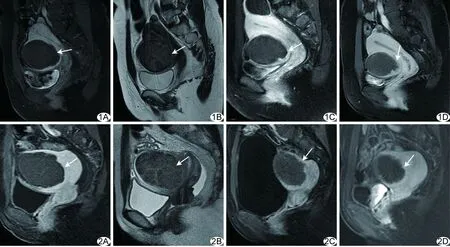
图1 患者35岁,低信号组,消融术后MRI A.消融术后第3天增强T1WI,坏死区域表现为无强化; B.消融后第3天矢状位T2WI,非灌注区域内T2WI信号强度与骨骼肌类似; C.消融术后第3个月增强T1WI; D.消融术后第6个月增强T1WI (箭示术后子宫肌瘤残余部分) 图2 患者43岁,等信号组,肌瘤消融术后MRI A.消融术后第3天增强T1WI,非灌注区域代表肌瘤凝固性坏死; B.消融术后第3天T2WI,无强化区域内T2WI信号强度介于子宫肌层与骨骼肌之间; C.消融术后第3个月增强T1WI; D.消融术后第6个月增强T1WI (箭示术后肌瘤残余部分)
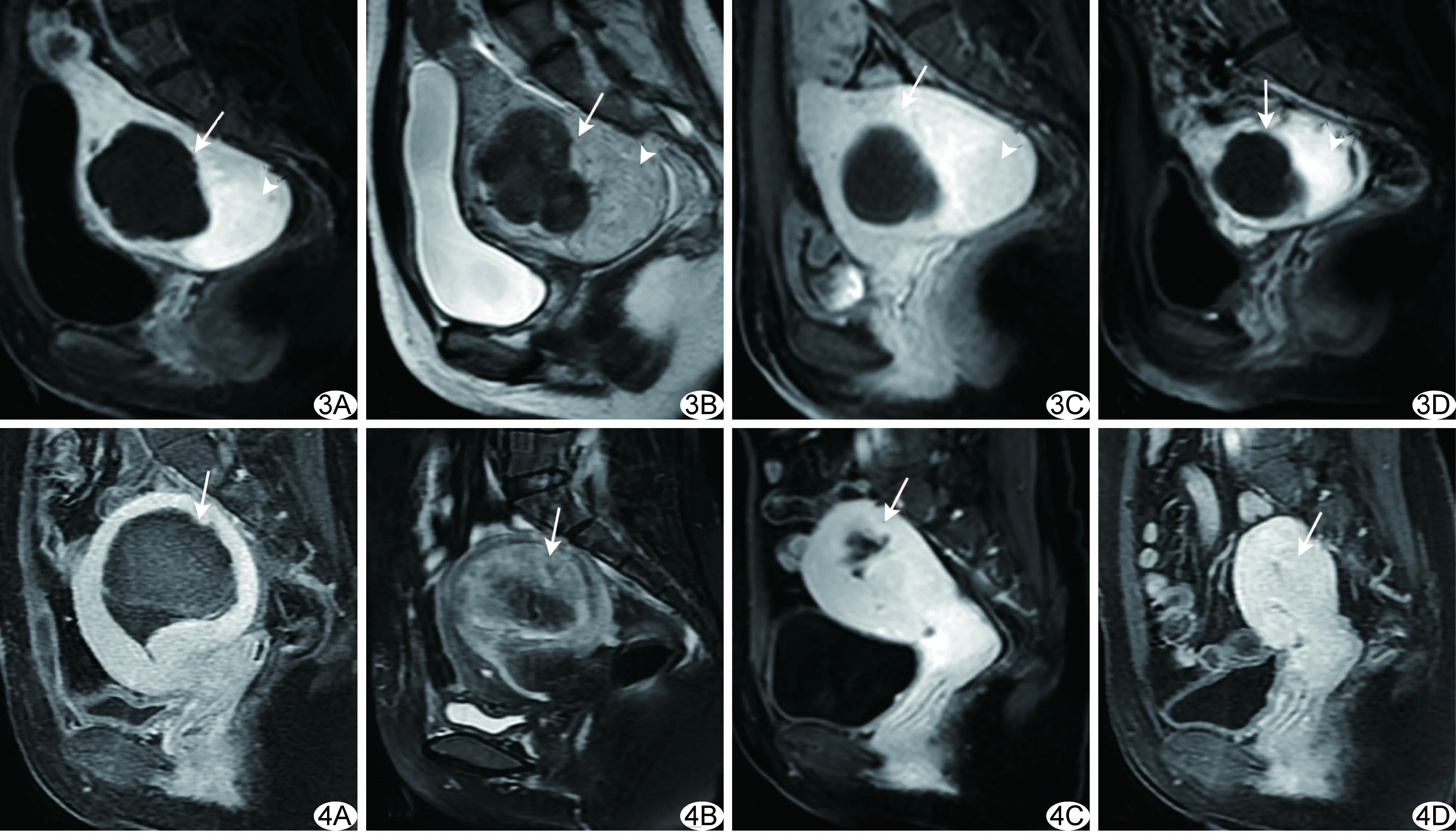
图3 患者32岁,混杂信号组,肌瘤消融术后MRI A.消融术后第3天增强T1WI; B.消融术后第3天T2WI,消融区域T2WI信号强度由类似子宫肌层信号、类似骨骼肌层信号及介于二者之间的信号组成; C.消融术后第3个月增强T1WI; D.消融后第6个月增强T1WI (箭示消融后残余肌瘤,箭头示未消融肌瘤) 图4 患者38岁,高信号组,肌瘤消融术后MRI A.消融术后第3天增强T1WI,坏死区域表现为无灌注; B.脂肪抑制T2WI,消融区域T2WI信号高于子宫肌层信号,中心有等信号区; C.消融术后第3个月增强MRI,无强化区域缩小,肌瘤残余体积增加; D.消融术后第6个月增强T1WI,非灌注区域消失,肌瘤残余体积进一步增加 (箭示术后肌瘤残余部分)
HIFU消融术后,消融区域水分大量丧失,导致T1WI呈高信号、T2WI呈低信号,T2WI信号可有效反映肌瘤的凝固性坏死和液化性坏死,故T2W是判断肌瘤组织有无残余的重要序列[10-11]。本研究中,HIFU消融术后非灌注区域内多为T1WI稍高/高信号,T2WI信号表现多样,低信号、等信号、混杂信号和高信号所占比例分别为10.00%(9/90)、16.67%(15/90)、44.44%(40/90)和28.89%(26/90)。
本研究结果发现,非灌注区域内T2WI呈高信号患者术后肌瘤残余体积较大,推测其复发率可能较高,可能与细胞高增殖率、纤维血管网络重建及激素受体再分布有关,但其具体病理机制不清楚,仍需进一步深入研究。此外,本组为回顾性研究,样本量相对较少,尤其低信号组患者只有9例,需扩大样本量研究。本研究随访过程中发现,部分高信号组患者术后第3个月和第6个月时肌瘤体积明显缩小,肌瘤残留并不明显,提示需要结合消融率、MR多参数成像对其精准分析、综合考虑。本研究部分患者术后有下腹痛、阴道流血等症状,均未行特殊处理于术后数小时至数日自行恢复,提示HIFU治疗相对安全。
总之,HIFU治疗子宫肌瘤安全、有效、无创;术后MR检查,特别是非灌注区域内T2WI信号特征对术后疗效评估有一定价值。

