Treg与Th17细胞在桥本氏甲状腺炎发病机制中的作用*
陈玉敏 胡枫湫 黄慧 陈香 王椿
(四川大学华西医院内分泌代谢科,四川 成都 610041)
桥本氏甲状腺炎(hashimoto's thyroiditis,HT)是机体内存在甲状腺自身抗体以及甲状腺组织中淋巴细胞浸润、引起甲状腺滤泡破坏或损伤、导致甲状腺功能异常的自身免疫性疾病,临床上可表现为甲状腺毒症或甲状腺功能减退。有研究[1-3]指出, Treg和Th17细胞在HT的发病中有着重要的作用,他们发现在HT动物模型及患者的外周血中,Th17细胞比例明显升高,其特异性转录因子RORγt表达量也明显升高,而Treg细胞特异性转录因子Foxp3表达量明显减少。既往的研究并未关注甲状腺功能异常是否对Treg和Th17细胞的影响。因此,为排除甲状腺功能异常对T细胞功能的影响及其HT患者甲状腺功能正常状态下T细胞功能的变化,本研究收集甲状腺功能正常HT患者的外周血,观察其Treg、Th17细胞的变化,旨在进一步探索HT的发病机制,为临床治疗HT的新方法提供依据。
1 对象与方法
1.1 研究对象 收集2015年3月~2016年11月在四川大学华西医院内分泌科门诊就诊的HT患者45例(HT组),男性7例,女性38例,年龄21~51岁,平均(35.5±9.1)岁,其中包括因出现甲状腺功能减退而服用L-T4将甲状腺功能维持在正常范围的22例(治疗组), 23例为初诊的甲状腺功能正常的HT患者(初发组)。同时纳入同期至我院进行健康体检的27名健康者设为正常对照组,其中男4名,女23名, 年龄23~49岁,平均(35.7±9.6)岁。两组间性别构成比、年龄差异无统计学意义(P>0.05)。
1.2 纳入与排除标准 纳入标准:①符合HT的诊断标准:超声检查提示甲状腺不均匀改变,回声不均,可伴多发性低回声区域或甲状腺结节,并且TPOAb(thyroid peroxidase antibody)阳性。②甲状腺功能正常维持3个月以上。排除标准:①合并其他自身免疫性疾病,如系统性红斑狼疮、类风湿性关节炎等。②近期使用过糖皮质激素、环孢菌素等免疫抑制剂。 ③TRAb(tsh receptor antibody)阳性。④严重心、肝、肾等疾病者。正常对照组入选标准:①甲状腺功能正常,TgAb(antithyroglobulin antibody)、TPOAb、TRAb在正常范围内。②既往无甲状腺疾病以及自身免疫性疾病病史及家族史。③非感染、创伤等应激状态。④肝肾功能、血脂正常。
1.3 研究方法
1.3.1 甲状腺功能及 TPOAb、TgAb 滴度检测 抽取受试者空腹静脉血,分离血清用以检测甲状腺激素水平(TSH、FT3、FT4)及TPOAb、TgAb滴度。采用电化学发光法检测,检测所用仪器为罗氏E170C与E170B,试剂为Roche试剂盒。正常参考值范围:TSH: 0.27~4.2 mIU/L;FT3:3.6~7.5 pmol/L;FT4:12.0~22.0 pmol/L;TPOAb:≤34 IU/mL;TgAb:≤115 IU/mL。
1.3.2 外周血单个核细胞(PBMC)的提取 采集各组受试对象空腹外周静脉血3ml,肝素钠抗凝,Ficoll密度梯度离心法分离获得PBMC。
1.3.3 Treg染色分析 吸取 100uLPMBC,分别加入FITC-CD4、 APC-CD25单克隆抗体(BD Biosciences),充分混匀后室温避光孵育 30 min,用Foxp3 Staining Buffer Set(eBioscience)透膜/固定后进行 PE-Foxp3 单克隆抗体(BD Biosciences)避光染色30min,流式细胞仪上机检测细胞,从分离出的PMBC中圈出CD4+T细胞,再从CD4+T群中圈出CD25+ 和Foxp3+ T细胞群,CD4+CD25+Foxp3+T细胞群即为Treg细胞。
1.3.4 Th17染色分析 取1×106细胞PMBC加入900ul RPMI-1640中,加入100ul原液胎牛血清,加入佛波酯(Sigma-Aldrich)、离子霉素(碧云天)、蛋白转运抑制剂(碧云天)使其终浓度分别为50ng/ml、1ug/ml、10ug/ml;置于细胞培养箱(37℃ 5%CO2)刺激4小时。将刺激后细胞分离并加入FITC-CD4单克隆抗体(BD Biosciences)避光染色30min,用通透固定液(eBioscience)进行透膜/固定后进行 PE-IL17A 单克隆抗体(BD Biosciences)避光染色30min,流式细胞仪上机检测细胞,从分离出的PMBC中圈出CD4+T细胞,再从CD4+T群中圈出IL17A+T细胞群,CD4+ IL-17A+T细胞即为Th17细胞。

2 结果
2.1 各组一般资料比较 HT组与正常对照组的TSH、FT3、FT4水平差异无统计学意义(P>0.05);HT组TPOAb、TgAb的滴度明显高于对照组,差异有统计学意义(P<0.05)。治疗组与初发组的TSH、FT3、FT4水平差异无统计学意义(P>0.05);初发组TPOAb和TgAb滴度的中位数水平,均明显高于治疗组,但差异均无统计学意义(P>0.05),见表1。
2.2 各组 PBMC中Treg细胞的比例 HT组外周血中Treg频率(即Treg细胞群占CD4+的比例)与正常对照组比较差异有统计学意义(P=0.001);治疗组和初发组Treg细胞比例均低于对照组(P<0.05),虽然治疗组Treg细胞比例低于初发组,但差异无统计学意义(P>0.05),见图1、表2。

表1 HT组和正常对照组一般临床资料分析Table 1 The general clinical data between HT and control group
注:与对照组比较,①P>0.05;与对照组比较,②P<0.05;与初发组比较,③P>0.05
2.3 各组PBMC中Th17细胞的比例 与对照组相比,HT组外周血中Th17频率(即Th17细胞群占CD4+的比例)有升高,但差异无统计学意义(P>0.05);初发组和治疗组Th17细胞比例,均高于对照组,但差异均无统计学意义(P>0.05);治疗组与初发组Th17细胞比例差异无统计学意义(P>0.05),见图1、表2。
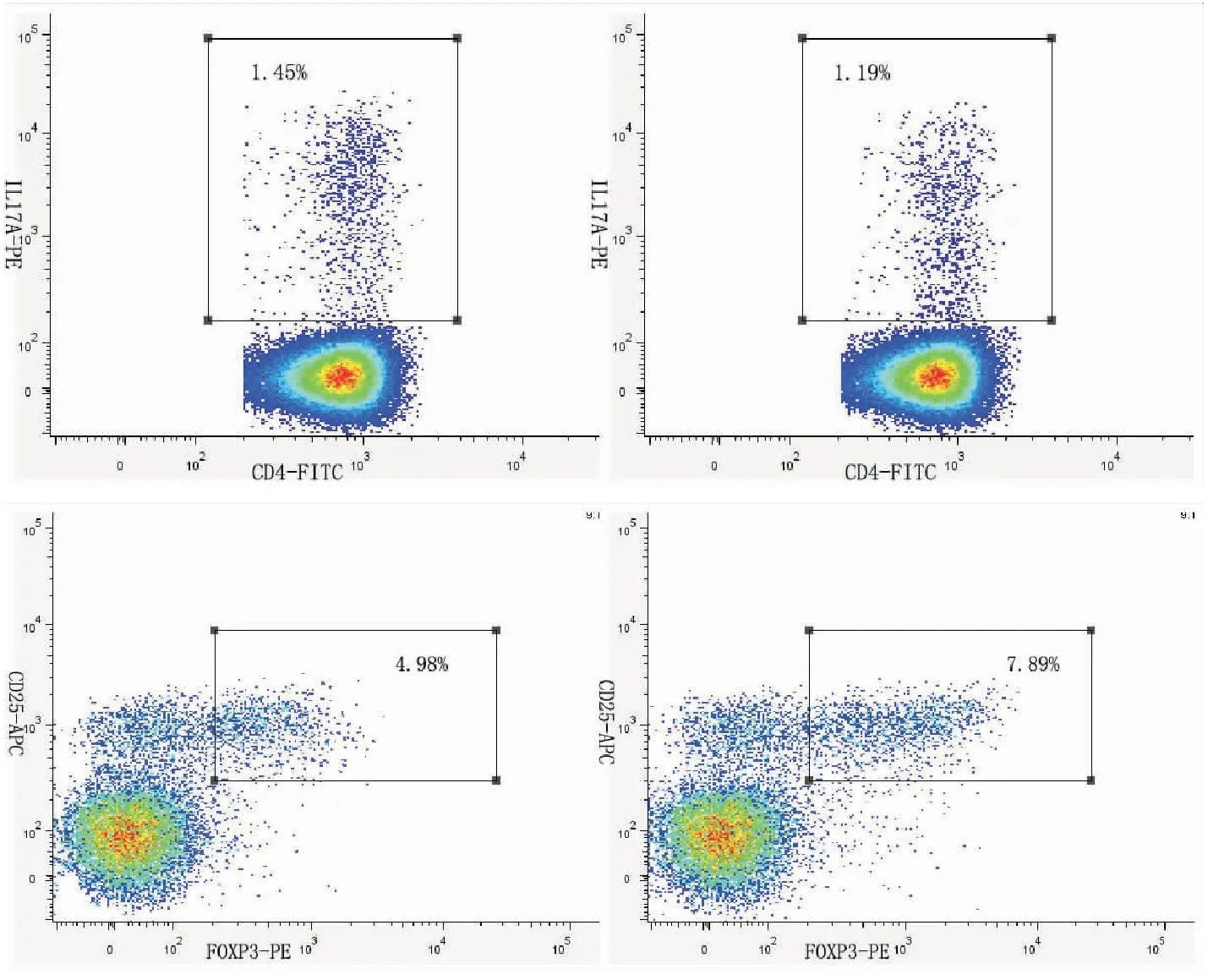
图1 流式细胞术分析 PBMC 中 Treg、 Th17 细胞所占比例Figure 1 The proportion of Treg and Th17 cells in PBMC by flow cytometry
2.4 各组 PBMC中Th17/ Treg比值 HT组外周血中Treg/Th17比值与正常对照组比较差异有统计学意义(P<0.001);治疗组Treg/Th17比值高于初发组,但两组间差异无统计学意义(P>0.05);治疗组和初发组Treg/Th17比值均小于正常对照组(P<0.05),见表2。
2.5 HT组外周血中Treg、Th17、Treg/Th17比值的影响因素分析 HT患者中,TgAb抗体滴度与外周血中Treg、Th17细胞数及Treg/Th17比值无明显相关性(P>0.05);TPOAb抗体滴度与外周血中Treg、Th17细胞数及Treg/Th17比值也无明显相关性(P>0.05)。

Table2ComparisonsofTreg,Th17,Treg/Th17ratioamongeachgroup

组别nTreg(×10-2)Th17(×10-2)Treg/ Th17HT组454.98±2.71①1.45±0.66①3.12(1.88~5.73)① 治疗组224.59±1.96②④1.33±0.77③④3.51(2.02~6.46)②④ 初发组235.38±3.39②1.57±0.50③2.86(1.44~5.42)②对照组277.89±3.751.19±0.687.2(3.7~13.01)
注:与对照组比较,①P<0.05;与对照组比较,②P<0.05;与对照组比较,③P>0.05;与初发组比较,④P>0.05
3 讨论
Th17 及Treg 细胞是近年来发现的新型免疫细胞,具有独立的分化和调节机制,且互相抑制。Treg、Th17细胞已被证实在自身免疫性疾病的发病中有着重要的作用[4]。Treg能够阻止自身反应性T细胞的活化,并抑制自身免疫性疾病的发生[5]。而Th17是一种以分泌IL-17为主的T细胞亚群,其通过高分泌IL-17使促炎因子诱导多种前炎症细胞因子和趋化因子的产生,继而参与机体炎症反应与免疫防御[4-7]。在类风湿性关节炎过敏性紫癜患者出现Treg、Th17细胞失衡,Treg / Th17比例也发生变化[8-9]。作为自身免疫性甲状腺疾病之一的桥本氏甲状腺炎,Treg、Th17细胞对其的作用也不容忽视。已有研究[2-3、10]发现,Treg、Th17细胞功能失衡在HT发病中也起了较为重要的作用。然而HT 患者外周血Treg/Th17 细胞轴的免疫失衡在甲状腺功能正常期即已出现[11]。由此可见,Treg/Th17 细胞轴的免疫失衡贯穿于HT 的不同阶段[12]。
相较于甲功正常和亚临床甲减的HT患者,临床甲减患者外周血中Treg细胞含量最低而Th17含量最高。Mao C等[13]的研究也发现,甲状腺功能亢进的Graves病患者 Treg含量明显低于药物治疗后甲功正常的Graves病人群。所以,甲状腺功能的不同本身就可能对外周血中Treg、Th17细胞有一定的影响[14]。本研究发现虽然HT患者的外周血Treg/Th17比值均低于正常对照人群,但初发甲状腺功能正常的HT患者(初发组)及HT伴甲减但予以L-T4治疗将甲功维持正常的患者(治疗组)两组间Treg/Th17比值并不存在统计学差异。因此我们并没有发现在HT 患者外周血Treg、Th17细胞含量在疾病的不同阶段呈现进行性变化。推测HT 患者外周血Treg、Th17细胞含量在不同阶段呈现出的变化可能是由于甲状腺功能变化所致,而与HT患者的免疫炎症反应的变化无直接关系。
由于Treg、Th17细胞是通过其调控因子如TGF-β、IL-6等介导的T 细胞异常免疫反应过程中发挥作用,从而参与了甲状腺组织自身免疫损伤[15]。因此,即便Th17细胞或Treg细胞数量没有变化,但其功能发生了改变,其相关调控因子水平发生了变化,也会影响免疫炎症反应。说明在HT的发病中,Treg/Th17比值的变化对其桥本氏甲状腺炎的病情的预测和判断更具有意义。
既往研究[16-18]显示L-T4可以使HT患者肿大的甲状腺缩小。即便是甲功正常的HT患者,在予以L-T4治疗后患者TPOAb抗体滴度出现明显下降,而停用L-T4后,患者TPOAb逐渐升高。本研究发现虽然TPOAb、TgAb滴度在治疗组和初发组之间无明显的统计学差异,但从数值上看,L-T4替代治疗后的HT患者的TPOAb、TgAb滴度低于初发HT人群。有学者指出[16]L-T4治疗后HT患者的B淋巴细胞也出现明显下降,提示L-T4的免疫治疗作用可能是通过影响免疫细胞实现的,L-T4可通过减少B淋巴细胞来改善HT患者的自身免疫状态。Bossowski A等[19]观察到,未予以L-T4治疗的HT患者Treg细胞数量较正常人群明显减少,但L-T4治疗6~12个月后Treg细胞数量逐渐恢复正常。可见,L-T4可以改善辅助性T 细胞和调节性T 淋巴细胞功能紊乱状态,从而降低TPOAb、TgAb滴度。因此认为L-T4对HT可能具有一定的免疫调节作用。但本研究并未发现L-T4治疗后HT患者与初发HT患者间外周血中Treg、Th17细胞数量及Treg/Th17比值的统计学差异,也未发现TPOAb抗体滴度与外周血中Treg、Th17细胞数量及Treg/Th17比值有明显相关性。提示L-T4对TPOAb、TgAb抗体滴度影响的机制较为复杂,可能并不是单一通过影响Treg、Th17细胞功能来实现[20]。也有可能是L-T4替代治疗后对TSH水平影响,使其对甲状腺组织的刺激作用减少,使免疫炎症反应减弱,从而减少TPOAb、TgAb产生[16]。有研究[21]提示可能存在其它未知因素参与调节SOCSl (suppressor of eytokine signaling l)和SOCS3 suppressor of eytokine signaling 3)的表观遗传学修饰,会影响HT的免疫炎症反应。
4 结论
桥本氏甲状腺炎的患者Treg细胞数量、 Treg/Th17比值明显降低,Treg、Th17细胞功能失衡在HT发病中起重要作用。甲状腺功能异常可能会影响Treg、Th17细胞功能。 L-T4替代治疗可能会降低桥本氏甲状腺炎患者TPOAb、TgAb滴度,但其作用机制可能并非单一通过影响Treg、Th17细胞功能实现的。

