肝细胞癌相关基因CTNNB1的3号外显子突变研究*
徐艳 谭维维 胡迅 杨宗泽 樊萍 张姝 席佳蕾 王亚曦
(四川大学华西医院生物样本库,四川 成都 610041)
原发性肝细胞癌 (Hepatocellular carcinoma,HCC) 是常见的原发性恶性肿瘤之一,肿瘤相关病死率居全球第二位[1]。HCC的发病率与性别及地域相关,男性发病率为女性的2~4倍,在地域中主要分布在亚洲 (75%) ,其中大约50%发生在中国,中国男性HCC的发病率约为 40.0 /1000000,女性约为15.3 /1000000[2-3]。
HCC的发生发展受环境与遗传等多因素影响,多年的研究已发现一些肿瘤相关基因在细胞周期调节、细胞生长及粘附等功能中具有重要的作用,可能会引起广泛的基因组改变并破坏正常细胞信号通路功能,最终导致HCC的发生。其中,癌基因CTNNB1位于3q22.1, 其所编码的蛋白β-catenin是HCC相关研究中的一个热点,该基因在HCC中的突变率可达到12.8%~44.4%,突变类型大多为单核苷酸置换和缺失突变,并且集中在其3号外显子区域[4]。中国人群中相关的研究报导较少,本研究拟对HCC患者的CTNNB1基因3号外显子突变情况进行测序,并通过免疫组化方法检测突变患者组织中β-catenin蛋白的表达水平,探讨该基因3号外显子突变与HCC发生的相关性。
1 对象与方法
1. 1 对象及材料 随机选取四川大学华西医院已行手术的100例原发性肝细胞癌患者肿瘤组织及配对的远端正常组织样本200份。患者均为汉族,其中男85 例,女15例,年龄18~75岁,所有样本均为手术后取样分装立即液氮冻存备用。所有患者均由医院病理科明确诊断为HCC。本研究经四川大学华西医院伦理委员会批准,患者均签署知情同意书。
1.2 方法
1.2.1 DNA提取 天根生化科技(北京)有限公司血液/组织/细胞基因组DNA提取试剂盒提取组织DNA。NanoDrop 8000分光光度计测量DNA浓度及纯度,A260/A280的比值在1.8~2.0之间时DNA的纯度符合PCR扩增要求。
1.2.2 PCR扩增CTNNB1基因3号外显子 引物序列为F1: 5′-CAATGGGTCAT ATCACA GATTCT -3′,R1:5′-CTAAGTATTTGCTATCCTAAATGGT -3′。PCR扩增体系包括: DNA模板 (25 ng/ml) 2μl、 KOD-Plus-Neo高保真PCR酶 (1.0U/μl) 0.4μl、上下游引物 (10 μmol/L)各0.5μl、Dntp (2 mmol/L) 2μl、MgSO4(25 mmol/L) 1.2 μl、PCR缓冲液2μl,用pH 8.2双蒸灭菌水补足总体积20μl。94℃预变性2 min;98℃变性10s,55℃退火30s,68℃延伸30s,共35个循环后68℃延伸5 min。扩增产物为466bp片段大小,经2%琼脂糖凝胶电泳检测。
1.2.3 PCR产物测序及序列分析 PCR扩增产物直接测序,由上海生工生物工程技术服务有限公司完成。为保证测序结果的可靠性,采用正反双向测序。基因测序结果使用Chromas软件和Gene Tool软件分析,对肿瘤组织、配套正常对照组织测序结果及GENEBANK中所查到的基因标准序列同时进行比对分析,判断有无突变并分析相应氨基酸的改变情况。
1.2.4 免疫组化检测突变患者肝癌组织中 β-catenin蛋白的表达 根据测序及序列分析结果,选取已发现有CTNNB1基因3号外显子突变的患者,对其肿瘤及正常对照组织进行β-catenin蛋白表达检测。所有标本制备石蜡切片并采用SP免疫组化法进行染色。β-catenin单克隆抗体,SP免疫组化试剂盒和辣根过氧化氢酶二氨基联苯胺 (diami-nobenzidine,DAB) 显色试剂盒购自Dako公司 。主要方法如下:组织经中性甲醛固定,石蜡包埋并制成4μ m厚的切片、常规脱蜡和水化后PBS液冲洗3次,3% H2O2阻断内源性过氧化物酶活性并 置于pH6.0的枸橼酸缓冲液中进行抗原修复;室温下正常山羊血清阻断非特异性反应,滴加一抗试剂,4℃孵育过夜,PBS漂洗3次,滴加生物素标记二抗,室温孵育后滴加辣根过氧化物酶标记的链霉素卵白素工作液,室温下孵育,最后DAB显色、苏木素复染、二甲苯透明、中性树胶封片。PBS代替一抗作为阴性对照。每张切片在高倍镜 (×400)下随机选择 10 个不重复视野。结合染色强度和阳性细胞百分比综合判定结果。染色强度为无着色0分,浅黄色1分 ,棕黄色2分 ,棕褐色 3分;阳性细胞百分比<10%计 0分 ,10%~40%计 1分,41%~ 70%计2分 ,≥71%计 3分;将上述两项得分相加,0~1分为蛋白表达阴性,2分为弱阳性,3~4分为阳性,5~6分为强阳性,其中 2~6分为蛋白表达阳性。
1.3 统计学分析 采用SPSSl8.0统计软件对CTNNB1基因突变与患者性别、发病年龄、有无乙型肝炎病毒 (hepatitis B virus, HBV) 感染及肿瘤分化程度等临床病理特征之间的相关性进行分析。其中,计数资料比较应用四格表卡方检验;计量资料比较应用t检验或方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1CTNNB1基因3号外显子突变情况 100例肿瘤组织中3例发生突变,突变率为3%。3例均为杂合错义突变,1例为CTNNB1外显子区域第363位碱基出现一个杂合突变 (c.363 A> T),引起第32位密码子编码的氨基酸由天冬氨酸变为了缬氨酸 (p.D32V),见图1;另外2例患者均在外显子区域第375位碱基检测出同一种杂合错义突变 (c.375 A> C),引起第36位密码子编码的氨基酸由组氨酸变为了脯氨酸 (p.H36P),见图2。这两种突变均位于既往报道的3号外显子突变热点区域。
2. 2 β-catenin蛋白在CTNNB1基因3号外显子突变患者组织中的表达 对3例检测到CTNNB1基因3号外显子突变的HCC患者的肿瘤及配对正常组织进行免疫组化检测,结果均显示:β-catenin蛋白在正常肝组织中主要定位于细胞膜,为弱表达;肿瘤组织染色主要定位于细胞膜及胞浆,表达明显较正常组织增强,为强阳性表达,见图3。
2.3CTNNB1基因突变与临床病理特征之间的关系 将3例CTNNB1突变患者归为一组,无突变者归为另一组,对患者的性别、发病年龄、有无HBV感染及肿瘤分化程度等临床表型进行比较,差异均无统计学意义(P>0.05),见表1。
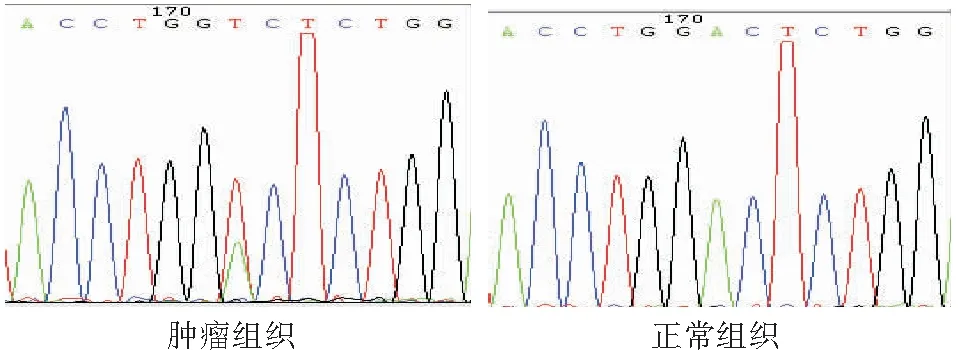
图1CTNNB1基因杂合错义突变(c.363A>T,p.D32V)
Figure1Themissensemutations(c.363A>T,p.D32V)ofCTNNB1gene
图2CTNNB1基因杂合错义突变(c.375A>C,p.H36P)
Figure2Themissensemutations(c.375A>C,p.H36P)ofCTNNB1gene
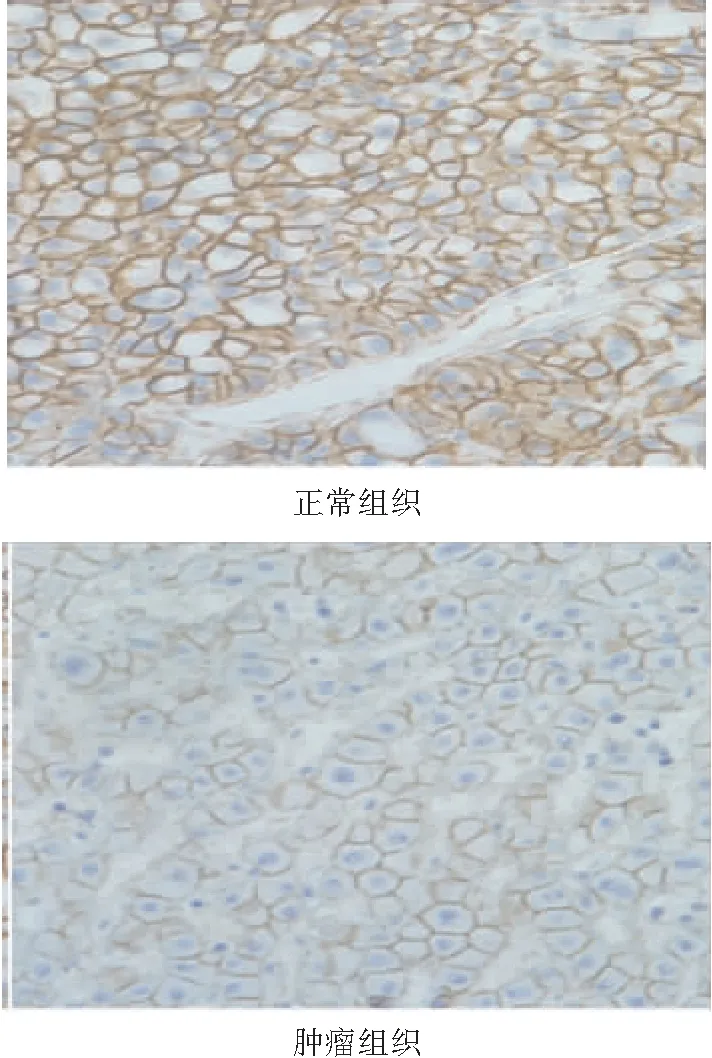
图3 HCC患者肿瘤及正常组织中β-catenin蛋白表达(×400)
Figure3β-cateninexpressionintumorandnormaltissuesofHCCcases(×400)
表1CTNNB1基因突变与临床病理特征相关性
Table1TherelationshipbetweenclinicopathologicalcharactersandCTNNB1mutations
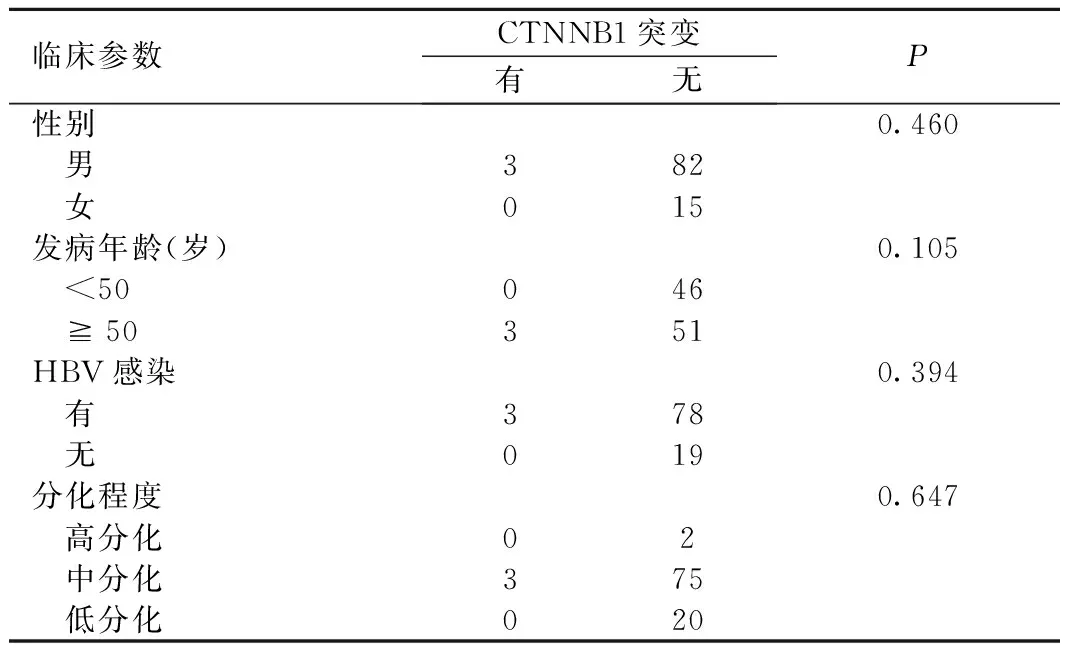
临床参数CTNNB1突变有无P性别0.460 男382 女015发病年龄(岁)0.105 <50046 ≧50351HBV感染0.394 有378 无019分化程度0.647 高分化02 中分化375 低分化020
3 讨论
大量研究显示,包括HCC在内,不同类型的癌症中均检测到了CTNNB1基因突变,并且突变大多发生在3号外显子区域。该基因突变能够造成其编码蛋白β-catenin表达异常,在胞质内聚集并转位入核导致Wnt/β-catenin信号通路异常活化,并进一步影响到细胞的生存、增殖、分化及血管生成等各种功能。
目前已发现其异常表达与很多癌症的发生有关,如肝癌、结肠癌、肺癌、乳腺癌、甲状腺癌和前列腺癌等[5-8]。本研究在100例HCC患者肿瘤组织中发现了两种杂合错义突变,突变率为3%,其中1例突变 (c.363 A> T) 引起密码子32所编码的天冬氨酸变为了缬氨酸 ( p.D32V);另外2例患者的同一种突变 (c.375 A> C),则使密码子36所编码的组氨酸变为了脯氨酸 ( p.H36P)。这两种突变均位于既往报道中的CTNNB1基因3号外显子突变热点区域(密码子32、33、36、37、41、45等区域)[9-11],即正好位于β-catenin蛋白的重点功能区域氨基端,这一区域包括糖原合成酶激酶3β (Glycogen synthase kinase-3β,GSK-3β) 和酪蛋白激酶1α (Casein kinase1α,CK1α) 的磷酸化位点,其中,密码子33、37、41为GSK-3β的磷酸化位点、密码子45为CK1α的磷酸化位点;而本研究检测到的两种突变分别位于密码子32、36,则属于邻近GSK-3β绑定位点的非磷酸化位点,一些研究报道认为该类突变主要是通过氨基酸的结构变化引起蛋白质的功能改变,干扰β-catenin与GSK-3β等激酶的正常结合并致磷酸化异常,正常情况下, β-catenin 的磷酸化是启动其泛素降解的起始信号,以上突变最终可能导致β-catenin 逃避降解,并在胞内水平升高[12-13]。因此,本研究进一步检测这3例HCC患者肿瘤及配对正常组织中的β-catenin蛋白表达情况,结果均显示β-catenin蛋白在正常组织中弱表达,在肿瘤组织中的表达则相对明显增强,提示本研究所检测到的2种突变很可能直接导致了患者肿瘤组织中β-catenin蛋白的异常高表达。在生理状态下,Wnt/β-catenin信号通路参与调控正常肝细胞的功能,动物实验发现,刚出生的小鼠体内β-catenin含量会迅速升高并在细胞核内聚集,这种变化与肝细胞的增殖活跃相一致,在短期内可促进肝脏的生长;在成年期的肝脏,该基因磷酸化失活,β-catenin蛋白大部分位于细胞膜上,很少出现于细胞质和细胞核中[14-15]。针对不同物种的研究又发现,小鼠、大鼠及人类肝脏再生时,β-catenin均有显著的升高,这种升高是由于蛋白降解的减少所致,而非mRNA的高表达造成,因此,Wnt/β-catenin通路在肝脏的生长和再生修复中发挥着重要的作用[16],但这种生理性的升高通常在48 h内降至正常水平。病理状况下,胞浆内β-catenin水平升高入核形成β-catenin-Tcf/Lef复合体,通过调控其下游靶基因的表达并与其它信号通路,如核因子-κB(Human nuclear factor-kappa B,NF-κB)、转化生长因子β (Transforming growth factor-β,TGF-β) 等通路相互作用而参与HCC的发生,转移等过程[17-18]。
HBV慢性感染是我国HCC发生的最主要病原之一,既往针对CTNNB1基因突变与HBV相关HCC的研究结果并不一致,部分研究在HBV相关HCC患者中检测到较高的CTNNB1基因突变率[20],而较多的研究则认为相对于丙型肝炎病毒 (Hepatitis C virus,HCV) 感染或饮酒相关的HCC,CTNNB1的基因突变率在HBV相关HCC中是相对较低的[21-22]。本研究观察到3例检测出突变的患者共同的特征都是大于50岁的男性HBV感染患者,但经过统计分析,突变与临床病理特征之间的关系无统计学意义,可能与纳入研究的样本量相对较小、同时在本研究人群中所发现的突变率较低有关,还需加大样本量进一步证实,并考虑该基因其它外显子突变的可能性。
4 结论
本研究结果表明,CTNNB1基因3号外显子突变存在于HCC患者肿瘤组织中,并导致其编码蛋白的异常表达,可能与HCC的发生相关。由于纳入研究的样本量较小,需扩大样本量对该基因变异予以进一步验证。

