季节和年龄因素对精子形态参数的影响*
武新梅,陈 华,陈允国,刘文芹
(温州医科大学附属第二医院,浙江温州 325027)
自1916年有研究者首次将精子畸形与男性生育力联系以来,人们对精子形态与精子功能之间相关性的认识不断加深。随着精子形态学分类体系的建立,多项研究认为精子形态与顶体反应、透明带结合试验、核染色质完整性密切相关,精子形态学分析在男性不育的诊断和治疗中发挥重要的作用[1]。此外,辅助生育技术已成为男性不育治疗的重要手段,精子形态学分析在体外受精中也有着重要的预测价值。本研究以温州地区9 648份男性精子形态学分析报告为例,探讨季节、年龄因素对男性精子形态参数的影响。现报道如下。
1 资料与方法
1.1一般资料 9 648份精液标本来自2009年9月至2015年2月在本院进行精子形态分析的男性患者,年龄19~54岁,禁欲时间3~7 d。
1.2方法
1.2.1分组 年龄分组:A组为30岁以下,4 022例;B组为>30~40岁,4 960例;C组为40岁以上,666例。季节分组:按取精时间划分,3~5月为春季,2 618例;6~8月为夏季,2 608例;9~11月为秋季,2 478例;12月、1~2月为冬季,1 944例。
1.2.2制片及精子染色方法 每例患者禁欲3~7 d,手淫取精,37 ℃水浴箱液化,液化好的精液滴于洁净载玻片上,推成薄片,自然干燥后改良巴氏染色。
1.2.3精子形态学分析 形态分析参照世界卫生组织编写的《人类精液及精子-宫颈黏液相互作用实验室检验手册(4版)》标准进行[2]。100倍油镜下,每份标本计数至少200个精子。
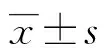
2 结 果
2.1季节因素对精子形态参数的影响 9 648份标本,以取精时间为准,按季节划分为春季组(2 618份)、夏季组(2 608份)、秋季组(2 478份)和冬季组(1 944份)。秋季组平均年龄明显低于其他3组(P<0.05),春季组明显高于夏、冬季两组(P<0.05),夏、冬季两组间差异无统计学意义(P>0.05);4组间禁欲时间差异无统计学意义(P>0.05);秋季组形态正常率明显低于其余3组(P<0.05),春、夏、冬季3组间差异无统计学意义(P>0.05);秋季组头部形态畸形率明显低于其余3组(P<0.05),春、夏、冬季3组间差异无统计学意义(P>0.05);颈部及中段畸形率4组间差异有统计学意义(P<0.05),从高到低依次为春、冬、秋、夏;尾部畸形率除夏、冬季两组间差异无统计学意义(P>0.05),其他各组间差异有统计学意义(P<0.05);细胞质小滴比例除春、秋季两组间差异无统计学意义(P>0.05),其他各组间差异有统计学意义(P<0.05);夏、秋季两组和春、冬季两组间畸形精子指数(TZI)和精子畸形指数(SDI)差异无统计学意义(P>0.05),但夏、秋季两组低于春季组,冬季组高于夏季组和秋季组(P<0.05)。见表1。
2.2年龄因素对精子形态参数的影响 9 648份标本按年龄分为A(4 022份)、B(4 960份)、C(666份)3组,平均禁欲时间B组明显高于A组(P<0.05),C组明显高于B组(P<0.05);B组精子形态正常率明显高于A、C两组(P<0.05),A、C两组间差异无统计学意义(P>0.05);B组精子头部畸形率明显低于A、C两组(P<0.05),A、C两组间差异无统计学意义(P>0.05);C组颈部及中段畸形率明显高于A、B两组(P<0.05),A、B两组间差异无统计学意义(P>0.05);尾部畸形率和细胞质小滴比例3组间差异无统计学意义(P>0.05);C组TZI明显高于A、B两组(P<0.05),A、B两组间差异无统计学意义(P>0.05);SDI在3组间差异无统计学意义(P>0.05)。见表2。
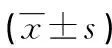
表1 季节对精子形态参数的影响
注:与春季组相比,aP<0.05;与夏季组相比,bP<0.05;与秋季组相比,cP<0.05
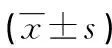
表2 年龄对精子形态参数的影响
注:与A组相比,aP<0.05;与B组相比,bP<0.05
3 讨 论
当前的环境恶化,如气温升高、森林破坏、大气污染及水资源缺乏等,已经超过了过去几千年变化的总和。而这些变化可能会影响人类的生育潜能,如精液质量。近年来的多项研究认为,人类和动物的精液质量有逐渐下降的趋势,这引起了医学研究者们对生殖健康的关注[3]。作为预测男性生育能力的重要指标,精子形态学分析结果除受到染色方法、分析标准和技术人员主观性等因素左右外,还受年龄、季节、气候、禁欲时间、地理位置等因素的影响[1]。尽管已有年龄、禁欲时间、季节因素对精子形态影响方面的研究,但由于地理位置差异,形成了各个地区独特的气候条件,再加上风俗习惯的差异等因素,可能会对精子形态产生不同的影响。本研究以温州地区9 648份男性精子形态学分析报告为例,探讨季节、年龄因素对男性精子形态参数的影响。
国内外就季节对精液密度、活动力等指标的影响已有报道,但季节对精子形态的影响报道较少。CENTOLA等[4]对1996-1998年的2 065份标本精子形态进行回顾性分析,发现随着季节的变化,精子正常形态的比例没有出现明显差异,但尾部缺陷比例春季明显高于其他3个季节,秋季尖头精子比例明显高于其他3个季节,夏季未成熟精子比例明显高于其他3个季节。CHEN等[5]对2000-2002年306份男性不育患者标本的精子形态进行交叉研究,发现秋季正常形态精子的比例为7.5%,高于其他3个季节,但差异不明显。CHEN等[6]对1989-2000年马萨诸塞州文森特地区的551份标本精子形态进行回顾性分析,发现冬季正常形态精子比例为9.2%,明显高于春、夏季,而夏、秋季头部缺陷的比例又明显高于冬季。ZHANG等[7]对1 866例供精志愿者的13 635份标本精子形态进行回顾性分析,发现精子形态正常率最低的在仲夏,最高的是秋、冬季节;头部缺陷比例最低的是秋、冬季节,春季明显增加;尾部缺陷比例最低的是仲夏,夏季早、中、晚3个时期尾部缺陷比例变化明显。CARLSEN等[8]对27个健康男性历时16个月的纵向研究认为季节因素不影响精子形态。国内张欣宗对259份精液标本的精子形态分析结果显示,春、冬季组精子正常形态率明显高于夏、秋季组(P<0.05);春、冬季组精子头部异常率、颈部和中段异常率、细胞质小滴比例、TZI及SDI明显低于夏、秋季组(P<0.05);夏、秋两季精子异常率的增高不仅体现在精子头部,还包括颈部和中段异常及细胞质小滴的增多,SDI及TZI均增加,夏、秋季异常精子的比例比春、冬季高[9]。本研究结果显示,秋季组形态正常率明显低于其余3组,春、夏、冬季3组间差异无统计学意义(P>0.05);秋季组头部形态畸形率明显低于其余3组,春、夏、冬季3组间差异无统计学意义(P>0.05);颈部及中段畸形率4组间差异有统计学意义(P<0.05),从高到低依次为春、冬、秋、夏;尾部畸形率除夏、冬季两组间差异无统计学意义(P>0.05),其他各组间差异明显(P<0.05);细胞质小滴比例除春、秋季两组间差异无统计学意义(P>0.05),其他各组间差异有统计学意义(P<0.05);夏、秋季两组和春、冬季两组间TZI和SDI差异无统计学意义(P>0.05),但夏、秋季两组和春、冬季两组间差异有统计学意义(P<0.05)。由于精子从产生到排出需要一段时间,一般为3个月,因此夏季温度较高影响精子产生,到秋季表现为精子形态正常率低。
造成不同研究间结果差异的因素除受研究对象、统计方法、染色方法、分析标准和技术人员主观性等影响外[10],也与各个地区独特的地理位置、气候条件、风俗习惯分不开[11]。温州市地处浙江省东南部,为中亚热带季风气候区,冬、夏季风交替明显,温度适中,四季分明,雨量充沛,年平均气温为17.3~19.4 ℃,年日照数在1 442~2 264 h。另外,微生物、理化、内分泌等因素也会对精子形态产生影响,温州私营个体企业较多,环境污染严重也是不容忽视的影响因素。
人精子形态除受外界环境因素影响外,与人的年龄也有一定的关系。随着年龄的增长,睾丸灌注减少、生理功能下降。这种下降首先反映在精子形态上[12],而精子形态又与精卵结合、顶体反应、精子穿卵等功能息息相关,同时精子形态正常与否在一定程度上也反映了精子染色质浓缩程度和DNA片段化水平,从而对胚胎发育及辅助受孕起到一定的预测作用[13]。另外,随着年龄的增长,男性精液内氧自由基明显增多,当氧自由基过多超过了机体抗氧化能力或抗氧化能力遭到破坏时,可直接氧化DNA碱基或通过脂质过氧化产物(MDA)与DNA共价键结合,造成DNA链损伤或断裂,这种伤害表观可能体现在精子功能与形态上[14]。CHEN等[6]研究认为,随着年龄的增长,精子形态正常率下降趋势明显,尾部缺陷显著增加;而该研究者的另一个交叉研究中则未发现年龄增加对精子形态产生明显的影响,并认为可能是因为研究群体比较年轻的原因[5]。一篇包含20篇相关文献,研究对象年龄为30~50岁的Meta分析认为,年龄的增加影响男性精子形态正常的比例[15]。本研究结果发现,>30~40岁年龄组精子形态正常率最高、头部畸形率最低,与30岁以下组和40岁以上组相比,差异有统计学意义(P<0.05);而TZI在40岁以上组最高。可能是精子形态参数在>30~40岁年龄段到达最佳,此后随着年龄的增加,呈下降趋势。
综上所述,季节和年龄因素均可能影响温州地区男性精子的形态正常率,在男性生育力评估和不育的诊断中应考虑这两方面的因素。

