可切除胃癌新辅助化疗术后辅助化疗对比化放疗的一项国际多中心、开放标签的随机Ⅲ期临床试验
——CRITICS研究解读
1 背景
晚期胃癌患者的生存率约为25%,局部复发是主要的治疗失败原因,复发率高达60%~80%,主要复发部位包括残胃、瘤床、吻合口及最多见的淋巴结复发。对于进展期胃癌,现有的治疗策略主要包括3种:以日本为代表的东亚地区常用的扩大淋巴结清扫术(D2手术)、以美国为代表的术后辅助化疗或放化疗和以北欧为代表的围手术期化疗。
奠定辅助化放疗地位的里程碑式研究为SWOG 0116研究(对比单纯手术和手术联合辅助化放疗),结果显示,无论总生存期(overall survival,OS)还是无复发生存期(recurrence-free survival,RFS),手术联合辅助化放疗都明显优于单纯手术。基于该结果,美国推荐高复发风险的患者常规行术后放疗。但由于该研究入组患者分期偏晚及手术完成度低等原因,术后化放疗策略一直未被广泛接受。与之相似的是,韩国ARTIST研究在D2术后的患者中比较辅助化放疗与辅助化疗的疗效差异,尽管排除了手术方式的干扰,结果仍是阴性的;但亚组分析提示,术前存在阳性淋巴结的患者术后化放疗仍能获益。
在北欧,接受度较高的围手术期化疗策略以MAGIC研究为代表(对比单纯手术与手术联合围手术期化疗),结果显示,患者接受围手术期化疗获益明显,并且在接受术前化疗后,手术可切除率增加。
由此,MAGIC研究结果公布后,CRITICS研究便紧随其后开展起来:在新辅助化疗和手术完全切除的基础上,对比术后化疗和术后化放疗的疗效差异。此外,辅助阶段增加一种治疗方式,经济成本增加,成本效果是否足够大,这也是值得思考的问题。
2 研究概况
本研究入组标准:初治ⅠB~ⅣA期胃腺癌患者,肿瘤位于胃或胃食管结合部;18岁以上且PS评分<2;心、肝、骨髓及肾功能良好;既往未接受过放化疗。
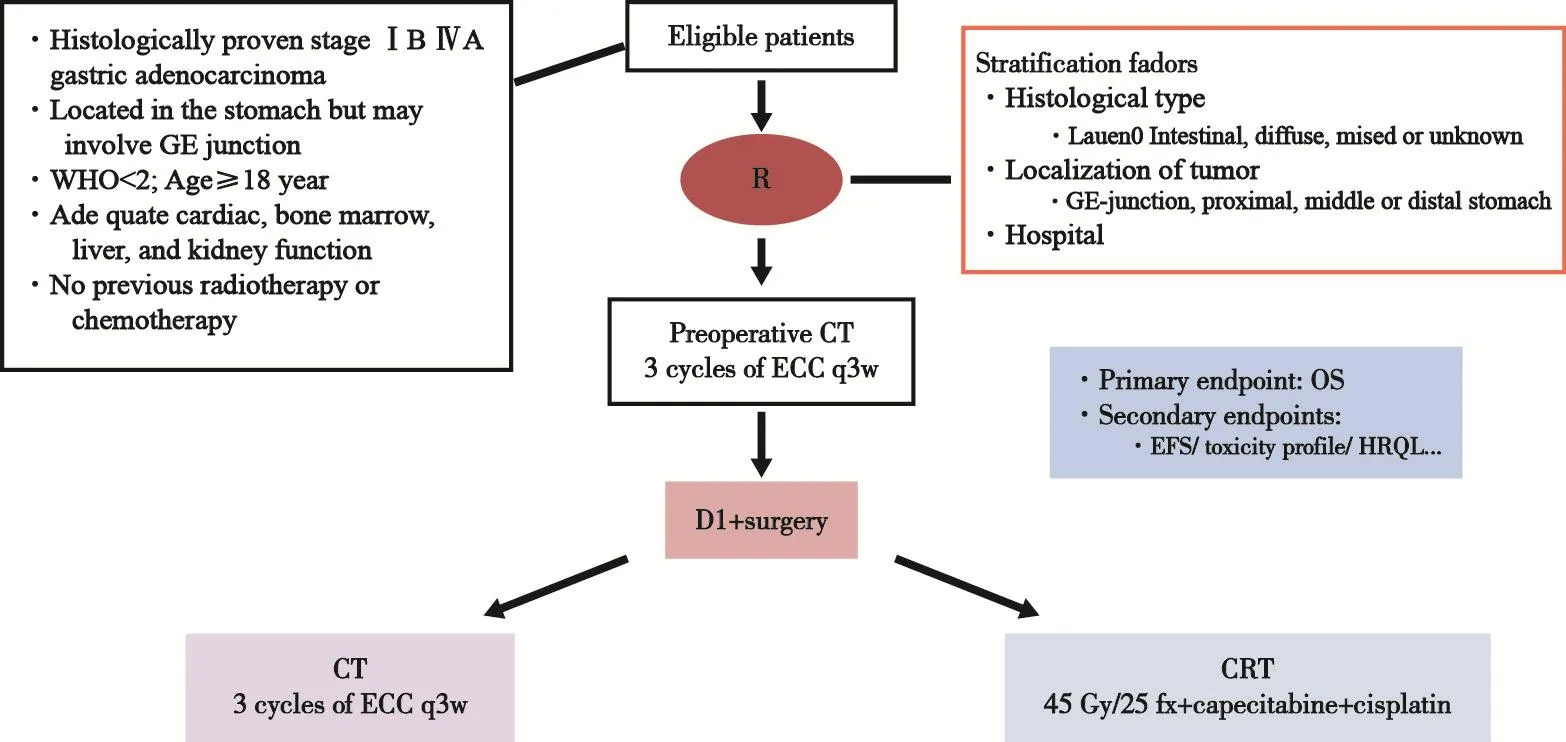
图 1 患者入组与治疗分配Fig. 1 Registration and randomization
根据患者的组织学类型、肿瘤部位和医院进行分层随机,随后都进行3个周期的ECC方案化疗(表柔比星+顺铂或奥沙利铂+卡培他滨)和手术,手术要求至少是D1+手术,根据随机结果进行术后化疗(CT组)或放化疗(CRT组)。
主要研究终点是OS,次要研究终点包括无事件生存(event-free survival,EFS)、不良反应和生活质量等。
3 样本量及统计分析计划
根据本研究的设计,可进行样本量估计的复核:Alpha=5%,Power=80%,预期围手术期化疗策略5年OS率约为40%,若采用术前化疗加手术加术后辅助化放疗,预期5年OS率可提高到50%,这相当于HR=0.76。计划入组时间4年,最后1例患者入组后随访3年进行分析。基于上述设计,要求达到事件数404例,对应的样本量为745例,考虑一定量的失访,研究最终入组788例。
从研究设计来看,这是一个非常简洁的设计,因此统计分析计划也比较简洁。首先是在意向性原则治疗(intention-to-treat,ITT)的人群中进行疗效比较分析,生存曲线的差异采用Kaplan-Meier法展示(Log-rank检验),多因素分析采用分层COX模型计算HR。其次,对疗效分析预设同质性检验:即基线亚组因素与治疗策略之间的交互作用,以森林图和99%CI展示结果,以避免亚组分析多次检验造成的假阳性率上升的问题。从研究方案来看,本研究还计划了一些子研究,包括在收集两种治疗模式的生存结局之后,做一些模型的验证,例如Maruyama指数预后价值的验证和MSKCC Nomogram模型的验证。此外,还可基于患者的标本做一些转化性研究。这些计划有利于研究数据的深度利用,有待将来发表。
4 研究结果
研究共入组788例患者(CT组393例,CRT组395例)。研究流程见图2,两组患者基线情况见表1。分层因素即组织学分型和肿瘤位置在两组间分布均衡。从流程图可以看出,两组分别只有59.2%和62.0%的患者接受辅助化疗和辅助放化疗,而且真正完成治疗方案的只有45.8%和49.9%的患者。
接受根治手术的患者中,两组之间的病理分期较均衡,手术方式相差不大,但是值得注意的是,一部分患者未能行D1+手术,并且两组都有部分患者的手术不是R0切除(表2)。
由于死亡、疾病进展、不良反应及患者身体不耐受等原因,两组术后只有将近60%的患者进行了辅助治疗。其中,真正完成预设治疗方案的,辅助化疗组为77%,辅助化放疗组为82%(表3)。
中位随访61.4个月后,CT组和CRT组中位OS分别是43和37个月(HR=1.01),5年OS率分别为42%和40%,差异无统计学意义(P=0.90)。两组的中位EFS分别为28和25个月(HR=0.92),5年EFS率分别为39%和38%,差异无统计学意义(P=0.92,图3)。主要的EFS事件包括局部复发、腹膜转移、远处复发、多部位转移及死亡,各项发生率在两组之间差异均无统计学意义(P>0.05)。
针对OS的亚组分析结果显示,只有性别与治疗策略疗效之间存在显著交互作用,提示女性可能从辅助化放疗中获益;其他因素与治疗策略之间无显著交互作用,不同亚组中两种治疗策略的OS差异无统计学意义(图4,P>0.05)。
不良反应方面,不论是术前治疗阶段还是术后辅助治疗阶段,不良反应基本可以接受。CT组非发热性中性粒细胞减少发生率高于CRT组[79例(34%) vs 11例(4%)]。术后辅助治疗中无患者死亡(表4)。手术并发症主要以感染和手术相关并发症为主,两组发生率差别不大。主要的手术相关并发症包括吻合口漏、肠梗阻、出血、腹部伤口裂开、瘘管及其他(表5)。
基于上述结果,本研究主要结论如下:对于可切除的胃癌患者,接受新辅助化疗序贯手术治疗后,辅助化放疗相比化疗并未改善患者生存;两种治疗模式安全性相似。由于术后辅助治疗依从性较差,后续的研究方向应侧重于新辅助治疗策略的优化。
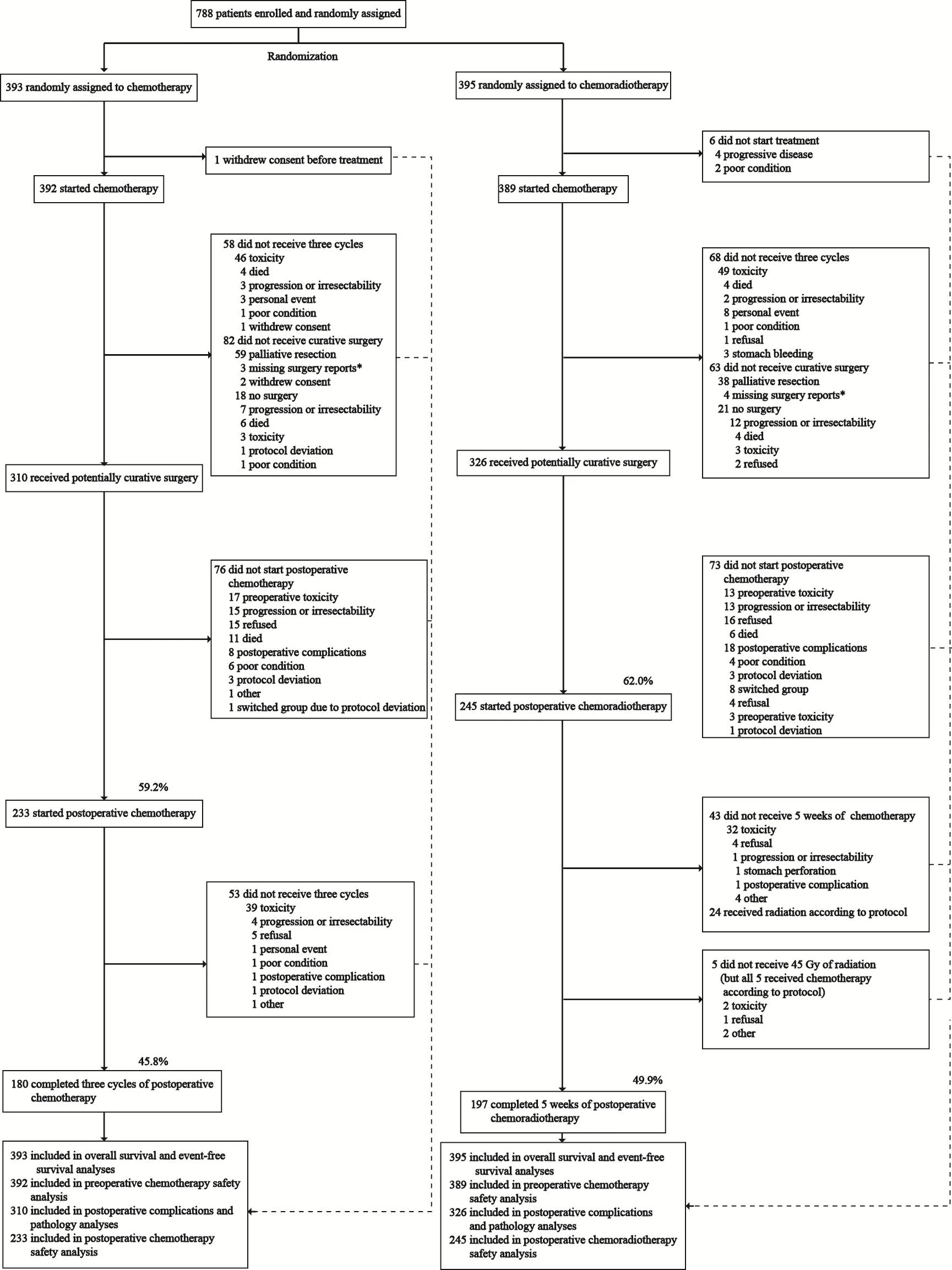
图2 研究流程图Fig. 2 Trial profile

表1 基线信息Tab. 1 Baseline characteristics[n(%)]

表 2 根治术后手术及病理结果Tab. 2 Surgical and pathological outcomes in patients who had potentially curative surgery[n(%)]
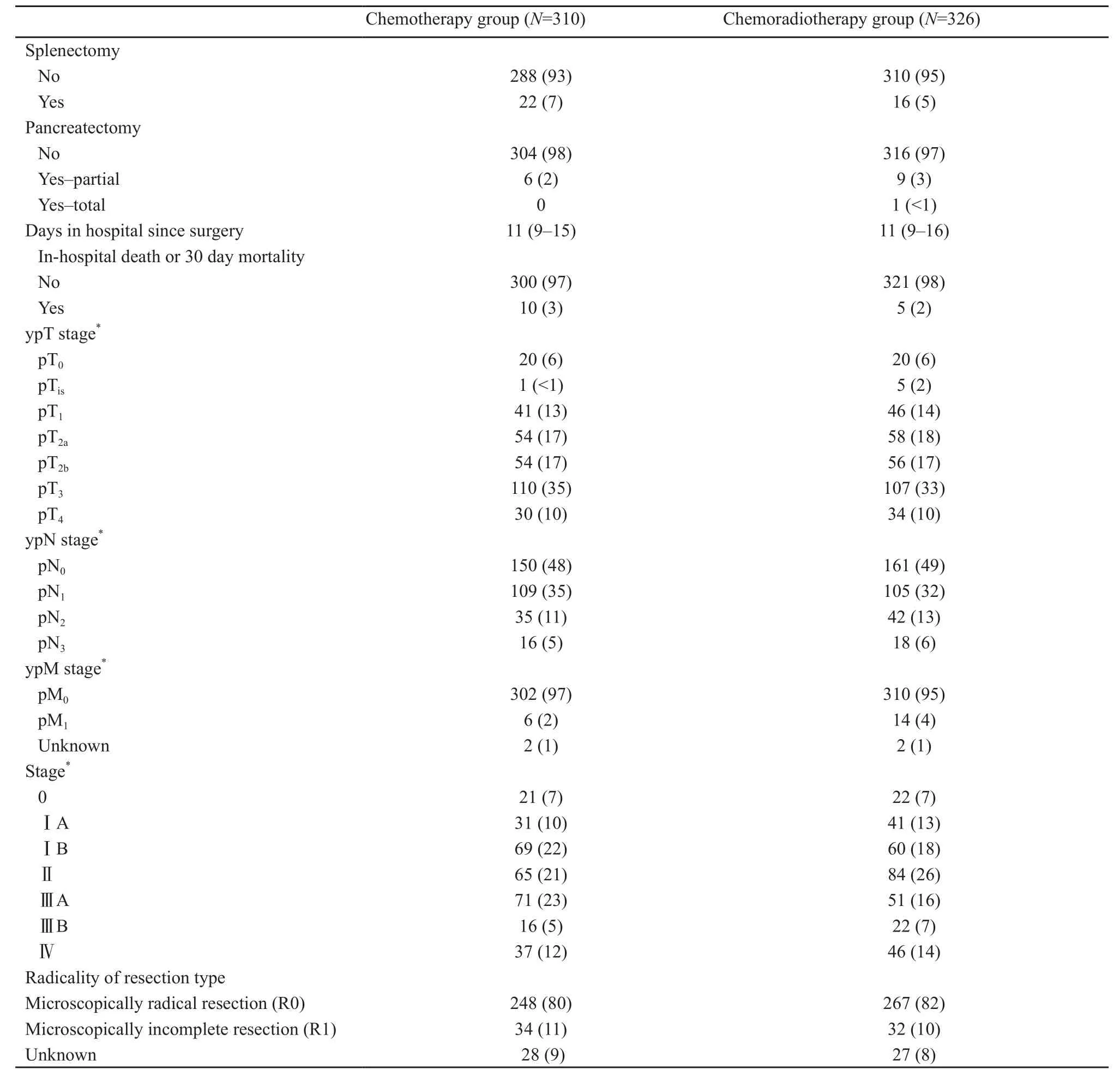
续表2

表 3 治疗完成情况及未完成原因Tab. 3 Fulfilment of the treatment and cause to stop treatment[n(%)]

Number at risk (number censored)Chemotherapy group 393 (0) 298 (0) 230 (6) 176 (31) 127 (69) 88 (94) 58 (120) 36 (142) 23 (154)Chemoradiotherapy group 395 (0) 298 (1) 237 (4) 176 (25) 123 (62) 84 (89) 58 (111) 25 (132) 17 (149)Number at risk (number censored)Chemotherapy group 393 (0) 249 (0) 199 (5) 153 (27) 112 (61) 81 (83) 55 (107) 34 (127) 22 (138)Chemoradiotherapy group 395 (0) 254 (1) 197 (4) 159 (21) 114 (56) 81 (80) 55 (101) 33 (122) 17 (138)图 3 OS和EFS Fig. 3 OS and EFS
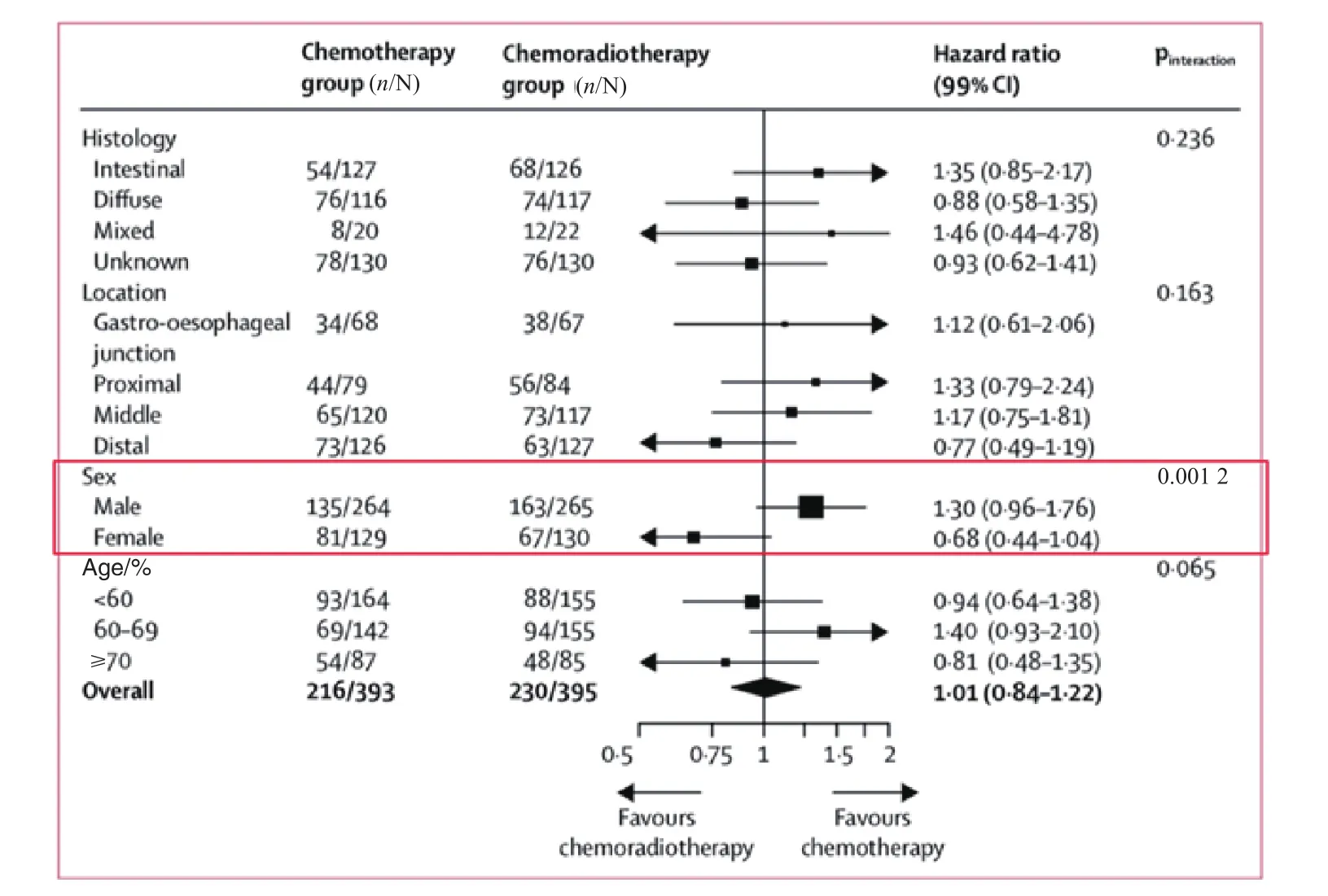
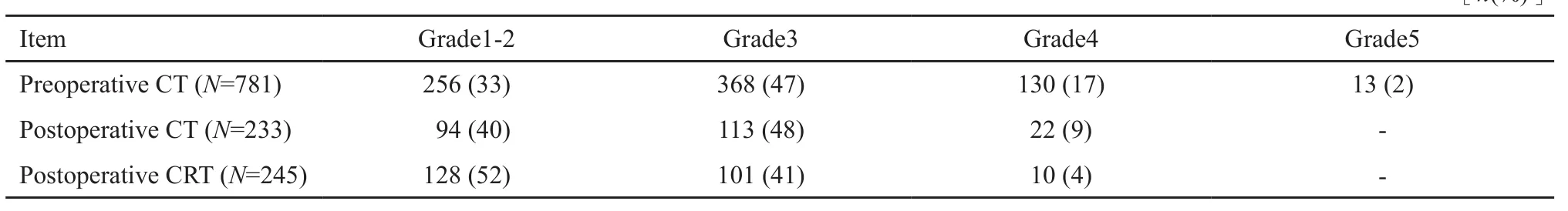
表 4 术前治疗和术后治疗的不良事件Tab. 4 Adverse events associated with preoperative and postoperative treatment[n(%)]
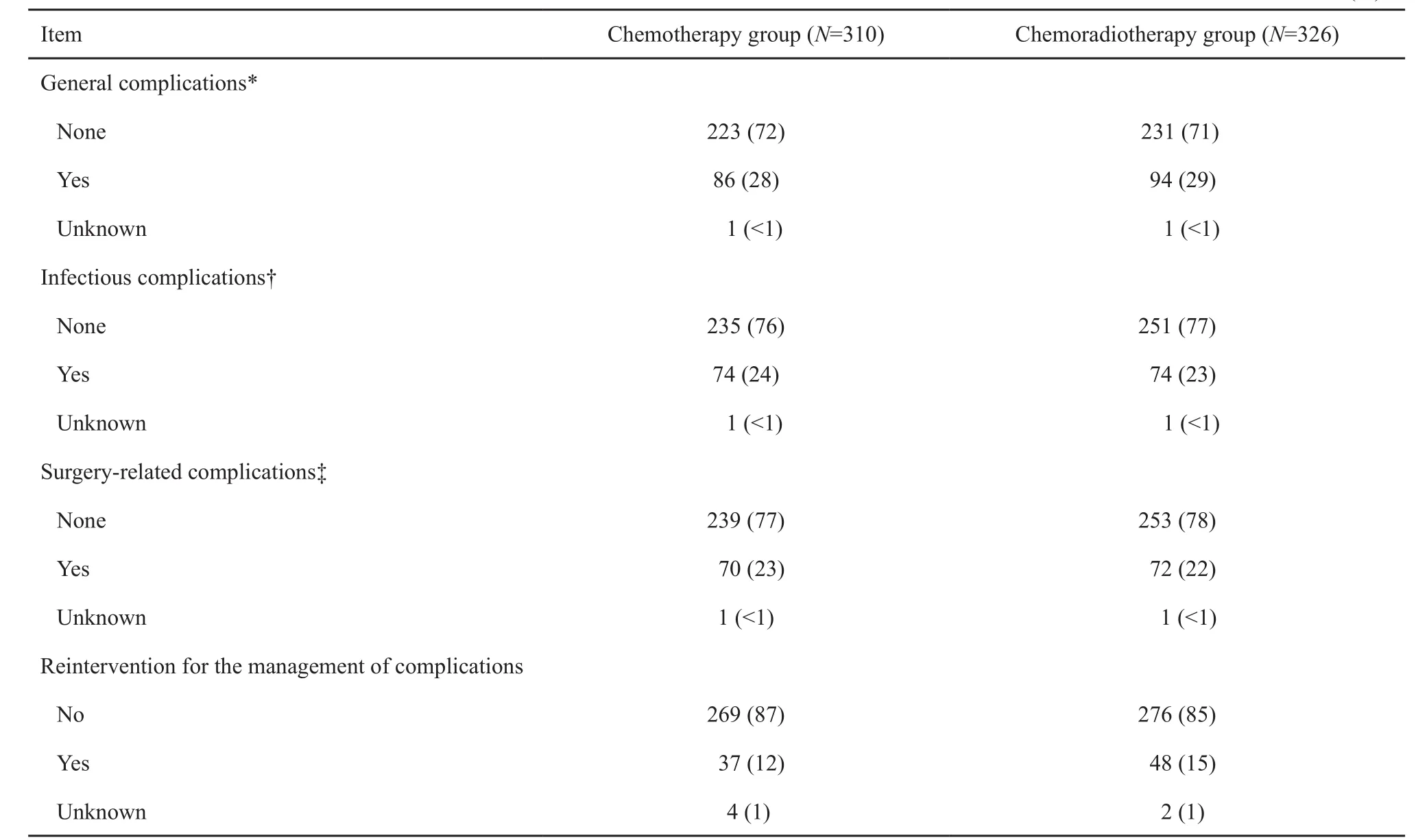
表 5 患者术后并发症情况Tab. 5 Surgical complications in patients[n(%)]
The complications listed in this table were recorded during hospital stay after surgery. *: Including cardiovascular, pulmonary, renal, and neurological complications. †: Including abdominal wound, abscess, and sepsis. ‡: Including bleeding, anastomotic leakage, abdominal wound dehiscence, ileus,and intestinal necrosis.
5 讨论与思考
该研究是首个头对头比较胃癌新辅助治疗后术后化放疗对比化疗的Ⅲ期临床研究,遗憾的是未能得到阳性结果。关于阴性结果的原因,不论从临床角度还是从统计学设计的角度考虑,其实存在着一些问题,值得研究者注意并在以后的研究中尽可能避免。
首先,在随机时间点的选择上,回顾本研究的方案,它是在治疗开始前就进行了随机,旨在比较两种治疗策略:一是围手术期化疗,二是术前化疗后手术加术后化放疗。值得注意的是,这两种策略的术前化疗是相同的,手术方式要求也是一样的,在术后辅助治疗阶段才得以区分,而前期相同治疗占据了很长的时间。尽管研究者的设计初衷是还原临床实际,并了解整个治疗策略在实践中的可行性,同时可尽量避免选择偏移。但是,实际结果显示,16%的患者因为术前化疗未完成而不符合治疗策略,18%的患者未达到要求的根治术,术后19%的患者无术后化疗。这意味着,超过50%的患者未能坚持到关键的实际差异来源的术后辅助治疗阶段,因此该研究最终符合方案(per-protocol set,PP)集只有参与随机的48%的患者。一般认为优效性设计中ITT集结果比PP集更保守可靠,然而该研究中,ITT集代表性严重受损,PP集结果也不能忽视,遗憾的是本研究并未报道PP集结果。换个角度思考,整个治疗策略的比较实质上是辅助治疗方式的比较,新辅助化疗和手术相当于富集设计的患者筛选入组期,当前方案相当于缩减了有效样本量,降低了检验效能。此外,即使是接受术后化疗或化放疗的阶段,也存在治疗不足的情况(13%)。因此,真正的临床实际是并非所有患者都适用于辅助CT/CRT,随机时间点建议选择真正体现组间差异的术后辅助治疗开始时间。
其次,众所周知,手术方式对患者的预后影响较大,在组间应该保持平衡。但是,本研究中两组各有11%和13%的患者未能按要求完成高质量淋巴结清扫,对于这部分患者的治疗尤其值得关注,但研究中并未提供相关结果报道。基于当前研究设计,无法实现对手术方式的分层随机,若随机时间点合理,则可有效避免该问题的影响。
第三,术后化疗组中有一部分患者未达到R0切除,这部分患者未行术后放疗是否有悖伦理?尽管目前尚无肯定证据规定接受新辅助治疗后切缘阳性患者应该接受术后放疗,但是对于未行术前治疗的R1切除患者,辅助放疗是明确可以获益的。
第四,根据ARTIST研究结果,在高质量手术(D2)后,亚组分析提示淋巴结阳性患者辅助化放疗相比辅助化疗有明显获益。基于该研究结果,目前的临床实践更倾向于对术后淋巴结阳性的患者行辅助放疗。本研究中,这一问题同样值得探讨,术后淋巴结阳性的患者是否有必要行放疗?尤其在已接受新辅助化疗的情况下。但由于随机时间点的问题,完成随机分组时无法准确知道患者的淋巴结状态,因此无法前瞻性地解答该疑问,有待研究者的后续探索性分析。
例如,医院作为研究预设的亚组之一,研究者专门分析了医院手术量与手术质量之间的关系。结果显示,手术量大的医院手术依从性也相对较高;对于要求淋巴结清扫15个以上的手术质量指标,手术量大的医院也是更好的。此外,医院手术量的高低对患者预后也存在一定的影响。分析纳入CRITICS研究中494例手术患者,医院规模按年手术量分组,结果提示,2007—2015年入组期间,前期以小中心(年手术量<20)的患者为主,后期越来越多来自大中心(年手术量≥20)的患者入组。不同规模医院手术的患者OS存在显著差异,无病生存期(disease-free survival,DFS)也显示出一定的差异趋势。因此,医院规模与手术质量非常相关,可能影响未达到D1+手术和R0切除的手术比例,最终均对预后产生影响。
综上所述,CRITICS研究虽然是一个阴性结果,但对今后探索胃癌的最佳治疗策略仍有借鉴意义,后续CRITICS Ⅱ研究的结果令人期待。

