不同HLB值非离子型表面活性剂与粘蛋白的相互作用
程欢,唐传核
(华南理工大学食品科学与工程学院,广东广州 510640)
粘蛋白(mucins)是一类高度水化的糖蛋白,其分子的核心蛋白链,由中间的糖基化区域和两端的非糖基化区域组成[1]。粘蛋白是粘膜层的主要成分,具有保护、润滑人体内各种管腔,细胞信号传导及转录调控,吸收及包裹微生物和致病颗粒,以及其他防御功能[2~4]。研究表明,一些疾病的发生与粘蛋白有关。2017年 8月 16日,由德国马克斯普朗克研究所的Thomas F. Meyer博士和美国斯坦福大学医学院的研究人员合作,在《Nature》上发文指出:幽门螺杆菌可能通过诱导胃粘膜下方干细胞的过度增殖,导致受感染患者的粘膜的特征性增厚,进而诱导胃癌的发生[5]。由此可见,粘蛋白对人体的健康有着至关重要的作用。
口腔是消化道的始端,和胃肠道同属消化器官,胃肠道是口腔环境在消化系统中的一种延伸,而口腔粘膜与胃粘膜有相似的组织学特征。近年,人体口腔唾液对口腔感官知觉方面的影响,尤其是摄入的食品组分与唾液蛋白相互作用产生涩味的口感[6~9],引起了食品科学家的兴趣,也引发研究者对唾液及其成分与食品组分相互作用的研究。大量研究表明,食品中的组分,如多酚,可导致口腔产生涩味[8~11];乳清蛋白可引起口腔干燥[12~14];而乳清蛋白稳定的乳液使口腔产生乳脂状,脂肪和厚度的感觉[15];溶菌酶稳定的乳液,则能导致口腔产生干燥,粗糙,和涩味口感[15,16]。基于这些事实可知,唾液是食品口腔加工的必需成分,对感官知觉有着复杂的影响。在设计新产品时不仅要考虑产品的货架期,也要考虑产品组分与唾液作用后的感官体验。
Span在食品中广泛使用,尤其在饮料中,如植物蛋白饮料,调制乳等,常常用作乳化剂。Span安全、无毒、刺激性小[17]、且受酸碱盐的影响较小、优良乳化性能以及其它方面的特殊性能很好地满足了不同行业的生产和需求,因而成为日化及食品领域广受关注的表面活性剂类型[18]。但目前,人们对于食品中的组分Span系列非离子型表面活性剂的认识还不够深入,缺乏对 Span系列非离子型表面活性剂与粘蛋白的相互作用及其对口腔感官影响的系统研究及报道。基于以上考虑,本研究的主要目标是探究常用的Span系列非离子型表面活性剂与粘蛋白相互作用的可能性,以期为食品工业开发新型的具备良好口感并有利健康的饮料给出一些建议。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
猪胃粘蛋白(type Ⅱ,结合唾液酸约为1%,)购于美国Sigma-Aldrich公司;非离子表面活性剂、山梨醇酐月桂酸酯(Span-20)、山梨糖醇酐单棕榈酸酯(Span-40)、山梨醇酐单硬脂酸酯(Span-60)、山梨醇酐单油酸酯(Span-80)均由广州润华化工有限公司赠予;尿素,广东光华科技股份有限公司;十二烷基硫酸钠,上海伯奥生物技术有限公司;其它化学试剂均为国产分析纯。
1.1.2 仪器与设备
Scientz-IID超声波细胞粉碎机,宁波新芝生物科技有限公司;HH-4数显恒温振荡器,常州澳华仪器有限公司;哈希2100N台式浊度仪,美国HACH公司;UV754N紫外可见分光光度计,上海精科仪器有限公司;PHS-3C精密pH计,上海雷磁仪器厂;78-1磁力搅拌器,常州澳华仪器有限公司;BCD-228UTM冰箱,合肥美的电冰箱有限公司;ME104E分析天平,瑞士METTLER TOLEDO公司;Nanoscope 3A原子力显微镜,美国Veeco公司;Zetasizer Nano ZS激光纳米粒度仪,英国Malvern公司。
1.2 实验方法
1.2.1 人工唾液的制备
称取一定量的粘蛋白(0.25%,m/V)分散于 pH为7的人工唾液中[19],由于本实验不涉及淀粉的消化,故未添加α-淀粉酶。采用磁力搅拌2 h促进溶解,用1 mol/L NaOH或HCl调节pH至7.0,加入两滴叠氮化钠溶液(0.02%,m/V)抑制微生物生长,然后在4 ℃放置过夜使粘蛋白充分水化。贮藏之后在8000 r/min的转速下离心10 min去除不溶杂质,置于4 ℃冰箱中备用。
1.2.2 非离子型表面活性剂的制备
Span-20溶液:称取一定量的Span-20分散于pH为7的5 mM磷酸缓冲液中,配制浓度为0.1%(m/V),将置于烧杯中的Span-20溶液放入超声波细胞粉碎机中,在10 mm探头、285 W条件下超声处理20 min,直至充分分散,待Span-20溶液在冰浴中恢复至室温后,将其稀释为不同浓度(0.1%,0.08%,0.06%,0.05%,0.04%,0.03%,0.02%和0.01%,m/V),搅拌待用;
Span-40、Span-60和Span-80溶液的制备方法同上,并稀释为不同浓度备用。
1.2.3 粘蛋白-非离子型表面活性剂复合物的制备
将一系列不同浓度的Span-20、Span-40、Span-60和Span-80溶液(各自浓度均为0.1%,0.08%,0.06%,0.05%,0.04%,0.03%,0.02%和 0.01%,m/V),在37 ℃,振荡频率为150 r/min的摇床中,与等体积的人工唾液(含0.25%(m/V)粘蛋白)混合,并在摇床中振荡25 min,充分反应后的混合液于室温保存待测。
1.2.4 粘蛋白-非离子型表面活性剂复合物浊度的测定
分别取5 mL反应后的混合液于试管中,用哈希2100 N台式浊度仪测其浊度值(NTU),记为NTUmixture。其中混合物的对照组有两个,其一是人工唾液(含0.25%(m/V)粘蛋白)与等体积的5 mM磷酸缓冲液混合,其二是非离子型表面活性剂溶液与等体积的人工唾液(不含粘蛋白)混合。两对照组在相同的条件下反应后,测其浊度值分别记为NTUmucin,NTUsurfactant。
最终复合物的浊度值计算:
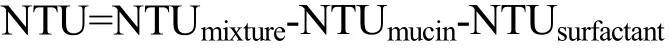
所有测量值都是在室温条件下至少测定两次,报告结果为超过三次读数的平均值。
1.2.5 粘蛋白-非离子型表面活性剂复合物粒度的测定
粘蛋白-非离子型表面活性剂复合物的粒度通过动态光散射(DLS)马尔文电位-纳米粒度仪(Zetasizer Nano ZS)来测定。测定复合物粒径之前,含粘蛋白的人工唾液需要过膜(0.45 μm)处理,磷酸缓冲液也需要过膜(0.22 μm)处理。所有测量值都是在室温条件下至少测定两次,报告结果为超过三次读数的平均值。
1.2.6 原子力显微镜(AFM)测量
原子力显微镜用以观察蛋白颗粒的形貌、大小等信息。AFM观察采用轻敲模式(Tapping Mode)成像,以及装有-“G”型扫描探头并由Nanoscope Ⅲa控制器驱动的Dimension 3000显微镜。样品用相同的缓冲液稀释至大约50 μg/mL,涡旋10 s充分混匀后取10 μL稀释样品滴在新鲜剥离的云母片表面(8×8 mm),室温下静置过夜自然风干。扫描条件:频率300 kHz,速率1 Hz。使用NanoScope Analysis Version 1.40软件分析获得的图片。
1.2.7 粘蛋白-非离子型表面活性剂复合物内聚力的测定
粘蛋白-非离子型表面活性剂复合物用变性剂(6 mol/L urea、0.5% SDS)处理表征其相互作用的内聚力,所用粘蛋白浓度为0.25%(m/V),表面活性剂浓度0.1%(m/V);分别取4.0 mL混合物与4.0 mL等体积的变性剂混合,涡旋30 s混匀后静置60 min,测定在λ=600 nm处的吸光度,以纯水作为空白对照。
1.2.8 数据分析
采用Origin 8.6对数据进行画图,所有数据均采用平均值(Mean)±标准差(SD)表示。采用SPSS 13.0软件进行一维方差分析(one-way ANOVA),以及置信区间为95%的显著性分析,显著性分析通过Tukey的多范围检验,显著性水平被认为是p<0.05。所有图表中采用相同的字母表示在p<0.05水平差异不显著,不同的字母表示差异显著。
2 结果与讨论
2.1 粘蛋白-非离子型表面活性剂复合物浊度的测定
由图1可知,粘蛋白与特定的非离子型表面活性剂(Span-20、Span-40、Span-60或Span-80)形成复合物的浊度值,均随着相应非离子型表面活性剂浓度的增加而增大,其中粘蛋白-Span-60复合物浊度增大显著。在选定的浓度下,不同 HLB值的非离子型表面活性剂与粘蛋白形成复合物的浊度不同。Span-80,Span-60,Span-40和Span-20的HLB值分别为4.3、4.7、6.5、8.6。在浓度一定时,随着HLB值的减小,Span-20,Span-40和Span-60与粘蛋白形成的复合物浊度显著增加。Span-80的HLB值低于Span-60,在相同浓度下,粘蛋白-Span-80的浊度值却并明显低于粘蛋白-Span-60的浊度值。并且随着浓度的增大,粘蛋白-Span-80的浊度值变化较小,而粘蛋白-Span-60的浊度值变化显著。粘蛋白分子既具有糖基化的亲水区又有疏水区,同样属于两亲性分子,而疏水作用表现显著[20]。而非离子型表面活性剂的疏水尾链主要影响非离子型表面活性剂与粘蛋白之间的疏水作用[21]。可能是由于Span-80极强的疏水性使得粘蛋白结构重叠的程度更大,因此当表面活性剂浓度增加时浊度变化较小。
由此推测,非离子型表面活性剂(Span-20、Span-40、Span-60或Span-80)与粘蛋白之间存在不同程度的相互作用,才导致相应的复合物溶液浊度值发生不同程度的变化。

图1 不同浓度和HLB值的非离子型表面活性剂与粘蛋白形成的复合物的浊度Fig.1 The turbidity of complexes which were formed between mucin and nonionic surfactants

图2 粘蛋白-非离子型表面活性剂复合物平均粒径随变化Fig.2 Average particle size of mucin-nonionic surfactant complex varies at different nonionic surfactant concentrations
2.2 粘蛋白-非离子型表面活性剂复合物粒度的测定
不加入非离子型表面活性剂时,粘蛋白平均粒径约为 88 nm。Thongborisute等[22]人所用猪胃粘蛋白(type Ⅱ)的平均粒径为90~100 nm,与本实验的结果一致。由图2知,在一定浓度下,从Span-20,Span-40到Span-60,随着HLB值的减小,粘蛋白与非离子型表面活性剂形成的复合物的平均粒径呈现依次增大的趋势,其中粘蛋白-Span-60复合物的平均粒径变化显著。即Span-20、Span-40和Span-60与粘蛋白的相互作用强度与其HLB值呈负相关关系。随着Span-80浓度从0.01%增加到0.1%,粘蛋白-Span-80复合物的平均粒径变化较小,其粒径分布图也呈现了粘蛋白颗粒减小的粒径分布。可能是由于加入Span-80后,使粘蛋白由松散的颗粒结构逐渐变为紧凑的颗粒。类似的报道有Nikogerorgos等人报道了小分子量的聚乙烯亚胺导致粘蛋白从松散的结构变得更为紧凑[23]。还有Jöbstl等提出多酚与松散的蛋白结合,导致蛋白质变小,其结构变得更加紧凑,更趋近于球形[9]。
2.3 不同非离子型表面活性剂诱导粘蛋白聚集颗粒的AFM微观形态

图3 粘蛋白与不同非离子型表面活性剂相互作用后的原子力图Fig.3 AFM images of various nonionic surfactants
为进一步验证不同非离子型表面活性剂与粘蛋白相互作用,导致粘蛋白粒度分布不同的结果,对不同非离子型表面活性剂作用后的粘蛋白进行AFM 微观形态表征。图3中展示了添加不同非离子型表面活性剂(Span-20、Span-40、Span-60和Span-80),粘蛋白及其聚集体原子力微观图。从图3中可以看出,在依次添加Span-20、Span-40和Span-60后,粘蛋白颗粒的高度均展现不同程度的增大,分别为3.1~15.8 nm,3.1~19.2 nm,3.1~35.2 nm;即随着 HLB 值的减小(Span-20、Span-40、Span-60),粘蛋白颗粒的簇聚情况加强。这与前面粒度结果相吻合,即 Span-20、Span-40和 Span-60与粘蛋白的相互作用强度与其HLB值呈负相关关系。Jöbstl等提出多酚与松散的蛋白结合,导致蛋白质变小,其结构变得更加紧凑,更趋近于球形[9]。而在添加 Span-80后,粘蛋白颗粒的高度从3.1 nm降低为1.5 nm;这是由于Span-80具有超强的疏水性,Span-80与粘蛋白接触,从而诱导粘蛋白结构展开,内部疏水基团暴露出来并与 Span-80通过疏水相互作用紧密结合,进而形成更大的疏水核心,导致粘蛋白重叠时形成更为紧凑,不规则的结构。这些颗粒聚集物在吸附到界面后可能由于内部作用力的强弱而发生不同的变化,从而对其乳液的性质产生影响。
2.4 内聚力的测定

图4 粘蛋白-非离子型表面活性剂复合物在不同蛋白变性剂溶液处理后的浊度。Fig.4 Influence of various protein-perturbing solvents on the turbidity of mucin-nonionic surfactant complex
为了明确维持粘蛋白-表面活性剂复合物颗粒内部作用力,通过在不同的蛋白变性剂存在条件下颗粒分散液的浊度来反映。实验所采用的变性剂有6 mol/L urea、0.5% SDS以及它们同时存在的组合,一般情况下认为urea和SDS分别能够破坏氢键、疏水相互作用[24,25]。首先由图4能够看到单独的6 mol/L urea和0.5% SDS与粘蛋白-非离子型表面活性剂复合物等体积混合之后,粘蛋白-非离子型表面活性剂复合物的浊度均呈现不同程度的下降。而在两种变性剂共同作用于粘蛋白-表面活性剂复合物时,粘蛋白-表面活性剂复合物的浊度均显著降低。
粘蛋白分子具有独特结构。其一,粘蛋白分子的瓶刷状寡糖侧链含有大量羟基,能通过氢键作用形成水合层;其二,粘蛋白分子既具有糖基化的亲水区又有疏水区,属于两亲性分子,而疏水作用表现显著[20]。由此可知,粘蛋白分子能通过氢键作用和疏水相互作用与非离子型表面活性剂发生作用,进而对粘蛋白的聚集体大小产生影响。因此,可以合理的推测粘蛋白与Span-20、Span-40、Span-60或Span-80形成复合物的作用力包含疏水相互作用和氢键。
3 结论
3.1 浊度测定结果表明,在浓度一定时,粘蛋白-Span复合物的浊度随着 HLB值从 Span-20、Span-40到Span-60的减小而显著增加;随着浓度的增加,粘蛋白-Span-60复合物浊度显著增大,而粘蛋白-Span-80复合物浊度变化较小。粒度测定结果表明,在浓度一定时,粘蛋白-Span复合物平均粒径随着 HLB值从Span-20、Span-40到Span-60的减小而逐渐增大,其中粘蛋白-Span-60复合物的平均粒径变化显著,粘蛋白-Span-80复合物平均粒径变化较小。即 Span-20、Span-40和 Span-60与粘蛋白形成复合物的浊度和平均粒径均与其HLB值呈负相关关系。
3.2 对于Span-20、Span-40和Span-60,其诱导粘蛋白形成聚集体颗粒的大小也与其 HLB值呈负相关关系,这均归因于粘蛋白与Span系列非离子型表面活性剂间的非共价作用力(氢键和疏水相互作用)。HLB依次减小的Span-20、Span-40和Span-60,表面活性剂的脂肪链长度依次增大。而Span-80与Span-60脂肪链长度相同,但是Span-80脂肪链中含有不饱和的碳碳双键,使得 Span-80具有超强的疏水性。因而Span-80与粘蛋白接触,诱导粘蛋白结构展开而使其内部疏水基团暴露出来,并通过疏水相互作用紧密结合,进而形成更大的疏水核心,导致粘蛋白重叠时形成更为紧凑,不规则的结构。

