不同18α和18β-甘草酸配比对P-gp转运功能和大鼠CYP3A酶活性的影响
霍小位,王士中,孟祥波,柳亚飞,赵燕燕
(1.河北大学药学院,河北省药物质量分析控制重点实验室,河北保定 071002)(2.河北祁一堂药业有限公司,河北保定 071002)
甘草(Glycyrrhiza uralensisFisch)是一种豆科植物,具有独特的甜味,是常用的食品添加剂。此外,甘草的药用价值极高,具有清热解毒、调和诸药之功效,是现代临床上最为常用的中草药之一[1]。甘草酸是甘草的主要活性成分,其具有两种差向异构体形式,即 18α-甘草酸(18α-GL)和18β-甘草酸(18β-GL)[2]。两种甘草酸异构体理化性质相似,但在药效和不良反应方面却有很大差异。这两种异构体的水解产物同样在药效学以及药动学等诸多方面存在着较大差异。因此,需要进一步对18α-GL和18β-GL这两种异构体展开深入研究以指导临床用药。
研究发现,药物在生物体内的吸收过程和代谢过程主要由P-糖蛋白(P-gp)和细胞色素CYP 450酶系调节,药物的转运过程则主要由P-gp介导[3~5]。P-gp是细胞中的转运功能蛋白,它能够ATP依赖性地将细胞中的药物排出细胞外。CYP450酶可以将药物通过C-羟基化等反应代谢排出体外,故能够减小药物对人体的毒副作用,保护肝脏等器官。由于对临床药物的代谢作用广泛,CYP3A成为细胞色素CYP 450家族中最主要的研究对象之一。P-gp和CYP3A酶均广泛存在于肝脏和肠道中,许多药物可以经过PXR和CAR信号通路影响P-gp和CYP3A酶的表达,这些药物便可以作为 P-gp和CYP3A酶的诱导剂或抑制剂[6~8],从而影响药物本身的代谢和转运过程。在本研究中我们考察了不同浓度、不同配比的18α-GL和18β-GL对P-gp转运功能的影响,以及对CYP3A酶活性的影响,系统探讨不同浓度、不同配比的甘草酸差向异构体在生物体内发挥药理作用的最佳组合,这对于药物相互作用研究和指导临床合理用药具有十分重要的意义。
1 材料与方法
1.1 材料
1.1.1 细胞株与动物
Caco-2细胞购于武汉大学的培养物储藏中心,Wistar大鼠,体重(200±20)g,购自河北省实验动物中心,合格证号为SCXK(冀)2013-1-003。
1.1.2 药物与试剂
Eagle’s minimum essential medium 培养基、磷酸盐缓冲溶液及胰蛋白酶购于美国HyClone公司;胎牛血清、二甲基亚砜购于Sigma-Aldrich公司;荧光黄购于天津致远化学试剂有限公司;18α-GL对照品(18α,20β-glycyrrhizic acid)和 18β-GL 对照品(18β,20β-glycyrrhizinic acid)均购于ALPS制药,批号分别为10B001S和05C11S;睾酮购于德国Dr.Ehrenstorfer公司,批号:10519;6β-羟基睾酮购于美国 Cerilliant公司,批号:FN04141413;罗丹明123、还原型辅酶II、二硫基赤藓醇、BCA蛋白检测试剂盒均购自北京索莱宝生物科技有限公司。
1.1.3 器材及仪器
超净工作台为中国安泰公司产品;高压灭菌锅为日本三洋公司产品;酶标仪为美国Biotek公司产品;倒置相差显微镜为日本 Olympus公司产品;MCO-18AIC恒温培养箱和LC-20ATVP高效液相色谱仪为日本岛津公司产品;SPD-20Avp紫外-可见检测器和 LabSolutions工作站为美国 Bio-Tek公司产品;transwell 6孔细胞培养板为美国康宁公司产品。
1.2 方法
1.2.1 Caco-2细胞单层模型的建立及紧密性考察
将transwell孔板放在紫外灯下照射24 h。在孔板的底层加入1.5 mL不含血清的MEM培养液,37 ℃培养2 h。在孔板的上层加入不含血清的MEM培养液0.5 mL继续培养2 h。细胞在培养瓶中生长到一定程度后(80%~90%)消化,接种到 Transwell孔板的上层(AP侧)。细胞接种密度为 2×105个/mL。孔板下层(BL侧)加入1.5 mL培养液。在接种后的第1~7 d,每天换液,第8~21 d,隔天换液。自第3 d起,隔日测定一次跨膜电阻值,并计算细胞的跨膜电阻(TEER)。每个时间点测3次,取平均值,当TEER值大于 500 Ω/cm2时说明紧密的单层细胞膜已经生成。跨膜电阻的计算公式如下:
TEER=(R1-R0)×A
注:其中R1为接种细胞孔测量的电阻值;R0为空白孔测量的电阻值;A为有效膜面积。
1.2.2 Caco-2细胞单层模型通透性考察及表观渗透系数的计算
将细胞接种到上层(AP侧),培养到21 d,弃掉培养液,用PBS将细胞洗涤2次,吸弃PBS,在AP侧加入3 μmol/L荧光黄0.5 mL,在下层(BL侧)加入1.5 mL的PBS,放入培养箱中培养2 h,吸取BL侧溶液200 μL,检测其荧光强度并根据荧光黄的标准曲线计算荧光黄的浓度。荧光黄标准曲线的制备:将已制备的荧光黄母液用PBS稀释成0.1~3.5 μmol/L的梯度浓度,在激发波长EX=427 nm,发射波长Em=536 nm条件下,检测荧光黄的荧光强度。以荧光黄浓度为x轴,以荧光强度为y轴,绘制荧光黄的标准曲线。计算各孔荧光黄表观渗透系数Papp,考察细胞模型的通透性和完整性。当Papp<0.5×10-6cm/s时,说明细胞模型形成了完整的单层细胞膜。计算公式如下:
Papp=dQ/(dt×A×C0)
注:其中dQ表示在dt单位时间内药物的转运量;A表示形成的单层细胞模型的膜表面积;C0表示在供给池中加入的药物的初始浓度。
1.2.3 罗丹明123跨膜转运实验
将培养至第21 d的细胞用PBS洗涤后进行药物干预。阴性对照组加入空白完全培养基,阳性对照组加入含P-gp抑制剂VER的培养基,药物组加入含不同配比药物的培养基,放入培养箱中培养72 h。吸弃培养液,在AP侧加入PBS,BL侧加入PBS,平衡30 min。将AP侧和BL侧的PBS小心吸弃。BL侧到AP侧的转运:BL侧加1.5 mL罗丹明123工作液,作为供给池,AP侧加0.5 mL PBS作为接收池。将孔板放置在37 ℃恒温水浴中,60 r/min转速,分别在15、30、60、90、120 min时从各接收池吸取溶液200 μL,并补足接收池体积。检测接收池罗丹明123溶液的荧光强度,代入其溶液标准曲线,求其溶液浓度(μmol/L),由其溶液浓度计算转运量。药物转运量dQ=药物浓度×接收池溶液体积。罗丹明123转运量与转运膜面积的比值即为罗丹明123的单位面积累积转运量(mol/cm2)。单位面积累积转运量=药物转运量dQ/转运膜表面积A。根据Rho-123的转运量可求得表观渗透系数Papp,进而求得它在细胞中的外排率。外排率的计算公式如下:
ER=Papp B-A/Papp A-B
注:PappB-A为分泌表观渗透系数,PappA-B为吸收表观渗透系数。PappB-A与PappA-B的比值为其在细胞中的外排率(ER)。
1.2.4 肝微粒体制备及蛋白浓度测定
实验动物禁食24 h,自由给水,脱颈处死后迅速取出肝脏,用冰生理盐水冲洗,并用滤纸吸干水分。将肝脏剪至小块,用冰蔗糖溶液冲洗,直至洗出液呈淡黄色或无色,用滤纸将肝脏表层水分吸干,称重。用剪刀将肝小块剪碎,加入 4倍体积(V/m)的蔗糖溶液,冰浴匀浆20 s,匀浆液于10240 r/min离心15 min。取上清液,加入88 mmol/L CaCl2(0.1 mL/mL),冰浴振摇5 min,于15110 r/min离心15 min。弃上清液,所得肝微粒体沉淀加其重量2倍的Tris-HCl(pH 7.4)缓冲液混悬均匀,分装,-70 ℃保存备用。制得的肝微粒用BCA蛋白试剂盒测定其蛋白浓度。以上操作均在冰上进行。
1.2.5 温孵实验及样品处理方法
各组肝微粒体体系均加入精密量取的50 μL睾酮标准品溶液和一定量不同浓度、不同配比的 18α、18β-GL溶液或相同体积溶剂后,缓慢的通N2吹干,加入甲醇-水(1:1,V/V)50 μL复溶,加入适量肝微粒体使其终浓度为1 mg/mL,以磷酸盐缓冲溶液(pH 7.4)补足体积,温孵体系终体积为500 μL。置于恒温振荡器中,37 ℃条件下预温孵5 min后在温孵体系中加入50 μL NADPH,使其终浓度为1 mmol/L,继续温孵30 min。已孵育完样品置于-20 ℃冰箱中20 min终止反应,于15110 r/min离心15 min,取上清液过已活化好的固相萃取小柱,以甲醇作为洗脱剂,将洗脱液在37 ℃水浴中缓慢的通N2吹干,最后用200 μL甲醇-水(1:1,V/V)对残渣复溶,0.45 μm滤膜过滤,上机分析。
1.2.6 不同浓度 18α、18β-GL作用下 CYP3A酶活性测定
肝微粒体温孵体系分为空白对照组和药物组。药物组加入不同浓度 18α、18β-GL(浓度分别设为 1、10、50、100、200、300、400 μg/mL)100 μL,空白对照组加入100 μL药物溶剂甲醇,各组平行三管。测定不同浓度18α、18β-GL作用下睾酮的代谢产物6β-羟基睾酮的生成量。计算各实验组CYP3A酶的相对活性(%)。公式如下:
酶相对活性(%)=药物组代谢产物生成量/空白组代谢产物生成量×100%
以空白对照组CYP3A酶活性为100%(用代谢产物 6β-羟基睾酮的生成量表示),当药物组 6β-羟基睾酮生成量多于空白对照组时,酶相对百分活性数值大于100%,药物对CYP3A酶表现为诱导作用;酶相对百分活性数值小于100%,则为抑制作用。
1.2.7 不同配比 18α、18β-GL作用下 CYP3A酶活性测定
肝微粒体温孵体系中依次加入甘草酸总浓度分别在 1、10、25、50、75、100 μg/mL 时 18α、18β-GL采取七个配比(10:0、8:2、6:4、5:5、4:6、2:8、0:10)的混合液,各组平行三管。测定不同18α、18β-GL总浓度分别在上述七个配比的作用下睾酮的代谢产物6β-羟基睾酮的生成量。分析同一浓度不同配比,以及同一配比不同浓度的18α、18β-GL对CYP3A酶活性的影响。
1.3 统计学处理
2 结果与讨论
2.1 Caco-2细胞单层模型的考察
如图1所示,随着培养天数延长,细胞模型的跨膜电阻值逐渐增大,当培养到21 d时,各孔跨膜电阻值均大于500 Ω/cm2,表明紧密的单层细胞已经形成。

图1 细胞模型跨膜电阻值Fig.1 The TEER of Caco-2 cells

表1 荧光黄表观渗透系数Table 1 The Papp of fluorescein in Caco-2 cells
荧光黄结果如表 1所示,当 Caco-2细胞在Transwell孔板上培养至21 d时,各孔渗透系数均小于0.5×10-6cm/s,表明完整的单层细胞膜模型已经形成。
2.2 不同配比18α、18β-GL单体对P-gp转运功能的影响
罗丹明123是评价P-gp功能的探针药物,常通过考察罗丹明123在细胞中的外排率来研究药物对P-gp功能的影响。根据课题组前期的研究基础,本实验选择了10 µmol/L作为药物总浓度。通过建立Caco-2细胞单层模型,测定转运液中罗丹明123的荧光强度,考察在不同配比的药物干预下,罗丹明123在细胞内跨膜转运的情况。如表2所示,不同配比药物组的罗丹明123由BL侧到AP侧外排量随18β-GL的比例的增加而增大,当18α-GL与18β-GL配比小于5:5时,罗丹明123在BL到AP侧的累积转运量大于空白对照组,表现出对P-gp转运功能的诱导作用。当药物配比为0:10时,罗丹明123在Caco-2细胞中的外排率最大。当药物配比大于5:5时,BL侧到AP侧的累积转运量均小于空白对照组,表现出对P-gp转运功能的抑制作用,随着18α-GL比例的增加,罗丹明123在细胞中的外排率减小,18α-GL呈现出对P-gp功能的抑制作用。当药物配比为6:4时,对P-gp的抑制作用最强,几乎与阳性药维拉帕米(VER)的抑制作用相当。当P-gp外排功能被抑制后,药物在体内停留时间延长,药效增强,但同时应考虑药物毒性的增加。
表2 不同配比药物对罗丹明123不同时间由BL侧到AP侧累积转运量的影响Table 2 The effect of different concentration of drugs on the transport B-A of Rho123 (±s, n=3)
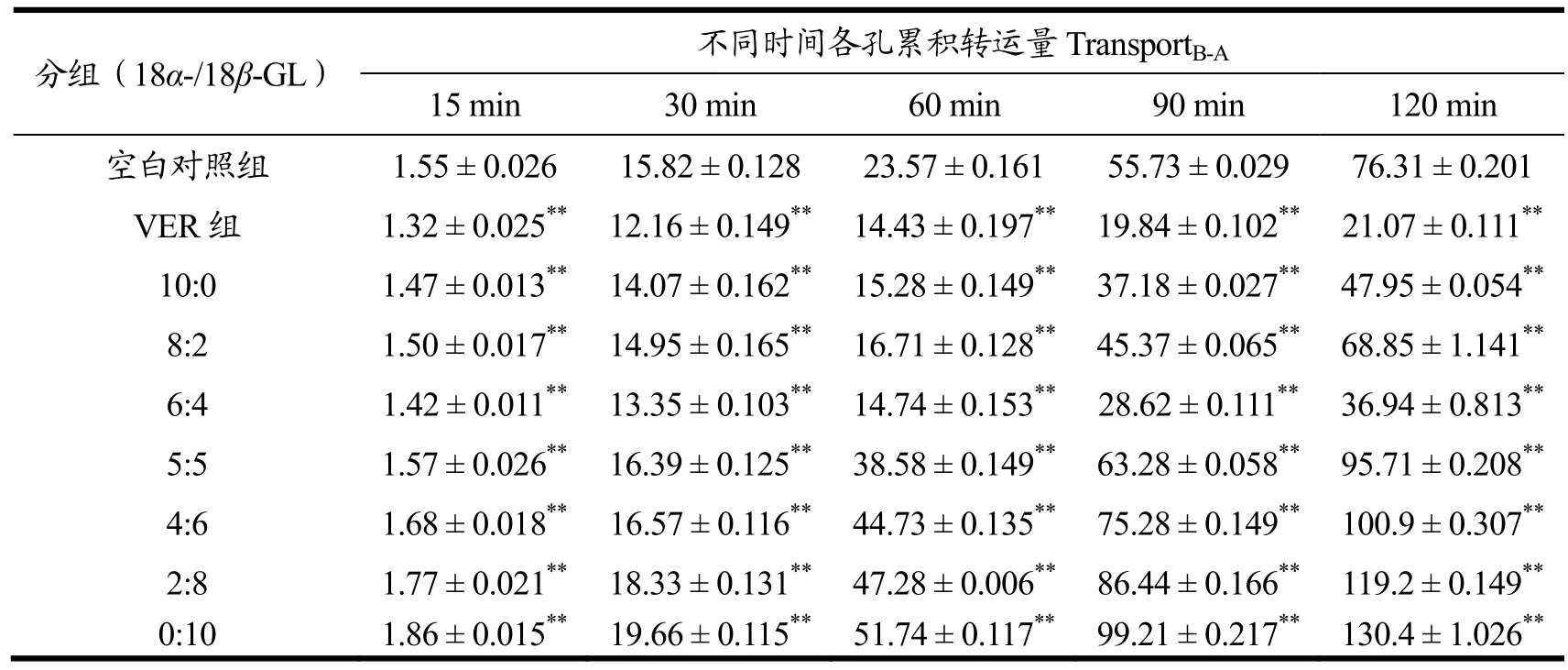
表2 不同配比药物对罗丹明123不同时间由BL侧到AP侧累积转运量的影响Table 2 The effect of different concentration of drugs on the transport B-A of Rho123 (±s, n=3)
注:与空白对照组比较,*p< 0.05,** p < 0.01。
分组(18α-/18β-GL) 不同时间各孔累积转运量TransportB-A 15 min 30 min 60 min 90 min 120 min空白对照组 1.55 ± 0.026 15.82 ± 0.128 23.57 ± 0.161 55.73 ± 0.029 76.31 ± 0.201 VER 组 1.32 ± 0.025** 12.16 ± 0.149** 14.43 ± 0.197** 19.84 ± 0.102** 21.07 ± 0.111**10:0 1.47 ± 0.013** 14.07 ± 0.162** 15.28 ± 0.149** 37.18 ± 0.027** 47.95 ± 0.054**8:2 1.50 ± 0.017** 14.95 ± 0.165** 16.71 ± 0.128** 45.37 ± 0.065** 68.85 ± 1.141**6:4 1.42 ± 0.011** 13.35 ± 0.103** 14.74 ± 0.153** 28.62 ± 0.111** 36.94 ± 0.813**5:5 1.57 ± 0.026** 16.39 ± 0.125** 38.58 ± 0.149** 63.28 ± 0.058** 95.71 ± 0.208**4:6 1.68 ± 0.018** 16.57 ± 0.116** 44.73 ± 0.135** 75.28 ± 0.149** 100.9 ± 0.307**2:8 1.77 ± 0.021** 18.33 ± 0.131** 47.28 ± 0.006** 86.44 ± 0.166** 119.2 ± 0.149**0:10 1.86 ± 0.015** 19.66 ± 0.115** 51.74 ± 0.117** 99.21 ± 0.217** 130.4 ± 1.026**
2.3 不同浓度18α、18β-GL单体对CYP3A酶活性影响
据报道[9],甘草酸对 CYP3A酶的活性有诱导作用。在本研究中,甘草酸的两种异构体18α、18β-GL单体对CYP3A酶活性的影响不同并且随其浓度的变化而变化,结果如图2所示。其中,18α-GL对CYP3A酶活性具有显著的抑制作用。研究表明18α-GL能够剂量依赖性的抑制CYP3A酶的蛋白表达水平[10],因此18α-GL对CYP3A酶活性的抑制作用可能与抑制蛋白表达相关。临床联合用药时,应考虑因18α-GL对CYP3A酶活性的抑制作用而导致的药物的代谢减慢,不良反应增加等。当18β-GL浓度在10~50 μg/mL范围内,6β-羟基睾酮生成量增多,表明对CYP3A酶活性有明显诱导作用;当浓度为1 μg/mL,或浓度大于100 μg/mL时,对CYP3A酶活性影响较小。王宇光[11]报道18β-GL在20~80 μg/mL的浓度范围内能够上调CYP3A酶的mRNA水平。因此,18β-GL浓度在10~50 μg/mL时对 CYP3A酶活性的诱导作用可能与上调CYP3A酶的mRNA水平相关。在临床联合用药时,应考虑因18β-GL对代谢酶的诱导作用所导致的合用药物的代谢加快,药效降低,以及耐药性的产生。

图2 不同浓度的18α、18β-GL单体对CYP3A酶活性影响Fig.2 Effect of different concentrations of 18α, 18β-GL on the activity of CYP3A
2.4 不同配比、不同浓度18α、18β-GL混合液对CYP3A酶活性影响
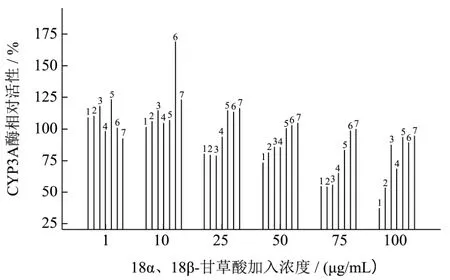
图3 相同浓度、不同配比的18α与18β-GL对CYP3A酶活性的影响Fig.3 Effect of different ratios of 18α, 18β-GL at the same concentration on the activity of CYP3A
实验考察了18α与18β-GL在同一浓度不同配比(10:0、8:2、6:4、5:5、4:6、2:8、0:10)以及同一配比不同浓度(1、10、50、100、200、300、400 μg/mL)对CYP3A酶活性的影响。实验结果如图3、图4所示,在总浓度固定时,不同配比18α、18β-GL对 CYP3A酶活性的影响不同。在甘草酸浓度为10 μg/mL,18α与18β-GL配比为2:8时,对CYP3A酶诱导作用最强。随着甘草酸总浓度增大、18α-GL比例增加,对CYP3A酶活性的抑制作用逐渐增强。当浓度为100 μg/mL、18α与18β-GL配比为10:0时,对CYP3A酶抑制作用最强。该研究结果可以对临床联合用药的安全性和有效性提供指导,但也存在一些不足和局限性,仍需在mRNA及蛋白表达水平来探究药物对酶活性影响。

图4 同一配比、不同浓度的18α与18β-GL对CYP3A酶活性的影响Fig.4 Effect of different concentrations of 18α, 18β-GL at the same ratio on the activity of CYP3A
3 结论
本研究考察了不同浓度配比的18α-GL和18β-GL对P-gp转运功能和对CYP3A酶活性的影响。实验结果显示,当18α-GL和18β-GL配比为6:4时,对罗丹明123的外排作用最弱,表明对P-gp的抑制作用最强;当18α-GL和18β-GL配比为0:10时,对罗丹明123的外排作用最强,表明对P-gp的诱导作用最强。此外,对 CYP3A酶活性的研究结果显示,18α-GL浓度在50~100 μg/mL范围内,对CYP3A酶活性有明显抑制作用。18β-GL浓度在10~50 μg/mL 范围内,对CYP3A酶活性有明显诱导作用。在甘草酸总浓度为10 μg/mL时,18α、18β-GL比例为2:8时,对CYP3A酶活性诱导作用最强,高于相同浓度的18β-GL单体。随着药物浓度及18α-GL比例增加,对CYP3A酶活性的抑制作用增强。当浓度为100 μg/mL、18α与18β-GL配比为10:0时,对CYP3A酶抑制作用最强。综上所述,不同配比的18α、18β-GL对P-gp转运功能及对CYP3A酶活性的影响不同。本实验将为研究18α、18β-GL的相互作用、指导临床用药安全及新药研发开拓新思路。

