镉胁迫下紫苏低分子量有机酸及镉含量变化
陈 燊, 洪 涌, 何小三, 韩永明, 彭 军, 朱静静, 肖清铁,2, 郑新宇,2, 林瑞余,2
(1.福建省农业生态过程与安全监控重点实验室/福建农林大学生命科学学院;2.福建农林大学作物生态与分子生理学福建省高校重点实验室,福建 福州 350002)
重金属污染土壤严重影响植物的正常生长发育和农产品安全,研究重金属的植物有效性、毒性及其代谢,将有助于揭示植物的重金属抗性机制.许多研究表明,有机酸在植物抗重金属毒害等逆境胁迫中起重要作用[1-3].有机酸是含有一个或多个羧基的化合物,广泛存在于植物体内和根系环境中,易与金属发生络合或螯合作用.不同有机酸与金属的络合能力大小与其分子结构有关,草酸、柠檬酸和酒石酸等的2个COOH直接相连或具有成对的OH/COOH依附在2个相邻的碳原子上,可与重金属形成五元或六元环状结构的螯合物,结构最为稳定[4].植物根系分泌的有机酸可结合土壤中的重金属,提高其重金属耐性[5].植物体内及根系分泌的有机酸可通过改变重金属的形态,影响重金属的行为,降低重金属的毒性,从而促进植物对重金属的吸收[6,7].进入植物体内的重金属可与储存在液泡中的有机酸螯合,转化成低毒或无毒的螯合态,从而增强了植物的抗性[8,9].Kupper et al[9]研究表明,在遏蓝菜(Thlaspicaerulescens)成熟及衰老的叶片中,积累的镉大部分以Cd-有机酸复合物的形式贮存在表皮细胞的液泡中.添加外源有机酸能提高蓖麻对镉的积累[10].孙瑞莲等认为龙葵叶片中的有机酸与其镉的超积累特性有关[11].可见,有机酸作为重金属元素的配体,不仅参与了重金属的吸收、运输、积累等过程,促进了植物对重金属的超积累,还能通过与进入植物体内的重金属结合,保护了细胞内重要蛋白及酶的活性,降低了重金属的毒害,有机酸可能是超积累植物耐重金属毒害的重要机制[12].唇形科植物紫苏(Perillafrutescens)是一种药食两用的作物,在中国具有悠久的栽培历史[13].近年来,一些研究发现,紫苏是一种有效的镉富集植物,但其镉富集机制尚不明确[14,15].为此,本研究从有机酸代谢的角度,探讨紫苏的镉耐性.
1 材料与方法
1.1 材料培养与取样
试验于2017年5—7月在福建农林大学生命科学学院玻璃温室进行.供试紫苏为尖叶紫苏,前研究表明具有较强的镉富集能力[15].
紫苏的培养采用水培法,营养液参照Hoagland配方[15].挑选饱满紫苏种子,用0.05% NaClO浸泡消毒30 min,再用蒸馏水冲洗干净,用0.5 mg·L-1赤霉素处理2 h后,播于温室试验田中,待幼苗长至10 cm(4片真叶)时,选择长势一致的幼苗,将其移至40 cm×30 cm×15 cm的塑料盆中,植株以塑料泡沫板和海绵固定, 每盆培养32株,并加入10 L完全营养液,营养液pH约5.5.紫苏水培7 d后,进行添加CdCl2溶液处理,镉处理浓度设0、2、5和10 mg·kg-14个水平,3 次重复,每周更换1次营养液,在处理的0、7、14和21 d分别取样,分析紫苏有机酸和镉含量,并测定其生物量.
各处理随机选择长势一致的植株6株,用去离子水淋洗根部3次,滤纸吸干表水后,按照根、茎和叶分别取样6份,每份样品鲜重0.2 g,用锡箔纸包好后,迅速置于液氮中冷冻,随后保存至-80 ℃冰箱中备用,各处理3次重复,该样品用于有机酸分析.在采集有机酸分析样品时,用同样的方法取样测定各处理紫苏根、茎和叶的鲜重,样品经烘干后,用于镉含量分析并计算紫苏生物量.
1.2 有机酸含量测定
有机酸含量测定采用HPLC法进行[16].取出各处理保存在-80 ℃冰箱紫苏根、茎、叶样品,立即加液氮研磨后,称取粉末0.1 g,加入10 mL 0.1%磷酸二氢钾溶液溶,浸泡4 h,超声萃取30 min,过滤,滤液3 500 r·min-1离心10 min,上清液过0.45 μm滤膜后,转移至棕色进样瓶内,4 ℃保存,用于有机酸分析.HPLC仪器型号为安捷伦1260,检测条件:色谱柱C18,等度洗脱,流动相为甲醇(5%)和0.1%磷酸二氢钾溶液(95%),流速0.8 mL·min-1,进样量10 μL,检测波长210 nm,柱温30 ℃.草酸、酒石酸、丙酮酸、抗坏血酸、乙酸、柠檬酸、富马酸、琥珀酸、丙酸标样为分析纯,采用外标法进行有机酸定量.
1.3 镉含量测定
镉含量测定采用原子吸收分光光度计法[17].测定鲜重后的紫苏根、茎、叶样品,经105 ℃杀青1 h后,72 ℃烘干,经粉碎、过60目筛后,备用.准确称取紫苏粉末0.5 g,加入混酸(HNO3∶HClO4=4∶1)15 mL,消化后用于镉含量测定.
1.4 数据处理
紫苏地上部及全株的镉含量是各处理根、茎、叶的加权平均值.数据分析采用Microsoft Excel 2007软件进行,结果以均值和标准差表示;统计分析、相关分析采用SPSS 19.0软件进行,不同处理间的差异显著性采用LSD法比较、Pearson双侧检测.
2 结果与分析
2.1 低分子量有机酸定量分析方法
在设定分析条件下,有机酸混合标样的HPLC图谱如图1所示.在12 min内9种低分子量各有机酸得到完全分离,重复性好,可用于定量检测.通过外标法建立的定量分析回归方程如下:
草酸:y=24.255 0x+4.360 1,r=0.999 7; 酒石酸:y=2.446 1x+0.861 2,r=0.999 5;丙酮酸:y=47.046 0x-5.417 4,r=0.999 3;抗坏血酸:y=12.455 0x-0.799 7,r=0.999 7;乙酸:y=2.614 7x+0.117 9,r=0.999 8;柠檬酸:y=1.655 8x-0.247 1,r=0.999 3;富马酸:y=190.790 0x-0.224 8,r=0.999 8;琥珀酸:y=0.805 9x+0.184 8,r=0.999 3;丙酸:y=0.823 7x+0.170 0,r=0.999 6.
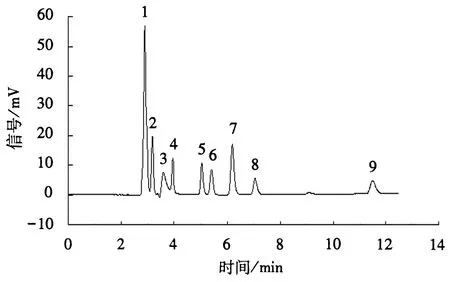
1.草酸;2.酒石酸;3.丙酮酸;4.抗坏血酸;5.乙酸;6.柠檬酸;7.富马酸;8.琥珀酸;9.丙酸.图1 混合标样溶液色谱图Fig.1 Mixed standard sample solution chromatogram
2.2 镉胁迫下紫苏各器官有机酸平均含量
结果表明,紫苏体内共检测到8种低分子量有机酸,包括草酸、酒石酸、丙酮酸、抗坏血酸、乙酸、柠檬酸、富马酸和琥珀酸(表1).不同处理条件下,紫苏有机酸总含量大小为:茎>叶>根.根部有机酸总浓度平均值为8 676.6 μg·g-1,其中草酸占75.74%,酒石酸1.72%,琥珀酸16.96%,柠檬酸3.25%,乙酸2.04%,抗坏血酸0.14%,丙酮酸0.10%,富马酸0.05%;茎部有机酸总浓度平均值为13 530.2 μg·g-1,草酸占64.46%,酒石酸2.67%,柠檬酸17.88%,琥珀酸12.17%,乙酸2.54%,抗坏血酸0.14%,丙酮酸0.10%,富马酸0.03%;叶片有机酸总浓度平均值为9 963.7 μg·g-1,草酸占69.72%,酒石酸1.57%,琥珀酸20.34%,柠檬酸4.88%,乙酸2.91%,抗坏血酸0.37%,丙酮酸0.17%,富马酸0.05%.可见,紫苏根茎叶中乙酸、抗坏血酸、丙酮酸和富马酸含量相对较低,草酸、酒石酸、琥珀酸、柠檬酸和乙酸含量占测定有机酸总量的95%以上,是主要的低分子量有机酸,在后续研究中主要讨论草酸、酒石酸、琥珀酸、柠檬酸和乙酸含量的动态.

表1 镉胁迫下紫苏不同器官的有机酸平均含量1)Table 1 The average content of organic acids in different organs of P. frutescens under cadmium stress (μg·g-1)
1)同一栏中不同小写字母表示不同器官间差异显著(P<0.05).
2.3 紫苏根部有机酸含量动态
由图2可见,随着处理时间的增加,有机酸含量总体呈上升趋势.从总酸含量看,在0、7、14、21 d无镉处理的总酸含量无显著差异,与2 mg·L-1镉处理间亦无显著差异,经5、10 mg·L-1镉处理后,总酸含量显著上升,且10 mg·L-1镉处理的高于5 mg·L-1镉处理.酒石酸、柠檬酸、草酸动态与总酸类似,其含量随处理时间和镉浓度的增加而升高,在处理14、21 d时,不同镉处理的有机酸含量均显著高于0 mg·L-1镉处理;乙酸含量总体呈先升后降趋势;0、2、5 mg·L-1镉处理的琥珀酸随时间增加而下降,10 mg·L-1镉处理的琥珀酸含量随培养时间增加呈先升后降趋势.
2.4 紫苏茎部有机酸含量动态
由图3可见,与根部相似,镉处理前(0 d)紫苏茎部各有机酸含量均无显著差异;随着处理时间的增加,有机酸含量上升.在14、21 d时,5、10 mg·L-1镉处理的总酸含量显著高于其余各处理的(图3).酒石酸、草酸含量随处理时间、镉浓度的增加而增大,0、2 mg·L-1镉处理的柠檬酸含量随时间增加显著下降,5、10 mg·L-1镉处理的柠檬酸含量随时间增加先降后升,5、10 mg·L-1镉处理14 d的乙酸含量显著高于其余各处理.在处理7、14和21 d时,10 mg·L-1镉处理的琥珀酸含量显著高于其余处理,且其余处理间无显著差异(图3).

图中不同小写字母表示处理间差异显著(P<0.05).图2 紫苏根部有机酸含量随处理时间变化Fig.2 Changes of organic acid content in P. frutescens root with treatment time
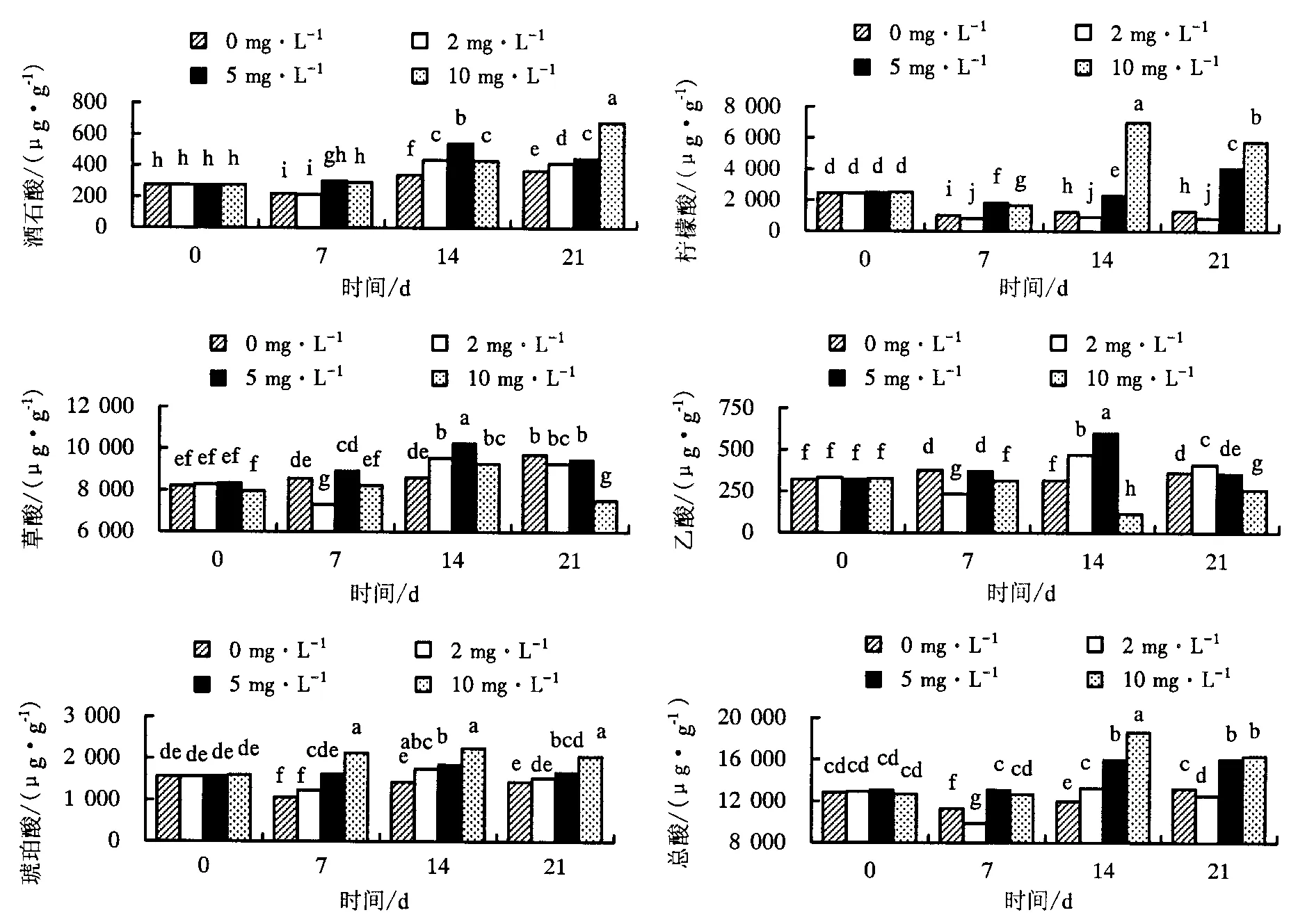
图中不同小写字母表示处理间差异显著(P<0.05).图3 紫苏茎部有机酸含量随处理时间变化Fig.3 Changes of organic acid content in stems of P. frutescens with treating time
2.5 紫苏叶片有机酸含量动态
由图4可见,与根和茎部相似,镉处理前(0 d)紫苏叶部各有机酸的含量无显著差异,经过21 d处理后,不同镉处理的有机酸总量显著下降.柠檬酸含量随处理时间的增加显著下降;酒石酸、草酸、琥珀酸含量随处理时间增加呈先升后降的趋势,乙酸含量随处理时间和浓度的增加而增大(图4).

图中不同小写字母表示处理间差异显著(P<0.05).图4 紫苏叶部有机酸含量随处理时间变化Fig.4 Changes of organic acid content in leaves of P. frutescens with treating time
2.6 紫苏镉含量及与有机酸含量的相关性
结果表明,不同处理浓度紫苏根、茎、叶镉含量均随着处理时间增加显著增大.在相同处理时间下,不同浓度镉处理紫苏的镉含量间亦存在显著差异(图5).从不同镉处理浓度和时间下的平均值看,紫苏镉含量在不同器官间存在显著差异,高低表现为:根(753.1 μg·g-1)>茎(135.6 μg·g-1)>叶(96.9 μg·g-1).
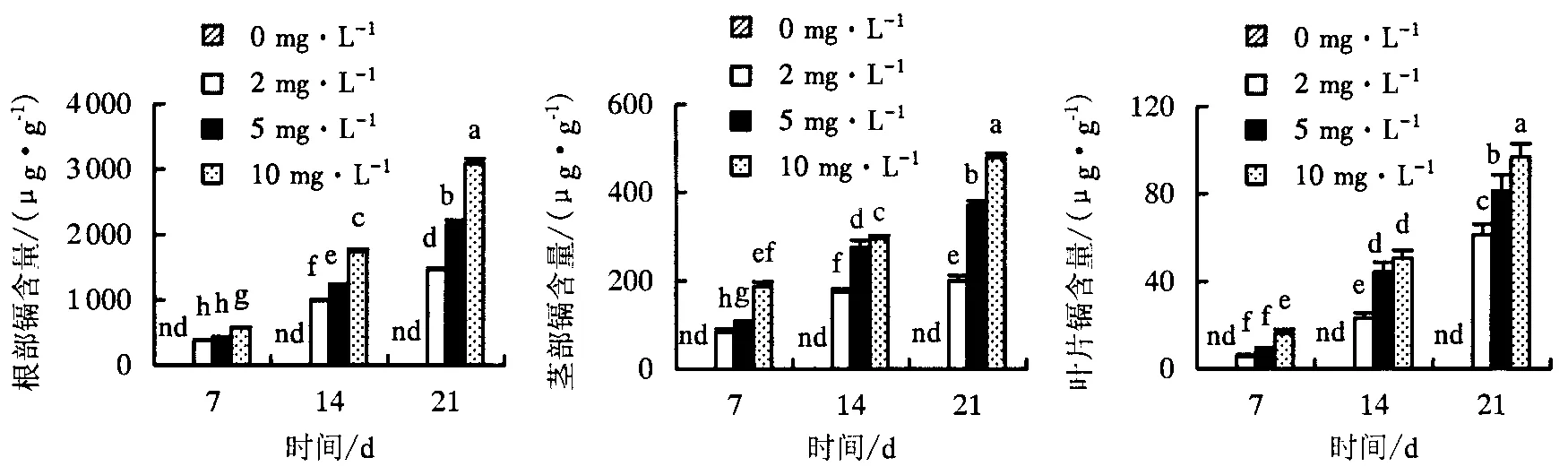
图中不同小写字母表示处理间差异显著(P<0.05),nd表示未检出.图5 紫苏根、茎和叶部镉含量随处理时间变化Fig.5 Changes of cadmium content in roots, stems and leaves of P. frutescens with treating time
相关分析表明,紫苏不同器官的镉含量与有机酸含量的相关性存在显著差异(表2).紫苏根、茎的镉含量与有机酸总量呈显著的正相关关系,而叶片的镉含量与有机酸总量呈显著的负相关.紫苏根的镉含量与草酸、酒石酸含量显著正相关,与富马酸显著负相关;茎的镉含量与酒石酸、丙酮酸、抗坏血酸、柠檬酸及琥珀酸含量显著正相关;叶的镉含量与草酸及柠檬酸含量显著负相关,而与抗坏血酸、乙酸含量显著正相关(表2).
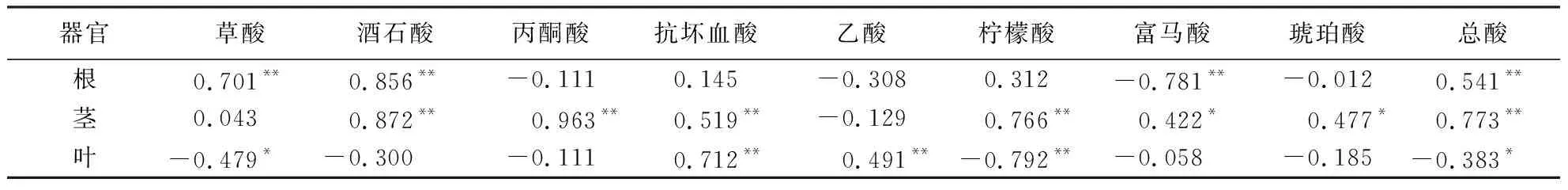
表2 紫苏根、茎、叶镉含量与有机酸含量的相关性1)Table 2 Correlation between cadmium content and organic acid content in roots, stems and leaves of P.frutescens
1)*表示在0.05水平上显著相关;**表示在0.01水平上显著相关.
3 结论与讨论
一些研究表明,有机酸、氨基酸、金属硫蛋白(MTs)和植物螯合肽(PCs)等植物抗金属毒害中起到重要作用[1-8].分析植物体内有机酸种类与含量有助阐明其金属抗性机制[4].孙瑞莲等在镉超积累植物龙葵不同生育期的叶片中均检测到乙酸、酒石酸、苹果酸、柠檬酸,其含量随龙葵的生育期而变化,认为有机酸能够指示镉积累的变化[11].紫苏也是一种镉富集植物,具有较强的镉耐性[15].不同镉处理浓度与处理时间的紫苏的根、茎、叶中均检测到草酸、酒石酸、丙酮酸、抗坏血酸、乙酸、柠檬酸、富马酸、琥珀酸,有机酸总量在各器官间的高低顺序为:茎>根>叶(表1),结果表明,紫苏不同器官的有机酸积累能力存在差异.在各器官中,含量较高的3种有机酸均为草酸、柠檬酸和琥珀酸,但其含量高低在根、茎、叶中的表现也不完全一致,根部:草酸>琥珀酸>柠檬酸,茎部:草酸>柠檬酸>琥珀酸,叶片:草酸>琥珀酸>柠檬酸.草酸的含量最高,这与麻莹等研究发现盐碱胁迫下碱地肤叶片积累的7种有机酸以草酸含量最高相似[18].前人研究表明,草酸在植物体内具有重要的生物学功能.它参与细胞体内Ca2+、pH和渗透压等的调节,植物病原菌防御反应与金属解毒等过程[19].草酸对镉等金属离子具有较强的结合能力,在紫苏根茎叶的有机酸中,草酸所占的比例高达65%~75%,这对提高紫苏的镉耐性具有重要意义.
从有机酸含量随时间的变化看,虽然镉胁迫下紫苏所含的有机酸种类未发生变化,但有机酸总量随着镉处理浓度和时间的增加显著增大,镉胁迫促进了紫苏有机酸的生物合成与积累,这与前人研究结论相一致[20-21].Cd胁迫下矿山型东南景天释放出更多的有机酸(如草酸和酒石酸等),通过草酸和酒石酸等对镉的络合作用,降低了植物体内游离态的镉离子浓度,从而降低了镉的毒害[22].砷胁迫下黑藻的草酸分泌量显著升高,添加外源草酸也能促进其对砷的吸收[23],同理,添加外源柠檬酸和酒石酸能够降低铅、锌对番茄幼苗的毒害[24].较高浓度的镉胁迫虽然抑制了紫苏的生长,且抑制效应亦随处理浓度的增加而增大[14];但紫苏的镉含量亦随着处理浓度和时间的增加而升高,其地上部及全株的镉平均含量均大于100 mg·kg-1,显示出紫苏较强的镉富集能力(图5).同时紫苏体内的草酸、柠檬酸和琥珀酸含量亦随着镉处理浓度和时间的增加而升高,这表明紫苏体内的草酸,柠檬酸和琥珀酸含量显著升高,有效地减轻了镉毒害,提高了镉耐性并促进了镉积累.此外,紫苏根部的镉含量与草酸、酒石酸含量显著正相关,茎部镉含量与柠檬酸、琥珀酸含量显著正相关,而紫苏叶片的镉含量与草酸含量负相关,说明紫苏体内草酸、酒石酸、柠檬酸、琥珀酸的积累增强有助于根、茎中镉的富集,这与一些解毒机制的研究认为,植物体外的有机酸可通过与根际游离的金属离子螯合形成稳定合物复合体,改变其有效性,降低金属的移动性,从而实现解毒的结论不一致[5,25].一般地,土壤环境中的重金属可被植物根系分泌的草酸等有机酸结合活化,使其更易迁至根表,其生物毒性亦随之大大降低.但结合活化的重金属究竟是进一步进入根系,抑或继续存留于根际环境,可能涉及到植物的生物学特性及其复杂转运过程[8].但紫苏体内积累的草酸、酒石酸、柠檬酸、琥珀酸等是否通过根系分泌作用活化了环境中的镉,并促进其从根部转运到茎部,有待进一步研究证实[26].另外,叶片是草酸的主要合成场所,合成途径包括乙醛酸/乙醇酸途径、抗坏血酸途径和草酰乙酸合成途径,但合成的草酸是否向下运输以及运输过程是否对叶片的镉具有淋洗作用,有待深入研究.

