松材线虫侵染对马尾松抗氧化系统的影响
谢婉凤, 梁光红, 张飞萍
(1.福建农林大学金山学院;2.福建农林大学林学院,福建 福州 350002)
病虫害是限制林木正常生长发育的主要因素.马尾松作为中国特有的速生丰产乡土树种,是中国南方荒山造林和工业生产的重要树种[1],松材线虫病等病害却严重影响着马尾松的生产,是马尾松的一种毁灭性病害[2].全国每年有超过500万株松树死于松材线虫病,年均发生面积达7 000 hm2[3],造成的直接和间接经济损失超过250亿人民币.因此,揭示松材线虫对马尾松的侵害机制对寻求持久有效的松材线虫病控制措施具有重要意义.
松材线虫病的发现己有百年历史,但仅在近几十年才对其进行系统研究,包括病原线虫形态学、生物学和传播媒介,寄主松树感病性,松材线虫病发生、扩散规律以及防控技术措施等[4].松材线虫病的致病机理是目前的研究热点,对此主要有三种观点:第一种观点认为松材线虫分泌的酶破坏了松树薄壁细胞的细胞壁以及细胞膜,进而导致了树脂道中的树脂异常渗漏并扩散进入邻近管胞,水分的输导也因此而受阻,致使马尾松萎蔫;第二种观点认为受松材线虫侵染的松树其木质部产生了挥发性萜烯类物质,这些物质进入管胞致使其形成空洞,阻碍水分输导;第三种观点则认为松树在受到松材线虫的侵染后,其体内产生了毒性物质导致松树萎蔫[5].尽管上述观点还存在争议,但它们证实了松材线虫的侵染会引起松树全身性系统反应,最终导致松树的枯萎死亡[6].
当前,松材线虫对马尾松的致病作用研究主要集中于生理、病理变化层面.有研究发现,接种松材线虫的马尾松中多酚氧化酶的活性提高,并在抗性种源中的提高程度大于敏感的种源;抗性种源中的总酚和绿原酸的含量也高于敏感的种源,并且这些次生物质在抗性种源中能够保持较长时间的高水平的含量,从而推测多酚氧化酶的活性以及酚类次生化合物的含量与马尾松的抗病能力存在关系[7].在马尾松感染松材线虫后反射光谱方面的研究结果认为,中红外波段反射光谱曲线能够在一定程度上指示松树的初期发病;随着病害的加深,马尾松针叶中的叶绿素含量也不断降低,并与光谱特征参数之间存在显著的线性关系[8].张慧等[9]研究认为,松材线虫的侵害影响了马尾松的光合作用能力和抗氧化酶的活性,其中感病马尾松的净光合速率先短暂上升后不断下降,并随着病害指数的增加而呈现负值,通过分析叶绿素荧光的变化认为光合作用的下降是由光合系统Ⅱ的变化引起的,且受侵害的马尾松针叶含水量变化导致叶绿素含量下降,并最终影响了针叶的光合作用能力,受侵害的马尾松的抗氧化酶系统也受到明显的影响.
植物抗性是其抵抗不利环境的重要基础[10].逆境条件下,植物的抗氧化物含量、抗氧化酶活性均会产生变化,从而影响植物的抗逆能力[11].植物生理抗性的物质包括两类,一类是总酚、黄酮等植保素类次生化合物[12-13],另外一类是抗氧化酶[14].这些次生化合物含量以及抗氧化酶活性的高低直接影响了植物的抗逆能力;此外,脯氨酸作为植物渗透调节的重要物质,在植物的抗逆调节中也发挥重要作用[15-16].在松材线虫的侵害下,寄主马尾松的抗性防御系统会受到影响[17],相关基因的表达水平也同时发生改变,鉴于此,本研究通过测定分析松材线虫侵染后马尾松的脯氨酸含量及抗氧化酶活性的变化,同时检测相关基因的表达情况,结合生理酶活性及对应基因的表达变化探讨松材线虫侵染对马尾松逆境防御能力的影响,以期进一步揭示松材线虫的致病机理.
1 材料与方法
1.1 供试材料
供试马尾松(Pinusmassoniana)为种植于福建农林大学森林保护研究所温室中的2年生幼苗.供试松材线虫分离自福建省漳州市芗城区的马尾松疫木,并于拟盘多毛孢菌(Pestalotiopsissp.)菌落[17]上纯培养.
1.2 试验方法
1.2.1 松材线虫悬浮液制备及接种马尾松 参照徐华潮等[17]和Xie et al[18]的方法制备松材线虫的悬浮液并采用皮接法接种马尾松.用无菌的刀片在距离马尾松基部10 cm的主茎的一侧斜切出约1 cm的伤口,伤口深至木质部,继而在伤口内固定一个经灭菌处理的脱脂棉球,并用封口膜将棉球固定形成斜漏斗状,往棉球中接种100 μL分别含有1 000、2 000、2 500、5 000、10 000、20 000条松材线虫的悬浊液,作为处理组,并以接种100 μL无菌水的马尾松作为对照组,接种后保湿24 h.处理组与对照组均放置于30 ℃温室中培养.
1.2.2 取样 接种后的1、2、3 d,分别取处理组(接种2 000条松材线虫)和对照组的马尾松松针,液氮速冻,用于总RNA的提取和检测编码富含脯氨酸的阿拉伯半乳聚糖蛋白(proline-rich arabinogalactan protein 4, AGP4)的基因表达.在接种后3、5、7、9、11和14 d,分别取处理组(接种2 000条松材线虫)和对照组的马尾松的针叶样本各1 g,用于提取粗酶液.此外,在松材线虫侵染2 d后,分别取接种不同虫量(1 000、2 500、5 000、10 000、20 000条)的处理组及其对照组的针叶、茎干及枝条0.5 g,用于提取总RNA,检测POD基因的表达.各处理组及其对照组均取3个重复.
1.2.3 松材线虫侵染的马尾松针叶抗氧化酶活性及脯氨酸含量测定 采用北京索莱宝科技有限公司的超氧化物歧化酶(superoxide dismutase, SOD)试剂盒、铜-锌超氧化物歧化酶(Cu-Zn SOD)试剂盒、过氧化物酶(perxiodase, POD)试剂盒分别测定处理组与对照组中的SOD、Cu-Zn SOD及POD的活力;采用脯氨酸试剂盒测定处理和对照样本中的脯氨酸含量.
1.2.4 总RNA的提取、逆转录及目标基因的荧光定量PCR检测 采用E.Z.N.A.® Plant RNA Kit (Omega) RNA提取试剂盒,参照操作手册分别提取各处理组及对照组的针叶、茎干、枝条的总RNA.采用TIANScript RT Kit(北京天根)逆转录试剂盒对总RNA进行逆转录成为单链cDNA.
检测AGP4基因(F:5′-GGGGTGCTACACTTATTTCC-3′, R:5′-GCTAACTGCTTTATCGGCTC-3′)和POD基因(F:5′-CACGGTTCGGTTGTAGTTC-3′, R:5′-CACAGTGGTGGGCATTTC-3′)的表达情况,以肌动蛋白(Actin)基因作为内参基因(F:5′-CCTTGGCAATCCACATC-3′, R:5′-TCACCACTACGGCAGAAC-3′).
qPCR试剂采用北京全式金的TransStartGreen qPCRSuperMix Kit, PCR反应在美国ABI公司的QuantStudioTM6 Flex Real-Time PCR System上完成,94 ℃ 30 s;94 ℃ 5 s,50~60 ℃ 30 s,72 ℃ 30 s (41cycles )读取荧光;95 ℃ 10 min,60~95 ℃ 0.02 ℃·s-1,20 min,读取荧光.松材线虫接种不同天数后的马尾松较其对照处理的基因相对表达变化量采用2-ΔΔct法进行计算[19],对照马尾松样本的基因表达量均归一化(normalize)为1.
1.3 数据处理
处理组与对照组之间采用单因素方差分析进行显著性差异比较.
2 结果与分析
2.1 松材线虫侵染后马尾松针叶中的脯氨酸含量变化
由图1可见,松材线虫侵染后,处理组中的脯氨酸的含量呈先降低后升高再降低的变化趋势,且在侵染11 d后的处理组中的含量显著低于对照样本,推测随着侵染时间的延长,受侵染马尾松的渗透调节能力可能受到了影响.此外,qPCR检测编码AGP4基因在松材线虫接种1、2、3 d的马尾松中的表达水平,显示该基因在接种1 d后的马尾松中表达较对照组下调,3 d后的表达下调程度加大,表明松材线虫侵染下马尾松针叶中该基因的表达变化与脯氨酸含量的变化存在一定的相关性.
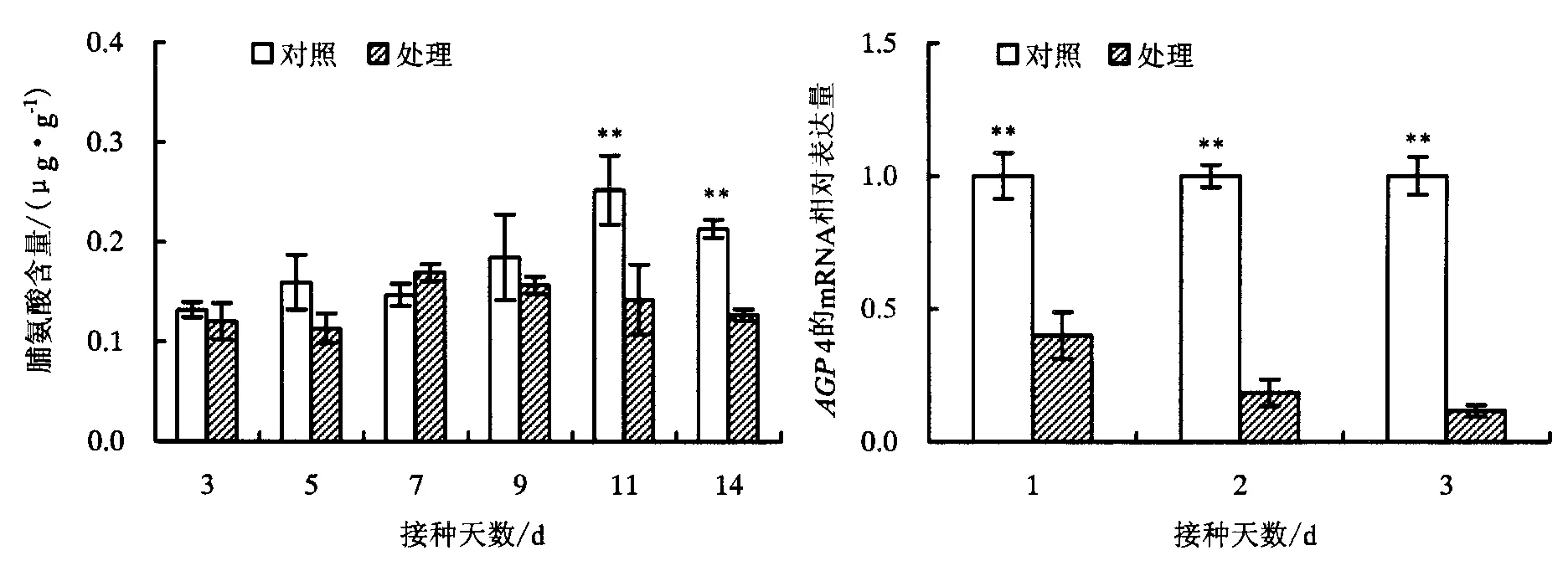
“**”表示处理组与对照组存在极显著性差异(P<0.01).图1 松材线虫侵染后马尾松针叶中脯氨酸含量及AGP4基因表达变化Fig.1 Dynamic change of proline contents and AGP4 gene expression level in the needles of P.massoniana after B.xylophilus infestation
2.2 松材线虫侵染后马尾松针叶POD和SOD基因的表达变化
松材线虫的侵染还影响马尾松的POD和SOD基因的表达水平.通过分析前期的转录组数据显示,马尾松中的2个编码POD基因(Unigene0020188, Unigene0034965)、2个编码SOD基因(Unigene0020266、Unigene0024712)以及一个编码Cu-ZnSOD基因(Unigene0031949)在接种松材线虫1、2、3 d的马尾松针叶中的表达量均低于对照组;此外,另外一个编码POD基因(Unigene0018599)和另外一个编码Cu-ZnSOD基因(Unigene0027785)在接种松材线虫1 d的样本中较对照下调表达,随后在接种松材线虫2 d的样本中表达量提高,但其在接种松材线虫3 d的样本中的表达量又降低(图2).可见松材线虫侵染下马尾松针叶中的过氧化物酶活性降低与编码该酶的多个基因的下调表达有关.
2.3 松材线虫侵染后马尾松针叶SOD和POD酶活力的变化
通过测定松材线虫侵染不同天数马尾松针叶中SOD和POD酶活力,结果显示,随着侵染天数的增加,受侵染的马尾松针叶中的SOD和POD的活力呈现先升高后降低的变化趋势.其中,与未经松材线虫侵染的马尾松样本中的SOD和POD酶活性相比,侵染3,7,11,14 d的马尾松针叶中的POD活性均显著低于其对照组;侵染3,5,9,11,14 d的马尾松针叶中的SOD活性也都显著低于其对照组.此外,侵染11,14 d的马尾松针叶中的Cu-Zn SOD活性也显著低于其对照组(图3).由此可见,对于2年生的马尾松苗,松材线虫侵染10天后,松苗的抗氧化酶活性显著降低,抗病防御能力下降.

CK:对照组;TR1:接种1 d;TR2:接种2 d;TR3:接种3 d.图2 松材线虫侵染后马尾松针叶中POD, SOD和Cu-Zn SOD基因的动态变化Fig.2 Dynamic gene expression change of the POD, SOD, and Cu-Zn SOD from the P.massoniana after B.xylophilus infestation

“**”表示处理组与对照组存在极显著性差异(P<0.01).图3 松材线虫侵染下不同天数下的马尾松中SOD和POD酶活性的变化Fig.3 Changes of SOD and POD activities in P.massoniana after different days of B.xylophilus infestation
2.4 松材线虫不同虫量接种后马尾松POD基因的表达变化
分别接种1 000、2 500、5 000、10 000、20 000条松材线虫于2年生马尾松,2天后,检测POD基因在马尾松茎、枝和叶中的表达变化.结果显示,接种松材线虫1 000的马尾松茎、枝、针叶中的POD基因表达较对照组的茎、枝、针叶中该基因上调表达;随着接种虫量的增加,马尾松茎、枝条中的POD基因表达水平降低,并在接种20 000条松材线虫的马尾松中的表达量最低;与之相对,该基因在针叶中的基因表达水平持续提高,并在接种20 000条松材线虫的马尾松针叶中的表达量最高 (图4).由此可见,该基因在马尾松不同组织中的表达具有空间差异性.
3 讨论
病原菌是引起植物侵染性病害的主要因子,这种侵害作用往往造成受害植物的生理代谢功能紊乱、生长发育受阻甚至植株枯萎死亡.植株组织中的抗氧化物质含量和抗氧化酶活性能够影响植物的抗逆能力,而植物在不同的发育阶段其抗逆能力也不同.马尾松是多年生树种,不同生长年限下的马尾松的抗病能力存在差异,其中以苗期的抗病能力较强,而成熟树龄的抗病能力较弱,但不同种源之间也存在差异[20-21].本研究以2年生的马尾松苗为材料接种松材线虫,研究该树龄的马尾松的抗病能力,研究结果显示松材线虫侵染后的马尾松针叶的脯氨酸含量显著降低,脯氨酸是植物中重要的渗透调节物质[22],其在植株中含量降低将不利于马尾松的渗透调节,影响植株的抗逆能力;与之相应,AGP4基因的表达也受到抑制,该蛋白在植物的生长与发育过程中具有重要作用[23],可见松材线虫侵染导致马尾松的水分运输受阻,其渗透调节作用也被抑制,不利于植株的生长.松材线虫侵染导致马尾松茎干的水分输导受阻,致使植株逐渐枯萎死亡,在此过程中,植株的渗透调节能力也受到影响.
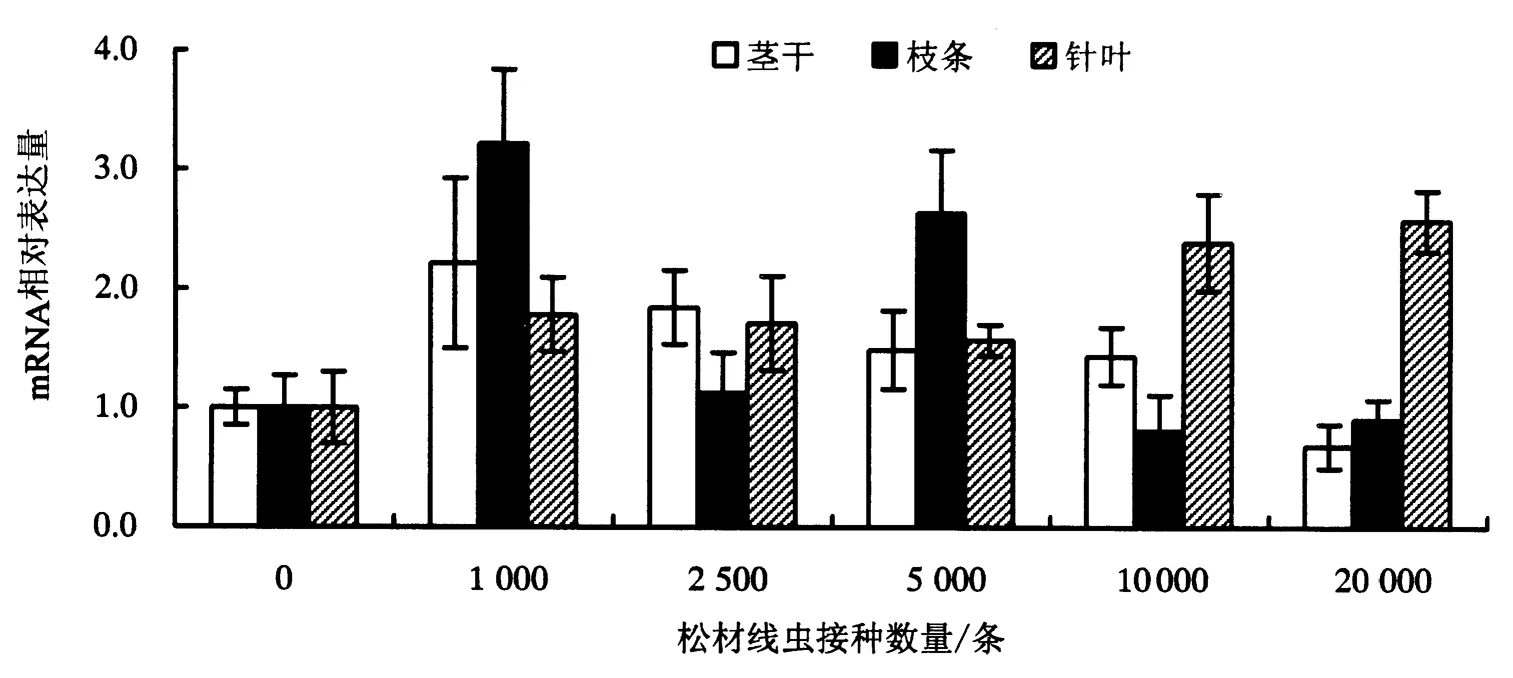
图4 不同数量松材线虫侵染下的马尾松茎、枝、针叶中的POD基因的表达变化Fig.4 Gene expression changes of POD in the stem, branch, and needle leaf of P.massoniana with different quantities of B.xylophilus infestation
此外,松材线虫侵染还抑制了马尾松中保护酶的活性.其中,SOD能够催化超氧化物的歧化反应,具有清除活性氧自由基的作用,活性氧自由基是逆境胁迫下生物植物细胞中产生的有害物质,对细胞产生氧化伤害[24].Cu-Zn SOD作为总SOD的一种,含Cu、Zn金属辅基,是最为常见的一种酶,主要存在于机体细胞浆中.受侵染的马尾松中SOD以及Cu-Zn SOD的活性降低将不利于细胞抗氧化作用.此外,POD在木质素的合成的催化过程,植物木质素合成增强有利于受侵染组织的木质化形成物理屏障,抵御病菌侵害,因此,植物POD的活性高低对其抗病能力强弱呈正相关性[25-26].在本研究中,松材线虫侵染致使马尾松的POD活性降低,并显著低于对照组,不利于马尾松合成木质素抵御病菌的侵害.随着侵染虫量的加大,POD基因在受侵染初期的马尾松的茎干和枝条的表达水平就不断下降,可见该酶的基因表达也受到抑制,同时还发现该基因在针叶中的表达水平上升,可见侵染初期不同组织中的基因表达模式不同,这可能与侵染初期松材线虫仅存在茎干,还未在整株中扩散有关;而对于受侵染的茎干部分,随着侵染虫量的不断加大,该基因的表达不断下调,体现了POD基因表达与植物抗病性的相关性.
综上,本研究认为松材线虫侵染致使2年生马尾松苗中与渗透调节相关的脯氨酸含量、与抗氧化能力相关的SOD以及木质素合成相关的POD的活性下降,相关基因的表达也受到影响,从而破坏了马尾松植株的整体抗性,导致马尾松最终的枯萎死亡.

