FSH处理对猪颗粒细胞中类固醇合成酶基因的表达及其调控区组蛋白H3修饰的影响
张金璧,姚望,潘增祥,刘红林
FSH处理对猪颗粒细胞中类固醇合成酶基因的表达及其调控区组蛋白H3修饰的影响
张金璧,姚望,潘增祥,刘红林
(南京农业大学动物科技学院,南京 210095)
【目的】研究FSH处理对猪卵巢颗粒细胞类固醇合成酶、垂体激素受体、凋亡相关等基因表达的影响及此过程中组蛋白H3修饰的变化情况。【方法】首先,采集猪卵巢组织并用注射器抽取方法收集卵泡颗粒细胞,用含血清体系体外培养颗粒细胞至贴壁,血清饥饿16h后用终浓度5IU∙mL-1的FSH处理24h,并收集细胞。其次,提取细胞mRNA,采用qRT-PCR方法检测类固醇合成酶(STAR、CYP11A1、HSD3B和CYP19A1)、垂体激素受体(FSHR和LHR)、凋亡相关基因(XIAP和FasL)mRNA的表达变化,最后,相同处理后固定细胞,采用染色质免疫沉淀结合qPCR(ChIP-qPCR)方法检测类固醇合成酶基因STAR、CYP19A1和HSD3B上游转录调控区组蛋白H3修饰(H3K4me2、H3K4me3、H3K9ac和H3K14ac)状况。【结果】5IU∙mL-1的FSH处理引起类固醇合成酶基因STAR、CYP19A1和HSD3B分别为2倍(<0.01)、2.8倍(<0.01)和3.6倍(<0.05)的显著上调,而CYP11A1表达水平没有显著变化;FSH处理对垂体激素受体FSHR、LHR和凋亡相关基因XIAP、FasL影响不显著。在上调的三个类固醇合成酶基因中,HSD3B调控区组蛋白H3修饰变化最为显著,H3K4me2、H3K4me3、H3K9ac和H3K14ac结合分别有14.7倍(<0.01)、 13.6倍(<0.01)、19.7(<0.01)倍和2.5倍(<0.05)的显著上调;STAR基因调控区的H3K9ac在处理后有11.1倍的显著下降(<0.05);CYP19A基因调控区的H3K4me3和H3K9ac分别有0.5倍的上调(<0.01)和10.4倍(<0.01)的下降,其余组蛋白修饰在处理前后没有显著变化。【结论】FSH处理24h对颗粒细胞类固醇合成酶基因转录有显著上调作用,对其转录过程有H3组蛋白修饰参与,组蛋白修饰模式具有基因特异性。垂体激素受体和凋亡相关基因的应答可能需要FSH和其他因素的联合作用。
猪;FSH;颗粒细胞;类固醇合成酶;组蛋白修饰
0 引言
【研究意义】组蛋白修饰调控是基因转录调控机制中的重要组成部分,其灵活快速的调控特点在细胞对微环境的应答过程中起到了重要作用。在哺乳动物基因组中,组蛋白具有多重修饰形式,包括组蛋白末端的乙酰化[1]、甲基化[2]、磷酸化[3]、泛素化[4]、ADP核糖基化[5]等。这些修饰模式多样,在特定的细胞和状态中对基因转录起到多样化的调控作用。【前人研究进展】促卵泡素(follicle stimulating hormone,FSH)是垂体前叶嗜酸性细胞分泌的一种糖蛋白激素,能与位于颗粒细胞膜上的特异性受体结合,激活细胞内信号通道,对卵巢卵泡发育,激素分泌过程有重要的调节[6-7]外培养的颗粒细胞中,FSH能促进细胞生长,抑制细胞凋亡[8],影响类固醇的生成,如促进孕酮的合成和分泌以及雌激素合成能力[9]。类固醇合成酶是一类催化性腺中类固醇激素合成的酶类,其催化合成的激素包括睾酮、孕酮和雌二醇等[10]。其中类固醇合成快速调节蛋白(StAR,由STAR基因编码)负责将胆固醇由线粒体外膜或细胞质向线粒体内膜运送[11];P450胆固醇侧链裂解酶(P450scc,由CYP11A1基因编码)催化胆固醇形成孕烯醇酮[12-13];随后在3b-羟甾脱氢酶(3b-HSD,由HSD3B基因编码)的作用下生成孕酮。孕酮是类固醇合成过程中的基础甾体,在卵泡膜细胞中,由C17-20裂解酶(P450c17,由CYP17C编码)催化生成睾酮[14]。最后在颗粒细胞中由芳香化酶(P450arom,由CYP19编码)氧化脱去19-甲基,芳香构化转变成C18雌激素(雌酮和雌二醇)[15]。FSH对垂体激素受体和凋亡相关基因的诱导具有时间上和物种间的差异,也与体外培养的条件有关。【本研究切入点】一般认为H3K4的2, 3甲基化可能与转录抑制相关,而联合参入的H3K9与 H3K14的乙酰化可能与转录激活相关,单独的H3K14的乙酰化则与转录抑制相关[16-17]。体外培养的颗粒细胞是卵巢研究中常用的实验对象,研究者们对FSH处理引起的基因应答已有一定认识,但组蛋白修饰在这些应答中是否参与,如何参与,是否具有特异性等问题尚不明确。【拟解决的关键问题】本文旨在明确体外培养的猪颗粒细胞中类固醇合成酶基因在FSH处理下的转录变化情况,并探索这些基因转录水平变化与其调控区组蛋白修饰变化的关系。对各组蛋白修饰对FSH的精确应答时间及其在基因调控区的详细分布状况进行深入研究,绘制组蛋白应答的时空图谱,将进一步完善FSH对颗粒细胞生理的调控原理。
1 材料与方法
本研究于2016年9月至2017年2月在南京农业大学动物科学类实验教学中心(国家实验教学示范中心)完成。
1.1 样品采集
猪卵巢选自淮安苏食肉品屠宰点,屠宰后10min内采集双侧卵巢,置于37℃含双抗(青霉素、链霉素各100U∙mL-1)的生理盐水中,3h内带回实验室进行后续试验。
1.2 颗粒细胞培养
清洗卵巢,用注射器抽取直径为3—6mm卵泡的卵泡液及颗粒细胞,800×g离心5min去除卵泡液;PBS清洗颗粒细胞两次,800×g离心5min去除PBS后,用完全培养基(含体积分数15%胎牛血清和100 U∙mL-1双抗DMEM/F12培养基)重悬细胞,充分吹打至散开并接种于T25培养瓶中;放置于细胞培养箱内,37℃,5%CO2培养。24h后观察颗粒细胞贴壁情况,弃去培养基及未贴壁的颗粒细胞、卵母细胞,清洗贴壁的颗粒细胞,更换培养基继续培养;待细胞长至90%汇合度时传代;传代时用PBS清洗细胞两次,加入1mL胰酶消化细胞,观察到大部分细胞漂起时即加入适量完全培养基终止消化,吹打分散细胞;800×g离心5min,弃去上清,并用完全培养基重悬细胞后接种于6孔板中(约105个/孔)继续后续试验。
1.3 FSH激素处理
正常培养颗粒细胞48h后,换无血清DMEM/F12培养基培养16h,试验组加入5IU/mL的FSH(宁波第二激素厂),对照组加入同等体积PBS,继续培养24h。
1.4 RNA提取及反转录
用PBS冲洗细胞两次,按照Trizol试剂(Invitrogen公司)说明书提取颗粒细胞RNA(每个孔用量1mL),紫外比色法测定总RNA的浓度和纯度,用1.4%甲醛变性琼脂糖凝胶电泳检测总RNA的质量。取1μg质量合格的总RNA用M-MLV 反转录酶(Promega公司)和oligo(dT)18进行cDNA第一链合成,具体步骤按说明书操作。cDNA于-20℃保存备用。
1.5 染色质免疫沉淀(ChIP)
PBS清洗颗粒细胞2次,用终浓度1%的甲醛体外交联颗粒细胞,从培养瓶中收集细胞后,1%SDS裂解液裂解细胞,超声波断裂染色质,加特异性抗体(H3K4me2、H3K4me3、H3K9ac和H3K14ac,CST公司)进行免疫共沉淀,洗脱与逆转交联后,用DNA纯化试剂盒(Qiagen公司)进行DNA纯化,最后以沉淀所得的DNA为模板,进行qPCR。
1.6 引物设计与qPCR反应
定量引物设计:根据GenBank数据库中收录的基因mRNA序列和qPCR反应要求,用Primer Premier5.0软件设计引物;ChIP引物设计:根据GenBank数据库中收录的相应基因序列,选取转录起始位点到上游1 000bp以内位置,用Primer Premier5.0软件设计引物。全部引物由上海英骏生物技术有限公司合成,使用时用ddH2O稀释至工作浓度。实时荧光定量PCR反应依试剂盒(Takara公司)说明操作。根据文献[18]的方法进行数据分析,即ΔCT= CT目标基因-CT内参基因,目标基因的CT 相对于内参基因的CT 为2-ΔCT,转基因植株基因表达的变化表示为对照的2-ΔCT记为1时目标基因2-ΔCT的相对值(即2-ΔΔCT),各基因表达量用均值表示。引物序列信息和扩增条件见表1。
2 结果
2.1 FSH处理对颗粒细胞基因转录水平的影响
2.1.1 类固醇合成酶基因 本试验共检测了4个类固醇合成酶基因的表达水平,分别为STAR、CYP11A1、HSD3B和CYP19A1。在FSH处理24h后的颗粒细胞中,STAR、HSD3B和CYP19A1的表达水平有显著上升,相比对照组而言,处理组的表达水平分别达到了2倍(<0.01)、2.8倍(<0.01)和3.6倍(<0.05)。而CYP11A1表达水平没有显著变化(图1)。

*. P<0.05,**. P<0.01 下同 The same as below
2.1.2 垂体激素受体基因 颗粒细胞中垂体激素FSH和LH的受体FSHR和LHR的mRNA表达水平在FSH处理24h后相比对照组没有显著差异(图2)。
2.1.3 凋亡相关基因 对抗凋亡基因XIAP和凋亡标志基因FasL-2表达水平进行检测,结果证明FSH处理并没有显著改变颗粒细胞中这两个凋亡相关基因的表达水平(图3)。
2.2 FSH处理对颗粒细胞类固醇合成酶基因调控区组蛋白修饰的影响
2.2.1 HSD3B基因的组蛋白修饰变化 在FSH处理24 h后,HSD3B基因上游调控区的组蛋白H3修饰发生了显著变化(图4)。其中H3K4me2、H3K4me3、H3K4ac和H3K14ac的结合水平分别上升了14.7倍(<0.01)、13.6倍(<0.01)、19.7(<0.01)倍和2.5倍(<0.05),差异均达到了显著水平。结果说明HSD3B基因转录调控与所检测的组蛋白修饰关联最为紧密。

表1 PCR引物及反应条件
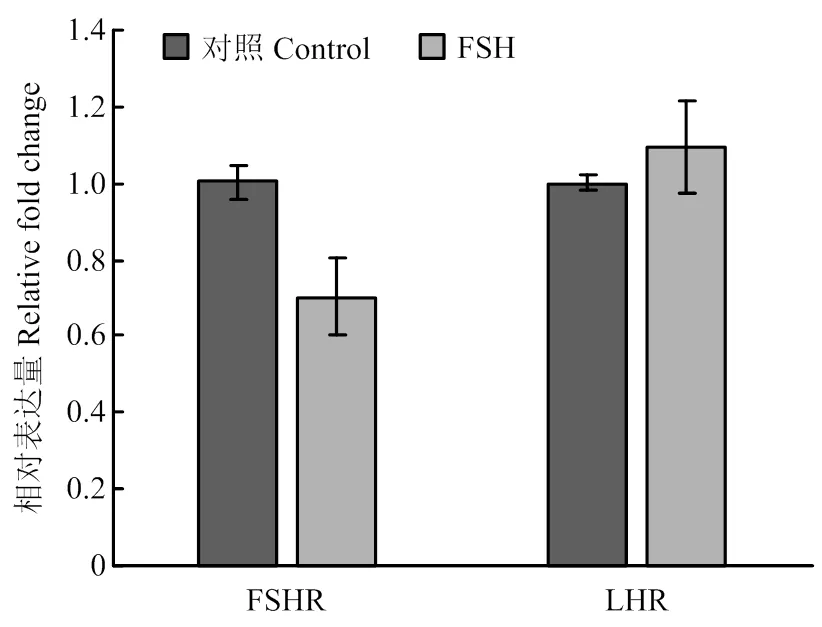
图2 FSH处理对颗粒细胞垂体激素受体基因的表达水平的影响
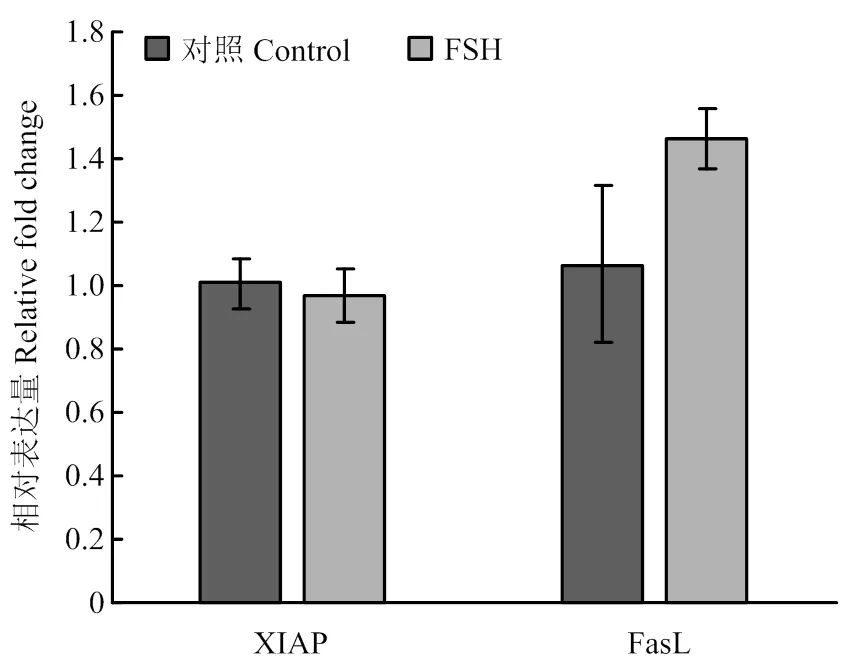
图3 FSH处理对颗粒细胞凋亡相关基因的表达水平的影响
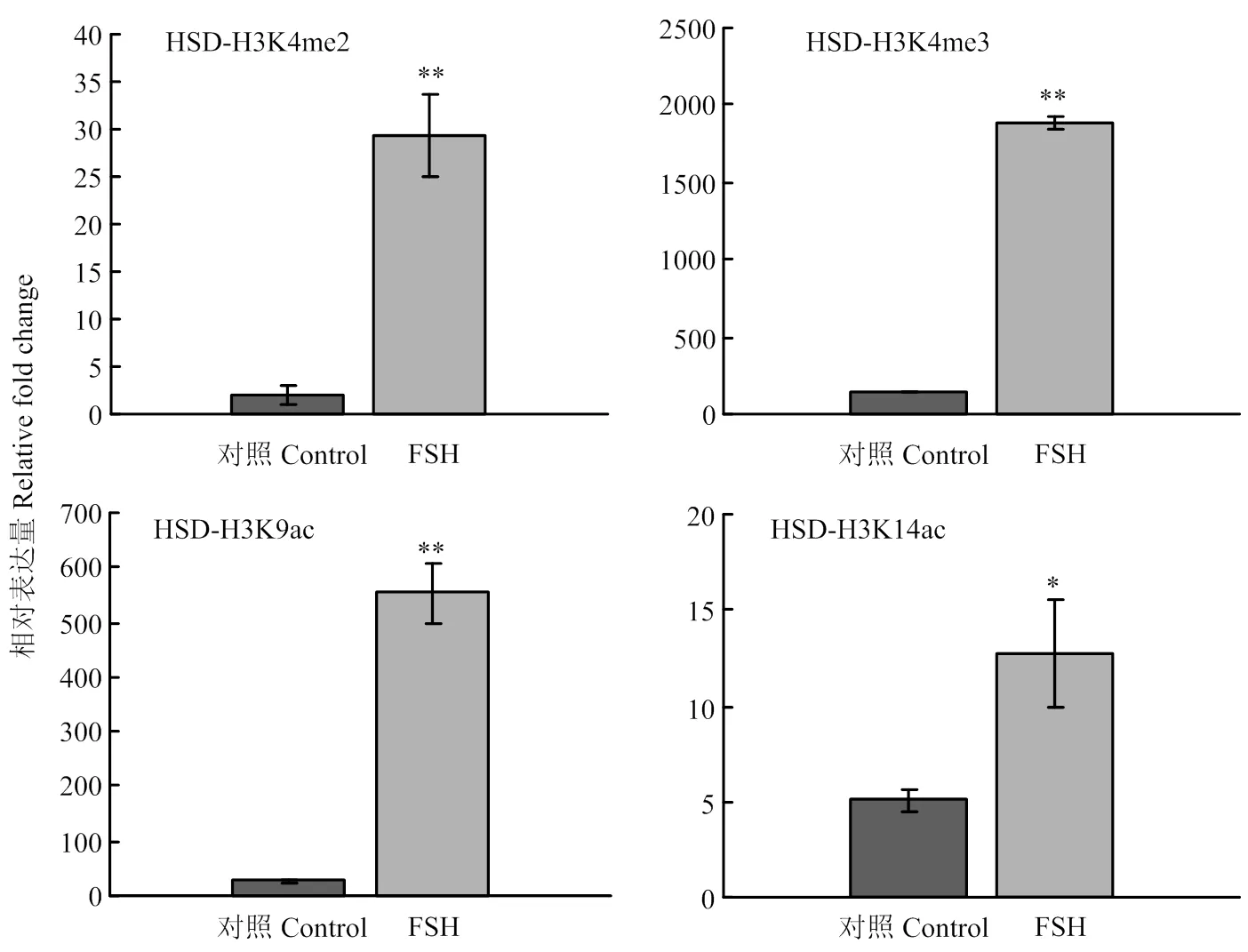
图4 FSH处理对颗粒细胞HSD3B基因上游调控区组蛋白修饰变化的影响
2.2.2 STAR、CYP19A基因的组蛋白修饰变化 在FSH处理24h后,STAR基因调控区的H3K9ac在处理后有11.1倍的显著下降(<0.05, 图5);CYP19A基因调控区的H3K4me3和H3K9ac分别有0.5倍(<0.01)的上调和10.4倍(<0.01)的下降,其余组蛋白修饰在处理前后没有显著变化(图6)。结果说明组蛋白修饰具有基因特异性,在不同类固醇合成酶基因中的参与有所不同。

图5 FSH处理对颗粒细胞STAR基因上游调控区组蛋白修饰变化的影响
3 讨论
3.1 FSH提升类固醇合成酶基因表达水平
FSH在雌性动物中能抑制卵泡凋亡、促进卵泡的生长、颗粒细胞增殖以及类固醇激素的合成和分泌[19]。笔者的试验证实,24h的FSH处理让卵泡类固醇合成3个主要合成酶基因STAR、HSD3B和CYP19A1的表达量有了显著上升。在卵巢类固醇激素合成过程中(图7),STAR编码的类固醇合成快速调节蛋白负责类固醇“原料”胆固醇的转运,而HSD3B编码的3b-羟甾脱氢酶是孕酮的主要合成酶,这两种酶表达量的升高理论上为进一步合成雌激素提供了反应底物。而CYP19编码的芳香化酶是雌激素合成的关键酶,其表达水平上升与FSH对颗粒细胞雌激素合成的影响和对卵泡健康发育的维持功能相吻合。同时,另一个合成酶基因CYP11A1的表达量却没有显著变化,一方面可能由于其编码的胆固醇侧链裂解酶及其催化产物孕烯醇酮可能在短期内较为充足,不会限制后续类固醇的合成,另一方面可能由于24h的处理时间不足让此基因在表达水平上产生回应。在小鼠和大鼠体外培养的颗粒细胞模型中有研究报道STAR对FSH的应答极快,3h后既能检测到mRNA的上调,而CYP11A1应答较为缓慢,在24h才检测到mRNA的表达变化[20],这一结果支持了后一种可能。
3.2 FSH处理对垂体激素受体的影响
除了类固醇合成酶,本研究对垂体激素受体基因FSHR和LHR的表达水平进行了检测。在雌性动物卵泡中,FSH和雌激素的协同作用会促进颗粒细胞表达更多FSH及LH受体,增加卵泡对促性腺激素的敏感性,较高的LH受体水平是大卵泡走向成熟和排卵的关键因素之一。但在体外培养的猪颗粒细胞中,24h的FSH处理并没有导致显著的FSHR和LHR水平变化。在其他物种的类似研究中发现,48h的FSH处理能诱导体外培养的小鼠颗粒细胞FSHR水平升高[21], 24h的FSH处理在大鼠颗粒细胞中引起FSHR显著升高[22],在体外培养的羊卵丘卵母细胞复合体(COC)中,10IU∙mL-1浓度的FSH能显著上调FSHR和LHR的mRNA水平[23]。然而,在牛颗粒细胞中,单独的FSH处理对FSHR的mRNA水平没有显著影响,仅有在与5-α-二氢睾丸酮(DHT)联合处理细胞时才能引起FSHR水平的升高[24]。在LHR对FSH的应答方面,早年有报道证实LHR对FSH的应答需要颗粒细胞和其他类型细胞的协同配合,因此只有在体内、卵泡培养中才能观测到LHR上调。培养体系中的血清对LHR的应答有较大影响,大鼠无血清培养的颗粒细胞中也有LHR上调的报道[25]。结合的试验结果和他人的研究结论可见,FSH在猪、牛等动物中的作用与在小鼠、大鼠等物种中有所差别,FSH对垂体激素受体的诱导具有时间上和物种间的差异,另外也与体外培养的条件有关。
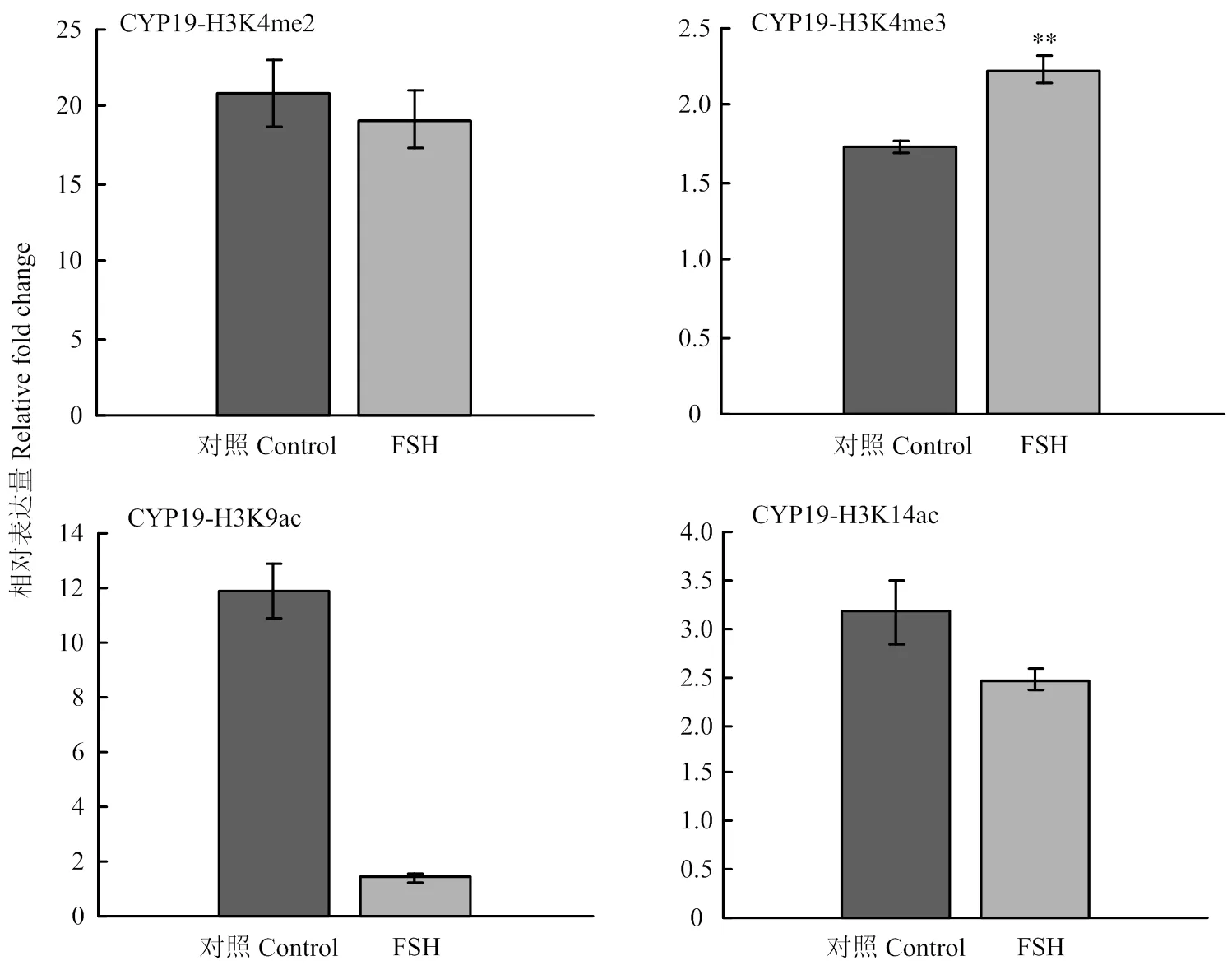
图6 FSH处理对颗粒细胞CYP19A基因上游调控区组蛋白修饰变化的影响
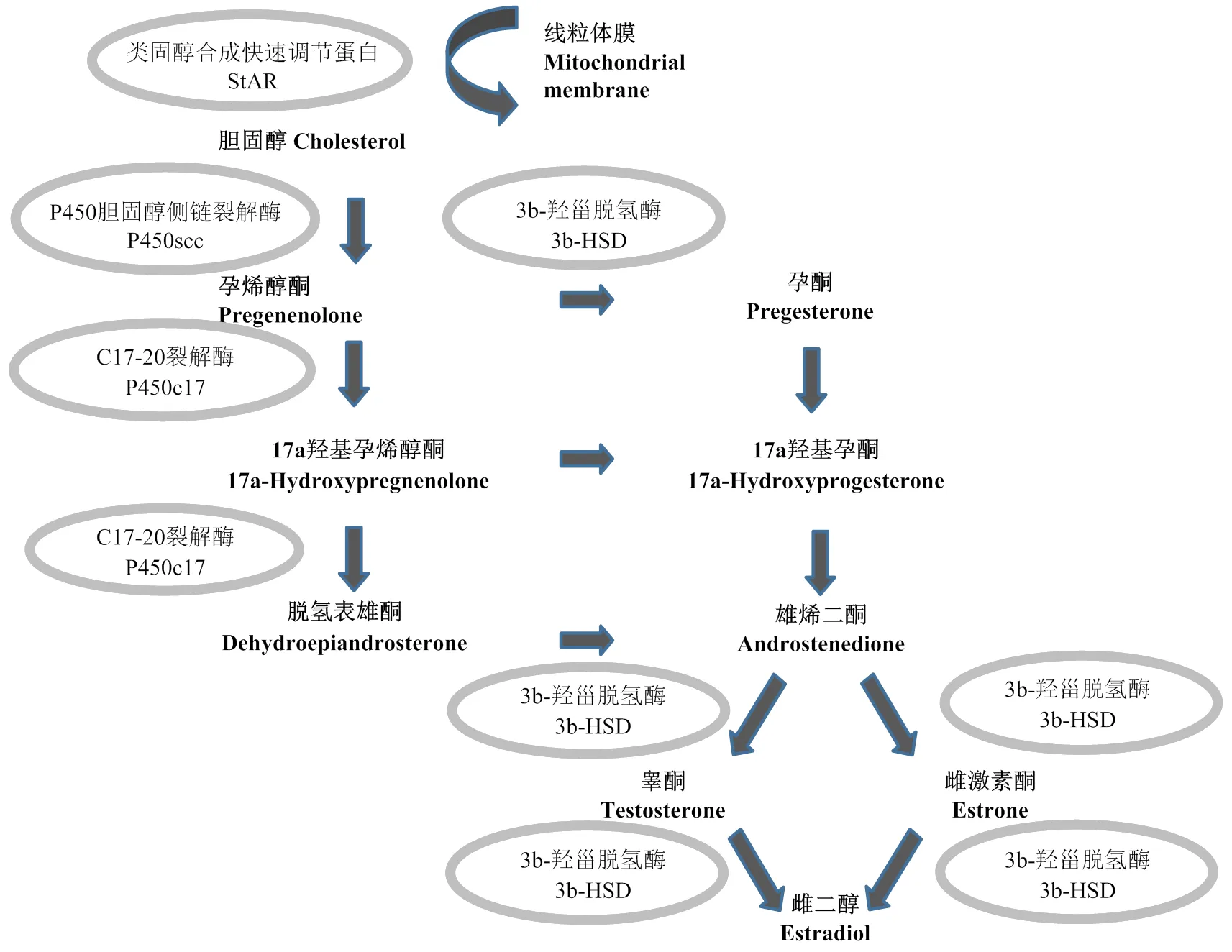
类固醇用加粗表示,相应合成酶用椭圆表示 Steroid hormones are in bold, steroidogenic enzymes are encircled
3.3 FSH处理对凋亡相关基因没有显著影响
对抗凋亡基因X连锁凋亡抑制蛋白(XIAP)和凋亡标志基因FasL-2的表达水平的检测证明FSH处理对这2个基因表达没有显著影响。在体内试验和体外培养的卵泡中均有研究证实FSH处理能上调XIAP表达水平[26-27],而下调FasL的表达水平[28]。但由于体外培养的颗粒细胞模型与完整卵泡相比,在FSH应答方面有一定差异,单独的FSH处理不足以引起XIAP和FasL-2的转录变化,但与其他激素,如甲状腺激素三碘甲状腺氨酸(T3)的联合处理则能诱导这两个基因的显著变化[29]。
3.4 FSH处理对调控区组蛋白修饰的影响具有基因特异性
目前,对FSH处理的颗粒细胞模型中组蛋白修饰变化的研究鲜有报道,卵泡中的组蛋白修饰研究较多集中在黄体化过程中,在黄体化的大鼠体内试验中,卵巢颗粒细胞对LH的应答使STAR和CYP19A1转录水平发生变化,而这些变化与H4ac和H3K4me3修饰显著相关[30]。DEBORAH等证实了全染色质水平的H3S10磷酸化在FSH处理24h后有显著上升[31]。本研究首次在基因水平上对体外培养的猪颗粒细胞组蛋白修饰对FSH处理的反应进行了检测,结果证明组蛋白修饰具有基因特异性。在3个受FSH调控上调的类固醇合成酶基因中,HSD3B的调控区组蛋白H3K4me2、H3K4me3、H3K9ac和H3K14ac修饰显著提升,CYP19A1基因调控区的H3K4me3修饰也有显著上升,这些修饰在多数情况下均与转录活化相关[32];相反,STAR和CYP19A1基因调控区的H3K9ac在处理后有所下降,可见FSH处理对调控区组蛋白修饰的影响具有基因特异性。
4 结论
FSH处理让卵泡类固醇合成3个主要合成酶基因STAR、HSD3B和CYP19A1的表达量有了显著上升,CYP11A1应答较为缓慢。FSH对垂体激素受体和凋亡相关基因的诱导具有时间上和物种间的差异,也与体外培养的条件有关。对上游调控区组蛋白的检测发现这些基因的表达变化与组蛋白修饰有关,其中HSD3B的表达增高伴随着组蛋白H3K4me2、 H3K4me3、H3K9ac和H3K14ac修饰的显著提升。本研究为进一步完善FSH对卵巢颗粒细胞的影响及调控机理提供了参考。
[1] TURNER B M. Histone acetylation and an epigenetic code.2000, 22(9): 836-845.
[2] KOUZARIDES T. Histone methylation in transcriptional control., 2002, 12(2): 198-209.
[3] ROSSETTO D, AVVAKUMOV N, COTE J. Histone phosphorylation.2012, 7(10): 1098-1108.
[4] QIN W, WOLF P, LIU N, LINK S, SMETS M, MASTRA F L, FORN, EACUTE I, PICHLER G, H RL D, FELLINGER K. DNA methylation requires a DNMT1 ubiquitin interacting motif (UIM) and histone ubiquitination.2015, 25(8): 911-929.
[5] MESSNER S, HOTTIGER M O. Histone ADP-ribosylation in DNA repair, replication and transcription.2011, 21(9): 534.
[6] GOUGEON A. Dynamics of follicular growth in the human: a model from preliminary results., 1986, 1(2): 81-87.
[7] HUNZICKERDUNN M, MAIZELS E T. FSH signaling pathways in immature granulosa cells that regulate target gene expression: Branching out from protein kinase A.2006, 18(9): 1351-1359.
[8] ASAHARA S, SATO A, ALJONAID A A, MARUO T. Thyroid hormone synergizes with follicle stimulating hormone to inhibit apoptosis in porcine granulosa cells selectively from small follicles.2003, 49(5-6): 107-116.
[9] MAKRIGIANNAKIS A, COUKOS G, CHRISTOFIDOU- SOLOMIDOU M, MONTAS S, COUTIFARIS C. Progesterone is an autocrine/paracrine regulator of human granulosa cell survival, 2000, 900(1): 16-25.
[10] PAYNE A H, HALES D B. Overview of steroidogenic enzymes in the pathway from cholesterol to active steroid hormones., 2005, 25(6): 947-970.
[11] CHRISTENSON L K, STOUFFER R L, RD S J. Quantitative analysis of the hormone-induced hyperacetylation of histone H3 associated with the steroidogenic acute regulatory protein gene promoter., 2001, 276(29): 27392-27399.
[12] RODGERS R J, RODGERS H F, WATERMAN M R, SIMPSON E R. Immunolocalization of cholesterol side-chain-cleavage cytochrome P-450 and ultrastructural studies of bovine corpora lutea., 1986, 78(2): 639-652.
[13] BELIN F, GOUDET G, DUCHAMP G, G RARD N. Intrafollicular concentrations of steroids and steroidogenic enzymes in relation to follicular development in the mare., 2001, 62(5): 1335.
[14] LI H, CHEN Y, YAN L Y, QIAO J. Increased expression of P450scc and CYP17 in development of endogenous hyperandrogenism in a rat model of PCOS., 2013, 43(1): 184-190.
[15] MURRAY A A, SWALES A K, SMITH R E, MOLINEK M D, HILLIER S G, SPEARS N. Follicular growth and oocyte competence in the in vitro cultured mouse follicle: effects of gonadotrophins and steroids., 2008, 14(2): 75-83.
[16] KRISHANPAL K, KREBS A R, MUSTAPHA O A, HIROSHI K, LASZLO T. H3K9 and H3K14 acetylation co-occur at many gene regulatory elements, while H3K14ac marks a subset of inactive inducible promoters in mouse embryonic stem cells., 2012, 13(1): 424.
[17] KLEIN B J, SIMITHY J, WANG X, AHN J W, ANDREWS F H, YI Z, C T J, SHI X, GARCIA B A, KUTATELADZE T G. Recognition of Histone H3K14 Acylation by MORF., 2017.
[18] LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method., 2001, 25(4): 402-408.
[19] HOWLES C M. Role of LH, FSH in ovarian function., 2000, 161(1-2): 25-30.
[20] LIU Z, RUDD M D, HERNANDEZGONZALEZ I, GONZALEZROBAYNA I, FAN H Y, ZELEZNIK A J, RICHARDS J S. FSH and FOXO1 regulate genes in the sterol/steroid and lipid biosynthetic pathways in granulosa cells., 2009. 23(5): 649-661.
[21] TILLY J L, LAPOLT P S, HSUEH A J. Hormonal regulation of follicle-stimulating hormone receptor messenger ribonucleic acid levels in cultured rat granulosa cells., 1992, 130(3): 1296-1302.
[22] LU C, YANG W, CHEN M, LIU T, YANG J, TAN P, LI L, HU X, FAN C, HU Z. Inhibin A inhibits follicle-stimulating hormone (FSH) action by suppressing its receptor expression in cultured rat granulosa cells.2009, 298(1-2): 48-56.
[23] WEI S, GONG Z, SHENG L, LIANG H, LAI L, DENG Y. Maturation rates of oocytes and levels of FSHR, LHR and GnRHR of COCs response to FSH concentrations in IVM media for sheep.2017, 15(3): 180-186.
[24] LUO W, WILTBANK M C. Distinct Regulation by Steroids of Messenger RNAs for FSHR and CYP19A1 in Bovine Granulosa Cells., 2006, 75(2): 217-225.
[25] ERICKSON G F, WANG C, HSUEH A J W. FSH induction of functional LH receptors in granulosa cells cultured in a chemically defined medium.1979, 279(5711): 336-338.
[26] WANG Y, RIPPSTEIN P U, TSANG B K. Role and gonadotrophic regulation of X.2003, 68(2): 610-619.
[27] WANG Y, ASSELIN E, TSANG B K, Involvement of transforming growth factor α in the regulation of rat ovarian x-linked inhibitor of apoptosis protein expression and follicular growth by follicle- stimulating hormone1.2002, 66(6): 1672-1680.
[28] LIN P, RUI R. Effects of follicular size and FSH on granulosa cell apoptosis and atresia in porcine antral follicles.2010, 77(8): 670-678.
[29] ZHANG C, XIA G, TSANG B K. Interactions of thyroid hormone and FSH in the regulation of rat granulosa cell apoptosis., 2011, 3(4): 1401-1413.
[30] LEE L, ASADA H, KIZUKA F, TAMURA I, MAEKAWA R, TAKETANI T, SATO S, YAMAGATA Y, TAMURA H, SUGINO N. Changes in histone modification and DNA methylation of the StAR and Cyp19a1 promoter regions in granulosa cells undergoing luteinization during ovulation in rats., 2013, 154(1): 458-470.
[31] DEMANNO D A, COTTOM J E, KLINE M P, PETERS C A, MAIZELS E T, HUNZICKERDUNN M. Follicle-stimulating hormone promotes histone H3 phosphorylation on serine-10., 1999, 13(1): 91-105.
[32] RIDDIHOUGH G. Deciphering the histone code.2016, 352(6286): 668-670.
(责任编辑 林鉴非)
Effects of FSH Treatment on Steroidogenic Enzymes Expression and Histone H3 Modification in Pig Granulosa Cells
ZHANG JinBi, YAO Wang, PAN ZengXiang, LIU HongLin
(College of Animal Science and Technology, Nanjing Agricultural University, Nanjing 210095)
【Objective】The objective of this study was to explore whether FSH treatment affect expressions of genes including steroidogenic enzymes, pituitary hormone receptors and apoptosis related genes in porcine granulosa cells, and to detect the histone H3 modification on specific gene regulation regions involved in this process. 【Method】 Firstly, ovary granulosa cells were collected using syringe extraction method from porcine ovaries and cultured in media with serum until the cells attached. After 16 h of non-serum culture, granulosa cells were treated by 5 IU∙mL-1FSH for another 24 h culture and harvested for following experiment. Secondly, transcriptional expression changes of steroidogenic enzymes (STAR, CYP11A1, HSD3B and CYP19A1), pituitary hormone receptors (FSHR and LHR) and apoptosis related genes (XIAP and FasL) were detected using qRT-PCR method. Finally, histone H3 modification (H3K4me2, H3K4me3, H3K9ac and H3K14ac) status on regulatory regions of STAR, CYP19A1 and HSD3B genes were detected by ChIP-qPCR.【Result】 Treatment of 5 IU∙mL-1FSH induced a significant upregulation of STAR, CYP19A1 and HSD3B genes with fold changes of 2 (<0.01), 2.8 (<0.0), and 3.6 (<0.05), respectively, but had no significant effect on CYP11A1, pituitary hormone receptors FSHR, LHR and apoptosis related genes XIAP, FasL. Among the three steroidogenic genes, the histone modifications of HSD3B regulatory region were the most significant. The fold change of H3K4me2, H3K4me3, H3K9ac and H3K14ac was 14.7 (<0.01), 13.6 (<0.01), 19.7 (<0.01) and 2.5 (<0.05), respectively. H3K9ac on STAR gene regulation region decreased 11.1 (<0.01) times. H3K4me3 on CYP19A regulation region increased 0.5 (<0.01) times while H3K9ac decreased 10.4 (<0.01) times. Other histone modification changes were not significant. 【Conclusion】24 h of FSH treatment enhanced the transcription levels of steroidogenic enzymes in pig granulosa cells. The up-regulation process involved H3 histone modifications in a gene-specific manner. Independent FSH treatment was not capable to induce significant effect on candidate pituitary hormone receptor and apoptosis related genes.
pig; FSH; granulosa cells; steroidogenic enzymes; histone modification
10.3864/j.issn.0578-1752.2018.18.014
2017-04-25;
2018-07-06
国家自然科学基金重点项目(31630072)、江苏省自然基金(No. BK20160721 & BK20161453)
张金璧,E-mail:zhangjinbi@njau.edu.cn。通信作者刘红林,E-mail:liuhonglin@njau.edu.cn

