优选发酵毕赤酵母与酿酒酵母混合发酵的葡萄酒酿造应用潜力
陈景桦, 马小琛, 李 婷, 胡朱瑞, 邓凯瑞, 陶永胜,2,*
(1.西北农林科技大学 葡萄酒学院, 陕西 杨凌 712100; 2.陕西省葡萄与葡萄酒工程技术研究中心, 陕西 杨凌 712100)
非酿酒酵母和酿酒酵母普遍存在于葡萄、酿酒设备和酒窖环境中,其中葡萄是酵母菌的主要来源。无论是自然发酵还是接种酵母菌进行发酵,酿酒酵母因其较高的酒精转化率和酒精耐受性能够保证发酵的顺利进行和完成。非酿酒酵母,酒精转化率低、酒精和SO2耐受性较差,一般在发酵过程中会产生较高的挥发酸,引起葡萄酒风味的不良变化,因此最初被认为是导致葡萄酒破败的酵母[1-2]。近年来,通过非酿酒酵母与酿酒酵母的混合酒精发酵,研究人员开始重新评价优选非酿酒酵母在葡萄酒酿造过程中的作用,越来越多的研究者开始关注非酿酒酵母生成的代谢产物对葡萄酒风味的影响[3-4]。研究发现,与酿酒酵母相比,一些优选非酿酒酵母具有较高的糖苷酶活性,能够在酒精发酵过程中促进葡萄香气糖苷的水解,增加葡萄酒典型的品种香气[5]。另有一些非酿酒酵母在发酵过程中能够表现出较高的酯酶活性,调节葡萄酒中酯类的平衡,从而增加葡萄酒的果香特征[6-7]。另有研究得出,非酿酒酵母和酿酒酵母混合发酵过程中生成的主要副产物,甘油、挥发酸、琥珀酸和乳酸等能够影响葡萄酒的风味质量。其中,甘油能够提高葡萄酒的黏稠度,影响葡萄酒的口感和甜度[8];挥发酸、琥珀酸和乳酸是酵母代谢过程中生成的重要酸,不仅影响葡萄酒的酸感和平衡,还会增加葡萄酒的风味[9],是评价优选非酿酒酵母酿造特性的客观依据。
实验菌株为发酵毕赤酵母,该菌株与酿酒酵母在混合发酵过程中酯酶活性较高,能够增加葡萄酒中酯类物质的含量[10]。本实验通过模拟葡萄汁的发酵研究优选发酵毕赤酵母与酿酒酵母混合发酵过程中乙醇、甘油、琥珀酸、乳酸和挥发酸的生成动力学,从而较全面的评价其与酿酒酵母混合发酵对葡萄酒感官质量的影响,为实现该酵母在葡萄酒酿造生产实践中的应用提供技术指导。
1 材料与方法
1.1 菌种材料
菌株为川南白酒窖池中分离得到的发酵毕赤酵母Z9Y-3,Pichiafermentans,以下简称P.F;法国Laffort葡萄酒辅料公司的Actiflore F33商业酿酒酵母,Saccharomycescerevisiae,以下简称S.C。本实验中,发酵毕赤酵母与商业酿酒酵母F33的菌落形态特征如表1。

表1 酵母的菌落形态
1.2 实验试剂
D-葡萄糖、琼脂、酵母浸粉、蛋白胨、氢氧化钠、盐酸、次甲基蓝、酚酞、EDTA-Na、硫酸铵、磷酸二氢钾、氯化钠、硫酸锰、高碘酸钠、丙三醇、七水合硫酸镁、一水合柠檬酸、苹果酸、酒石酸、鼠李糖、乙酸铵、冰醋酸、乙酰丙酮,均为分析纯,四川西陇化工股份有限公司。乙酸、乳酸、琥珀酸、磷酸、磷酸二氢钠,均为色谱纯,上海源叶生物科技有限公司。
1.3 实验仪器
TGL- 16M型台式高速冷冻离心机,长沙湘仪离心机仪器有限公司;KH- 500DE型数控超声波清洗器,中国禾创仪器有限公司;GB85DA型灭菌锅,厦门致微仪器有限公司;MP- 250B型霉菌培养箱,上海南荣实验室设备有限公司;HH- S6型电热恒温水浴锅,北京科伟永兴仪器有限公司;DGX- 9243BC型鼓风干燥箱,上海南荣实验室设备有限公司;NRY- 1102C型全温摇床,上海南荣实验室设备有限公司;BX51型光学显微镜,日本Olympus公司;LC- A10型高效液相色谱仪,中国岛津管理有限公司。
1.4 模拟发酵汁的配方
模拟发酵汁的制作参考Contreras等[11]的方法,稍有修改。葡萄糖100 g/L,果糖100 g/L,酵母浸粉1 g/L,硫酸铵2 g/L,柠檬酸0.3 g/L,苹果酸5 g/L,酒石酸5 g/L,七水合硫酸镁0.4 g/L,磷酸二氢钾5 g/L,氯化钠 0.2 g/L,硫酸锰 0.05 g/L,pH值调至3.5。
1.5 培养条件
实验菌株于YEPD培养基中28 ℃培养48 h,活化好的菌株再于扩增培养基28 ℃,160 r/min摇床培养72 h,最后将培养好的菌株按照106CFU/mL细胞浓度接种于模拟葡萄汁中启动发酵。
1.6 混合发酵接种方案
设计4组不同的模拟葡萄汁酒精发酵处理方案。1)对照组:仅接种菌液浓度为2×106CFU/mL酿酒酵母或发酵毕赤酵母进行单一发酵。2)实验组:S0组为同时接种菌液浓度为1×106CFU/mL的酿酒酵母和发酵毕赤酵母;S48组为提前接种1×106CFU/mL发酵毕赤酵母,48 h后接种1×106CFU/mL酿酒酵母。模拟发酵为22 ℃恒温静止发酵,每隔24 h取样。
1.7 酵母数量测定
模拟发酵体系取样前摇瓶,使沉淀的菌体均匀分布在发酵液中,每隔24 h于发酵液中取一定体积模拟酒样。利用血球计数板在显微镜下直接观察计数测定酵母总数[12]。利用平板计数法观察记录菌落数,对不同发酵处理下酵母生长情况进行监测。
1.8 指标的测定
还原糖含量采用斐林试剂法[12];乙醇采用密度瓶法[12];挥发酸采用水蒸气蒸馏法,以醋酸计[12];甘油采用高碘酸钠氧化法[13];琥珀酸、乳酸采用高效液相色谱法[14]。
1.9 统计分析
实验数据通过Origin Pro 8.5完成。
2 动力学模型的建立
2.1 菌体生长动力学模型
通过Logistic方程来建立菌体生长动力学模型,对酵母生长进行非线性拟合[15],见式(1)。
(1)
t为发酵时间,d;X为t时刻菌体浓度,CFU/mL;Xm为最大菌体浓度,CFU/mL;k为最大比生长速率,d-1。
2.2 底物消耗动力学模型
利用Luedeking-Piret方程建立底物消耗动力学模型,对底物消耗进行非线性拟合[15],见式(2)。

(2)

2.3 产物生成动力学模型
利用Luedeking-Piret方程建立产物生成动力学模型,对生成的产物进行非线性拟合[16],见式(3)。
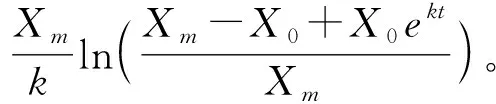
(3)
式(3)中,Y为产物产量,g/L;Y0为产物最初含量,g/L;t为发酵时间,d-1;Xt为t时刻菌体浓度,CFU/mL;ɑ为产物生长偶联参数;β为非生长偶联参数。
3 结果与分析
3.1 酵母生长动力学模型分析
对4组不同模拟葡萄汁酒精发酵过程中两种酵母的生长情况进行非线性拟合,结果见图1。
混合发酵处理的酵母生长动力学见图1。图1(a,b,c)为混合酒精发酵过程中活菌数的生长情况,生长周期为16 d,图1(d)为不同发酵处理的总酵母数,待酒精发酵结束测定了18 d。发酵毕赤酵母和酿酒酵母很快进入对数期,分别于第7天和第8天后进入稳定期,发酵毕赤酵母的菌体生长速率低于酿酒酵母。同时接种混合发酵2 d后,发酵毕赤酵母活菌数接近酿酒酵母,酵母浓度达到最大值(0.89×106CFU/mL)后开始下降,第4天消失,酿酒酵母活菌数第8天达到最大值(5.2×107CFU/mL)后进入稳定期。顺序接种混合发酵10 d后酿酒酵母进入稳定期,活菌数达到最大值(7×107CFU/mL),发酵毕赤酵母活菌数第4天达到最大值(2.1×107CFU/mL),第7天消失。与酿酒酵母相比,顺序接种混合发酵酿酒酵母的对数生长期延长2 d,酵母总菌数第10天达到最大值(7.6×107CFU/mL)后进入稳定期,且酵母总菌数最高。

图1 不同模拟发酵中两种酵母的生长变化情况Fig.1 Growth of two yeasts in different model fermentations

图2 不同模拟发酵体系中还原糖和乙醇的变化情况Fig.2 Variation of reducing sugar and alcohol contents during different model fermentations
3.2 还原糖消耗动力学模型分析
混合发酵处理的底物消耗动力学见图2。3种不同接种处理发酵结束时残糖范围1.8~2.5 g/L,发酵毕赤酵母单一发酵终止时残糖为140 g/L,还原糖消耗速率最慢。发酵毕赤酵母酒精发酵过程中乙醇增长缓慢,发酵结束时生成的乙醇含量最低,约为φ=4.6 %。混合发酵过程中生成的乙醇含量略高于酿酒酵母,其中同时接种处理发酵生成的乙醇含量最高,约φ=13.6%。
模拟发酵中酵母生长动力学参数结果也见表2,各酵母生长模型的R2在0.93~0.95,拟合度较高,能够较好地反映模拟葡萄汁发酵过程中酵母的生长规律。其中酿酒酵母发酵和发酵毕赤酵母的各项发酵参数(Xm,B,k)相差较大,说明两种酵母在发酵过程中的生长模型完全不同。对于混合发酵而言,同时接种与酿酒酵母发酵的酵母生长模型较为接近,而顺序接种发酵模式下的酵母生长模型与酿酒酵母发酵存在明显区别。模拟葡萄汁还原糖消耗和乙醇生成动力学参数结果见表2,不同发酵处理下还原糖消耗模型的R2达到0.99,乙醇生成模型的R2在0.96~0.98,拟合度较高,能够较好地反映模拟葡萄汁发酵过程中还原糖消耗和乙醇的生成情况。其中酿酒酵母和发酵毕赤酵母的各项发酵参数(ɑ,β)相差较大,说明两种酵母在发酵过程中的还原糖消耗和乙醇生成模型完全不同。对于混合发酵而言,同时接种与顺序接种发酵模式下的还原糖消耗和乙醇生成模型与酿酒酵母发酵较为接近。
由不同发酵体系中酵母生长、糖消耗和乙醇生成的动力学结果分析可知,混合发酵过程中优选发酵毕赤酵母的活动不会影响酒精发酵的顺利进行和发酵完全。
表2 不同模拟葡萄汁混合发酵过程中酵母生长、糖消耗和乙醇生成动力学参数
Tab.2 Kinetic parameters of yeasts growth, sugar consumption and alcohol production during different model fermentations

项目相关参数组别S.C组P.F组S0组S48组酵母Xm/(106CFU·mL-1)6.7044.2618.1168.780生长B4.67422.67016.30145.919K0.5150.8240.8940.826R20.9530.9150.9380.942还原糖ɑ13.43432.6667.5085.481β0.7002.2120.9501.113R20.9920.9730.9940.999乙醇ɑ0.5100.1751.3751.147β0.0970.2950.1250.115R20.9540.9830.9840.983
3.3 主要副产物生成动力学模型分析

图3 不同模拟葡萄汁混合发酵体系中主要副产物生成情况Fig.3 Production of main by-products during different model fermentations
混合发酵处理的主要副产物生成动力学见图3。发酵毕赤酵母酒精发酵过程中甘油增长缓慢,生成的甘油含量最低,约1.55 g/L。酿酒酵母和同时接种处理混合发酵过程中甘油不断增加,第10天增速开始变缓。混合发酵过程中生成的甘油含量略高于酿酒酵母,其中顺序接种处理生产的甘油含量最高,约2.74 g/L。酿酒酵母和发酵毕赤酵母发酵过程中挥发酸增长较快,最终的挥发酸含量为0.41、0.35 g/L。同时接种处理生成的挥发酸含量不断增加,第8天趋于稳定,发酵结束时挥发酸浓度为0.28 g/L。顺序接种处理发酵过程中生成的挥发酸含量不断增加,第10天趋于稳定。混合发酵处理过程中生成的挥发酸含量低于单发酵,尤其是顺序接种处理,约0.21 g/L。发酵过程中生成的琥珀酸呈先增后降的趋势。发酵毕赤酵母生成的琥珀酸含量不断增加,第8天达到最大值(0.74 g/L),随后开始下降,发酵结束时琥珀酸浓度为0.41 g/L。酿酒酵母酒精发酵过程中琥珀酸的增长缓慢,第9天达到最大值0.47 g/L。同时接种和顺序接种处理发酵过程中琥珀酸的增长速率接近,第9天达到最大值(0.58、0.76 g/L)后开始下降,其中顺序接种处理最终的琥珀酸含量最低0.20 g/L。发酵过程中生成的乳酸含量呈先增后降的趋势。酿酒酵母酒精发酵过程中乳酸增长较快,第8天达到最大值0.42 g/L。同时接种处理发酵过程中生成的乳酸含量不断增加,第8天达到最大值(0.28 g/L)后开始下降,最终的乳酸含量为0.12 g/L。顺序接种处理在发酵过程中乳酸含量不断增加,第10天乳酸含量达到最大值(0.3 g/L)后开始下降,发酵结束时乳酸含量为0.13 g/L。混合发酵过程中生成的乳酸含量略低于酿酒酵母。
主要副产物生成动力学参数结果见表3,不同发酵处理下主要副产物生成模型的R2在0.96~0.99,拟合度较高,能够较好地反映模拟葡萄汁发酵过程中主要副产物的生成规律。其中,甘油生成动力学结果表示,酿酒酵母和发酵毕赤酵母发酵的各项发酵参数(ɑ,β)相差较大,说明两种酵母在发酵过程中甘油生成模型完全不同。对于混合发酵而言,同时接种与顺序接种发酵模式下的甘油生成模型与酿酒酵母发酵较为接近。结合混合酒精发酵过程中,琥珀酸和乳酸先增后降的变化趋势,对混合酒精发酵过程中琥珀酸和乳酸前期生长的情况进行非线性拟合。挥发酸、琥珀酸和乳酸动力学结果表示,不同发酵处理的各项发酵参数(ɑ,β)相差较大,说明不同接种处理发酵过程中挥发酸、琥珀酸和乳酸的生成模型完全不同。

表3 不同模拟葡萄汁混合发酵中主要副产物的生成动力学参数
结合主要副产物生成动力学结果分析,与酿酒酵母单发酵相比,混合发酵生成的琥珀酸和乳酸含量基本不变,挥发酸略有降低,甘油含量增加,说明优选发酵毕赤酵母与酿酒酵母混合发酵对葡萄酒的酸感影响不明显,但能够增加甘油的含量,从而可以提高葡萄酒的酒体圆润度。
4 讨论与结论
受消费者对葡萄酒风味多样化需求的影响,非酿酒酵母和酿酒酵母混合发酵及其接种策略的研究已成为当前葡萄酒风味调控的焦点。Nissen等[17]研究发现,两种非酿酒酵母(戴尔凯氏有孢圆酵母Torulasporadelbrueckii和克鲁维耐热酵母Kluyveromycesthermotolerans)纯发酵时酵母对数期的生长速率与酿酒酵母较为一致,而稳定期的酵母数量低于酿酒酵母。Sadineni等[18]发现美极梅奇酵母(Metschnikowiapulcherrima)与酿酒酵母同时接种对酿酒酵母的生长影响不明显,而戴尔有孢圆酵母与酿酒酵母混合接种发酵时,随着接种比例增加,能够影响酿酒酵母的生长代谢。Rodríguez等[19]发现顺序接种(96 h)混合发酵过程中酿酒酵母的数量低于单一酿酒酵母,但酵母总数高于酿酒酵母纯发酵。本实验结果显示,同时接种处理的酿酒酵母数量略低于单一酿酒酵母,优选发酵毕赤酵母第4天开始衰亡至无法检出,而顺序接种处理的酿酒酵母在第5~6天开始占主导地位,优选发酵毕赤酵母存活时间更长(7 d),酵母总数最多。本实验结果与上述研究不同,其原因可能是从川南白酒窖池中优选得到的发酵毕赤酵母,长期处于白酒的酿造环境中,形成不同的生长特性。
葡萄酒中乙醇的含量范围φ=8%~16%,影响葡萄酒的热感、酒体和黏稠度,同时还会影响葡萄酒风味化合物的感知度,近年来优选非酿酒酵母作为潜在的控制葡萄酒酒精度的工具受到强烈关注。研究发现[17-19]一些酒精耐受性较高的非酿酒酵母(φ=10.5%~12.5%),如季也蒙有孢汉逊酵母(Hanseniasporaguillicrmondii)、戴尔有孢圆酵母和克鲁维耐热酵母与酿酒酵母混合发酵酿造的葡萄酒酒精含量均低于酿酒酵母纯发酵。本实验结果显示,同时接种优选发酵毕赤酵母混合发酵积累的乙醇与酿酒酵母纯发酵相比稍有增加。
甘油,作为酵母代谢第二大产物,甘油的存在有利于增强葡萄酒的圆润感和甜度,并有助于提高葡萄酒香气和风味的复杂性[8]。有研究表明,星形假丝酵母(Candidastellata)所酿造的葡萄酒中甘油含量可高达14 g/L,并且与酿酒酵母顺序接种发酵对葡萄酒化学成分和感官特征产生的影响比同时接种发酵更为明显[20]。另有研究发现,发酵毕赤酵母和酿酒酵母混合发酵也能够显著提高葡萄酒中甘油的含量[21]。本试验结果显示,采用优选发酵毕赤酵母与酿酒酵母顺序接种发酵生成的甘油含量高于酿酒酵母纯发酵(7%),说明延迟接种酿酒酵母来支持优选发酵毕赤酵母菌株的生长,能够提高发酵过程中甘油的生成,对提高葡萄酒质量有积极影响。
乙酸占葡萄酒总挥发酸的90%以上,是酒精发酵中定量评价和感官分析最重要的挥发酸,其含量范围在0.2~1.1 g/L,随着乙酸浓度的增加,葡萄酒表现出醋味,酿酒酵母产乙酸含量约0.3 g/L,而非酿酒酵母发酵过程中往往会产生较高的挥发酸[20-21]。但是,一些混菌共发酵研究表明,非酿酒酵母与酿酒酵母混合发酵过程中会产生一些挥发酸含量降低的葡萄酒[22-23]。Lachanceathermotolerans与酿酒酵母的顺序发酵中,挥发酸含量低于0.3 g/L[24]。Jemec等[25]研究也发现,酒精转换率较低的葡萄汁有孢汉逊酵母(Hanseniasporauvarum),产乙酸含量高(0.8~2.5 g/L),在与酿酒酵母同时接种发酵的葡萄酒中乙酸的含量却降低。本实验结果显示,优选发酵毕赤酵母和酿酒酵母混合发酵过程中生成的挥发酸含量略低于酿酒酵母纯发酵,尤其是顺序接种,不会对葡萄酒香气产生负面影响。
葡萄酒中主要的有机酸是酒石酸,其次是苹果酸,它们从酸感上支撑葡萄酒的酒体。酒石酸在葡萄酒中的含量较为稳定,酒精发酵过程中酵母一般不代谢酒石酸和苹果酸。琥珀酸和乳酸是发酵过程中酵母代谢产生的主要有机酸,引起酸感变化,过多的琥珀酸还会给葡萄酒带来不寻常的咸味和苦味[9]。最近研究表明,东方伊萨酵母(Issatchenkiaorientalis)纯发酵生成的琥珀酸含量相对较高,但其与酿酒酵母顺序接种后的混合发酵生成的琥珀酸含量较低,葡萄酒口感平衡,果香较好[26]。本实验结果显示,优选菌株混合发酵处理中琥珀酸含量无明显增高,并且顺序接种处理比酿酒酵母纯发酵中琥珀酸的含量略有降低,说明优选酵母混合发酵不会增加琥珀酸的含量,避免葡萄酒出现明显的咸味和苦味。乳酸具有宜人的酸性风味,但酒精发酵过程中仅能积累微量的乳酸。有研究发现星型假丝酵母与酿酒酵母同时接种混合发酵生成的乳酸含量会有所增加[20],但本实验结果显示,优选发酵毕赤酵母与酿酒酵母混合发酵不影响葡萄酒中乳酸的含量。
综上,优选发酵毕赤酵母和酿酒酵母混合酒精发酵过程中乙醇、甘油、琥珀酸、乳酸和挥发酸的生成与酵母菌体生长同步,酒精发酵中酵母生长总量达到稳定期时(6~10 d),混合发酵过程中生成的乙醇、甘油、琥珀酸、乳酸和挥发酸达到最大值。与酿酒酵母相比,顺序接种混合发酵中琥珀酸和乳酸含量基本不变,挥发酸含量略有降低,甘油含量增加,说明优选发酵毕赤酵母与酿酒酵母混合发酵对葡萄酒的酸感影响不明显,但甘油的增加能够改善葡萄酒的酒体质量。结合前期优选发酵毕赤酵母与酿酒酵母混合发酵的增香潜力,本实验结果证实该株发酵毕赤酵母与酿酒酵母的混合发酵具有葡萄酒酿造的应用价值。

