不同种植方式大豆根际土壤细菌多样性分析
王 芳 陈井生 刘大伟
不同种植方式大豆根际土壤细菌多样性分析
王 芳1陈井生2刘大伟3
1齐齐哈尔大学生命科学与农林学院/ 抗性基因工程与寒地生物多样性保护黑龙江省重点实验室, 黑龙江齐齐哈尔 161006;2黑龙江省农科院大庆分院, 黑龙江大庆 163316;3东北农业大学农学院, 黑龙江哈尔滨 150030
利用Illumina MiSeq第二代高通量测序平台, 对黑龙江省不同地区轮作及连作大豆根际土壤细菌16S rDNA基因组测序, 初步分析在不同种植方式下受大豆胞囊线虫侵染的大豆根际土壤细菌群落结构的变化。从6个土壤样本中共获得25 419个OTUs, 鉴定到细菌的47个门, 147个纲, 709个属。变形菌门、放线菌门、酸杆菌门、芽单胞菌门、浮霉菌门是供试土壤细菌的优势菌门, 占所有细菌群落总数90%以上。连作4年总OTUs及丰富度最高, 连作20年最低。不同轮作方式土壤细菌丰富度差异不显著(> 0.05), 短期连作与长期连作细菌丰富度及多样性差异显著(< 0.05)。不同轮作方式下放线菌门相对丰度低于连作方式, 芽单胞菌门和拟杆菌门相对丰度高于同地区连作方式。土壤功能细菌根瘤菌()、链霉菌属()、芽孢杆菌属()、溶杆菌属()、土微菌属()的相对丰度在不同年限连作下高于轮作。长期连作土壤优势细菌丰度与轮作土壤相似性更高。
大豆; 轮作; 连作; 细菌多样性; Illumina MiSeq 测序
大豆胞囊线虫病是世界大豆种植区的主要土传病害之一, 中国大豆播种面积70%以上发现有该病的发生, 大豆胞囊线虫成为制约大豆生产的重要病原物[1]。大豆与小麦、玉米、谷子、亚麻、万寿菊等作物轮作, 大豆感病丰产品种-抗病品种-玉米之间的轮作是目前防治该病害的主要措施[2-4]。也有研究表明, 大豆长期连作也可以降低线虫的物种丰度, 连作14年后土壤中胞囊线虫数量极少[5-6]。
作物根际细菌是土壤微生物中的主要群体, 养分活化的驱动者, 对植物根际生物条件具有重要作用, 直接或间接影响病原物的定殖及存活, 甚至一些细菌是植物病原物的拮抗菌[7-8]。国内外学者对不同种植方式下大豆根际细菌群落多样性研究表明, 种植制度对土壤中细菌的定殖、丰度及多样性都产生了影响[9-13]。因此, 鉴定大豆胞囊线虫病在建立及发展过程中不同种植方式对大豆根际细菌群落的影响, 研究这些变化对病害的控制及大豆健康生产具有重要意义。
本研究基于Illumina MiSeq第二代高通量测序平台, 分析不同种植方式下大豆根际细菌菌群丰度及多样性的变化, 探索在大豆胞囊线虫侵染下, 大豆根际细菌菌群对不同种植方式的响应, 为促进大豆健康生长和稳定土壤生产力提供一定的理论依据。
1 材料与方法
1.1 试验小区概况及设计
试验样地设在黑龙江省农业科学院大庆分院与齐齐哈尔分院大豆胞囊线虫病圃试验区。土壤类型为黑钙土。本研究6个试验小区, 包括大豆4年连作(C4, 大庆)、10年连作(C10, 大庆)、20年连作(C20,齐齐哈尔)、大豆轮作1 (茬口设计: RS, 感病品种-大麻-感病品种, 大庆)、大豆轮作2 (RR, 感病品种-大麻-抗病品种, 大庆)、大豆轮作3 (RQ, 玉米-谷子-感病品种, 齐齐哈尔)。
1.2 土壤样品采集
于2016年7月28日至7月29日(大豆盛花期, R2)采集田间土壤样品。选用“Z”字型取样方法, 每个采样小区至少取10个采样点。采样时先将0~5 cm表土去除, 拔出大豆植株根部, 采集紧紧附着大豆根际表面~5 mm土层。将各采集点土壤充分混合均匀, 采用四分法选取土壤, 装于取样袋置冰盒中, 4℃冰箱保存备用。
1.3 土壤细菌总DNA的提取及PCR扩增
取每个土壤样品0.5 g, 按照 Mo BIO Power Soil DNA Kit试剂盒说明书提取土壤微生物基因组DNA。经1.0%琼脂糖电泳检测DNA完整性, Nanodrop测定DNA浓度后, 将DNA样品置-20℃冰箱保存备用。以稀释后的基因组DNA为PCR模板, 采用细菌特异性引物341F/805R扩增16S rDNA-V4区, 同时在上游引物的5¢端添加带6个碱基长度Barcode序列区分样品。PCR反应条件为95℃预变性2 min; 95℃变性30 s, 55℃退火60 s, 72℃延伸90 s, 30个循环; 72℃终止延伸10 min。取5 μL PCR扩增产物进行凝胶电泳检测。使用 Illumina Miseq高通量测序平台(派森诺生物, 上海)上机测序。
1.4 土壤细菌16S rDNA基因测序及原始数据处理
对16S rDNA的V4进行双端测序, 将获得的原始数据进行质量过滤和双端序列的连接, 过滤和去除嵌合体, 统计样品优质序列。应用Qiime软件在97%相似水平下对得到的优质序列进行OUT (Operational Taxonomic Units)聚类和注释。
1.5 物种丰度分析
从样本中抽取一定数量的序列, 统计这些序列代表的OTU数目, 根据序列数及OTU丰度从大到小的排序, 以各个丰度值取log2的对数做丰度分布曲线, 反映样品中物种的分布规律。根据OTU列表中的各样品丰度情况, 利用mothur软件计算4种常用的多样性指数。
1.6 群落结构分析
在各分类水平上进行群落结构分析和物种丰度差异分析。在上述分析的基础上, 在属的水平下进一步对群落结构进行群落组成分析、主成分分析及聚类分析。
1.7 Alpha数据分析
Alpha数据处理及统计分析在SPSS Statistics 17.0中进行, 使用Duncan’s法进行多重比较。
2 结果与分析
2.1 土壤样本OTU稀释曲线分析
利用Illumina MiSeq高通量测序平台, 将获得的原始数据进一步过滤, 去除嵌合体, 共获得优质序列300 726条, 平均50 124条。从6个样本中随机抽取一定数量的序列, 与他们所能代表OTU数目构建稀释曲线, 所有样品平均覆盖率均超过90%, 各样品的稀释曲线趋于平坦, 表明该测序深度趋于饱和, 测序数据量已经基本覆盖样品中的所有物种, 可以反映样品中的物种丰度(图1)。
2.2 丰度分布曲线
对丰度值取log2的对数值得到样品丰度分布曲线图。横轴为OTU相对丰度含量等级降序排列, 纵轴是OTU所占相对丰度比例。由图2可知, 3种轮作土壤样品的曲线斜率较大, 表明轮作下土壤细菌物种多样性、均匀度及各物种的丰度高于连作。

图1 相似度为97%水平下各样品稀释性曲线
RR: 感病品种-大麻-抗病品种; RS: 感病品种-大麻-感病品种; RQ: 玉米-谷子-感病品种; C4: 连作4年; C10: 连作10年; C20: 连作20年。
RR: susceptible variety-hemp-resistant variety; RS: susceptible variety-marijuana-susceptible variety; RQ: corn-millet-susceptible variety; C4: continuous cropping 4 years; C10: continuous cropping 10 years; C20: continuous cropping 20 years.
2.3 Alpha多样性分析
根据OTU列表中各样品物种丰度情况, 应用Alpha多样性反映不同种植方式下大豆根际土壤群落丰富度(Chao指数)和多样性(Shannon指数)。6个土壤样品OTUs数量在3706~4928, 连作4年OTUs数量最高, 连作20年最低。连作4年细菌丰富度最高, 多样性也相对较高; 连作20年土壤丰富度及多样性均为最低。不同轮作方式土壤细菌丰富度差异不显著(>0.05)(表1)。短期连作(4年)与长期连作(10年或20年)细菌丰富度及多样性差异显著(<0.05) (表2)。Shannon指数显示, 大庆4份土壤样品细菌多样性都高于齐齐哈尔地区的2份土壤样品, 不同地区土壤细菌菌群多样性存在明显差异(<0.05)。

图2 6个土壤样品丰度分布曲线
RR: 感病品种-大麻-抗病品种; RS: 感病品种-大麻-感病品种; RQ: 玉米-谷子-感病品种; C4: 连作4年; C10: 连作10年; C20: 连作20年。
RR: susceptible variety-hemp-resistant variety; RS: susceptible variety-marijuana-susceptible variety; RQ: corn-millet-susceptible variety; C4: continuous cropping 4 years; C10: continuous cropping 10 years; C20: continuous cropping 20 years.

表1 不同轮作下大豆根际土壤细菌序列统计及多样性指数
同列数据后不同字母表示处理间有显著差异(< 0.05)。
RR: susceptible variety-hemp-resistant variety; RS: susceptible variety-marijuana-susceptible variety; RQ: corn-millet-susceptible variety. Values within a column followed by different letters are significantly different among treatments at< 0.05.
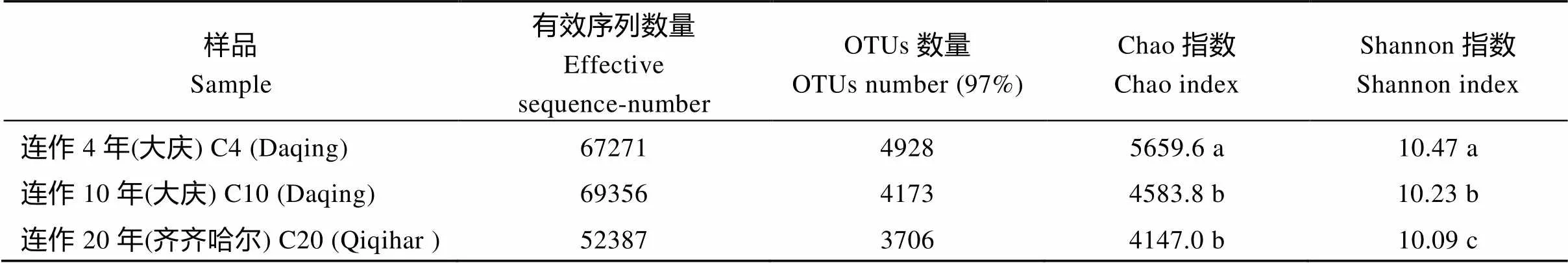
表2 不同连作下大豆根际土壤细菌序列统计及多样性指数
同列数据后不同字母表示处理间有显著差异(< 0.05)。
C4: continuous cropping 4 years; C10: continuous cropping 10 years; C20: continuous cropping 20 years. Values within a column followed by different letters are significantly different among treatments at< 0.05.
2.4 土壤细菌群落结构分析
6个土壤样品细菌菌群在门的层次下, 所含物种基本相似, 鉴定到的OTUs归属于47个菌门(图3)。变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)、芽单胞菌门(Gemmatimonadetes)、浮霉菌门(Planctomycetes)是供试土壤细菌的优势菌门, 占所有细菌群落总数的90%以上。变形菌门中的物种丰度最多, 变化范围为24.95%~36.00%, 均值31.08%; 其次为放线菌门, 变化范围在13.29%~26.96%, 均值18.78%; 酸杆菌门变化范围在12.99%~17.14%, 均值14.86%; 芽单胞菌门变化范围在5.53%~14.30%, 均值7.92%; 浮霉菌门的变化范围在5.40%~9.09%, 均值6.99%。拟杆菌门(Bacteroidetes)、疣微菌门 (Verrucomicrobia)、绿弯菌门(Chloroflexi)、硝化螺旋菌门(Nitrospirae)的物种丰度也相对较高, 均值均超过1%。
不同轮作方式放线菌门的OTUs占数据的14.34%、18.07%、13.29%; 连作下放线菌门的OTUs都有上升的趋势, 分别为21.11%、26.96%、18.92%。轮作下芽单胞菌门OTUs所占比例(8.65%、6.59%、14.30%)高于同地区连作下(5.81%、5.53%、6.63%)的比例。轮作下拟杆菌门OTUs所占比例(7.49%、4.91%、4.71%)高于同地区连作下(2.30%、1.49%、2.19%)的比例。
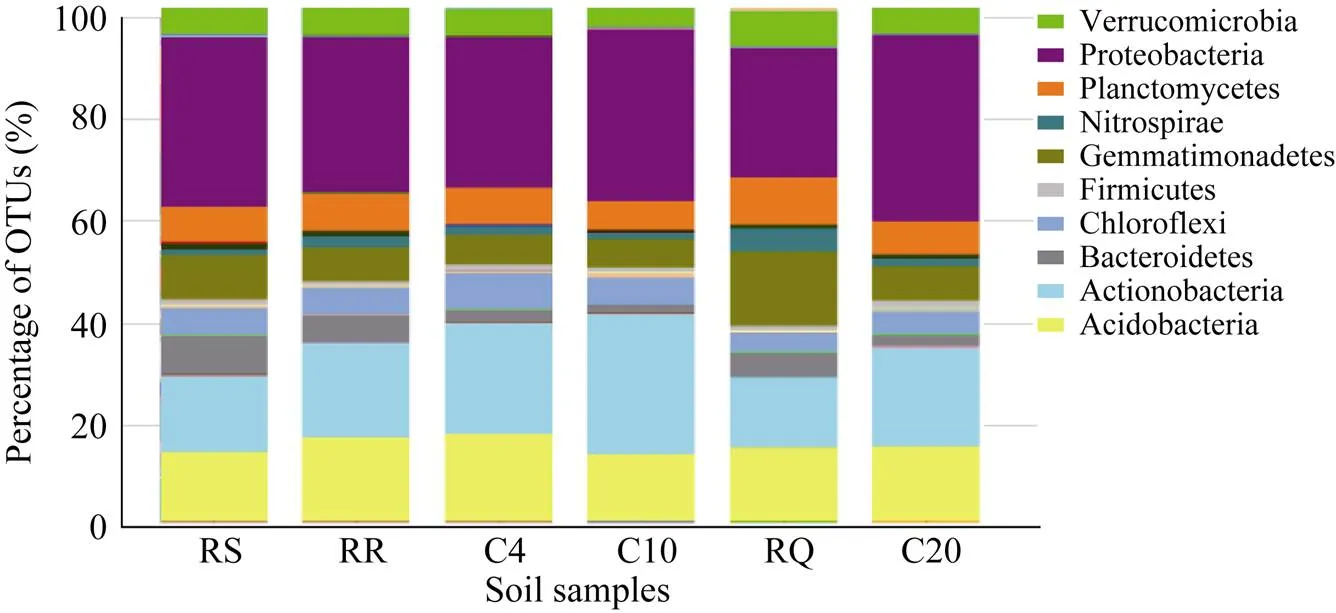
图3 各样品在门水平的群落相对丰度
6个土壤样品细菌类群分布在147个纲(图4)。α-变形菌纲(Alphaproteobacteria)物种数量最多, 占细菌群落占总OTUs数量的14.1%。其次为放线菌纲(Actinobacteria), 均值为9.5%, 酸杆菌纲-6 (Acidobacteria-6), 均值为9.0%。变形菌门下的Deltaproteobacteria、Gammaproteobacteria、Betaproteobacteria细菌丰度也相对较高, 均值分别为7.8%、4.8%和4.3%。Hermoleophilia (5.2%)、Gemmatimonadetes (5.1%)、Chloracidobacteria (3.4%)、Planctomycetia (3.1%)、Phycisphaerae (2.4%)、Pedosphaerae (2.3%)、Nitrospira (2.0%)、Acidimicrobiia (1.9%)、Rubrobacteria (1.6%)、Spartobacteria (1.4%)细菌群落占总OTUs数量也均超过1%。
Actinobacteria和Alphaproteobacteria的细菌丰度在大豆连作之后都明显上升, 平均分别增加4.3%和5.2%。而Gemmatimonadetes的细菌丰度在轮作时高于连作下的菌群丰度, 平均增加2.4%。

图4 各样品在纲水平的群落相对丰度
2.5 群落聚类分析
6个土壤样品细菌类群分布在709个属。应用R (pheatmap)软件, 将所得数据在属的水平上对样品和样品所含菌属丰度相似性进行聚类, 根据聚类后的各样品中不同OTU所含序列的丰度绘制Heatmap图, 利用该图反映样品在菌属水平上细菌群落结构组成的相似性和差异性(图5)。6个土壤样品所含菌落可以分为3个大的分支, 其中最为优势的OTU单元为变形菌门, OTU包含序列最多。从总体上看, 轮作与连作土壤细菌群落结构差异明显。不同年限连作土壤细菌丰度相似性相对较小, 变化明显。连作4年,、、丰度较高。连作10年,、、、、的丰度增加。连作20年土壤细菌丰度与轮作下的细菌菌群相似性更高, 但、、、、、、丰度增加。
2个地区不同轮作方式土壤细菌的丰度相似性较高, 属的丰度变化不明显。、、、、、、、、、细菌丰度较高。
放线菌、、、、及变形菌、、细菌的丰度差异在轮作及连作下变化明显。

图5 样品聚类分析热图
2.6 主成分分析
应用R(vegan)软件绘制PCA图, 对各样品序列之间的内在关系属水平上的多样性进行主成分分析。由图6可知, 主成分1和主成分2分别占40.06%和28.04%。6个土壤样品群落组成可以分成3组, 地域和种植方式对大豆根际土壤细菌群落组成有重要影响, 地域对轮作下细菌多样性的影响高于连作。

图6 6个土壤样品群落主成分分析
3 讨论
本研究利用第二代高通量测序技术, 得到许多难以通过传统的分子生物学方法研究的细菌种群, 这些细菌基本可以代表大豆在不同种植方式下大部分的种类, 6个土壤样品的平均覆盖率均超过90%。由于目前还没有仅应用一种方法就能全面获得土壤微生物种群的信息, 依然有许多菌种未被发现。
本研究发现, 轮作及连作大豆根际细菌优势菌群相似, 主要分布在变形菌门、放线菌门、酸杆菌门、芽单胞菌门、浮霉菌门、拟杆菌门、疣微菌门、绿弯菌门、硝化螺旋菌门、纤维杆菌门等。变形菌是土壤中最丰富的细菌类群, 其中α-变形杆菌是陆地土壤中的优势菌群[14]。本研究分类到变形菌门的物种数量在6个供试土壤样品中均最多, 并且α-变形菌亚群占优势, 与前人研究结果类似[15-17], 表明根际分泌物对其有吸引作用。朱英波等[18]对黑龙江富锦地区2个相邻的大豆土壤细菌多样性分析发现轮作土壤以变形菌为优势类群, 连作以酸杆菌为优势类群。厚壁菌门的物种数量在本实验所有样品中都较低, 平均占总数据的1.0%, 这与Zhu等[15]的研究结果不同, 表明不同门类细菌在不同生态地区, 根际和根围所占比例不同。
大豆连作障碍问题一直是研究的热点, 针对不同类型土壤和不同种植方式下大豆田土壤微生物的变化已有诸多报道。根据生态环境、栽培方式、研究对象以及连作年限的不同, 土壤微生物类群及丰度的变化结果也不尽相同。众多研究者认为大豆连作导致细菌数量减少, 真菌增多。曾有研究证明, 大豆持续连作后土壤细菌、放线菌的丰富度下降, 真菌丰富度增加, 主要原因是大豆根际沉积、根系和叶枯落物以及多年完全相同的田间管理措施导致了一种特殊的有利于病原真菌积累的土壤微生态环境[19-20]。本研究结果发现, 黑龙江西部地区大豆经过短期的连作(4年), 大豆根际细菌群落的多样性和丰富度呈增加现象。此结果与陈雪丽[21]的结果类似, 轮作、连作2年和连作4年处理的土壤多样性指数高于长期连作(7年以上)。前期也有研究发现, 大豆不同年限连作, 细菌仍是主要的微生物类群, 并且根际细菌16S rRNA基因的拷贝数随着连作年限的增加出现了先增加后降低再增加的现象, 短期连作细菌基因组DNA质量略高于20年连作和轮作, 此现象在其他作物连作时也显示出同样的趋势[22-24]。这些结果表明连作对微生物的影响是一个持续积累的过程。
在一种土壤病害爆发之后, 随着作物连作的延长, 病害开始降低, 长期连作导致健康土壤到致病土壤再到抑病土壤的转变[25-26]。连作使土壤出现抑制线虫的现象已在全世界发现[27]。这可能涉及到土壤根际微生物群落结构的变化, 不同功能生物类群结构的交换更替, 一方面有益真菌增加, 有害真菌和植食性线虫减少, 另一方面细菌优势菌群丰度的变更[28]。也有研究表明, 长期连作土壤较短期连作有更多特异性细菌类群存在, 如链霉菌属()和根瘤菌()[16,29]。本研究聚类分析结果显示, 长期连作(20年)的优势细菌丰度与轮作土壤相似性更高, 并且发现随着连作年限的增加, 一些有益菌的丰度高于轮作, 如与固氮有关的根瘤菌和与有机物矿化有关的链霉菌属的丰度。促进植物生长和病原菌有防控作用的芽孢杆菌属()的丰度在连作4年及10年都高于轮作。具有生物防控作用的溶杆菌属()在连作4年和20年也表现出高丰度, 其中spp已用在根结线虫的防治中[30-31]。在不同年限的连作下, 土微菌属()相对丰度也高于轮作。土微菌属能够以烃类污染物为碳源来氧化滞留土壤环境中的铁和锰, 降低对植物的毒害作用[32]。这也表明土壤菌群结构随着连作年限增加处于不断的动态变化过程中, 优势菌群不断交替更新, 越来越接近于轮作土壤。本研究鉴定到一些促进植物生长且有抑制病原菌作用的细菌类群, 该结果对解释大豆长期连作对抑病土壤的形成具有一定价值。这些类群在大豆胞囊线虫病生态控制方面的具体作用待进一步研究。
Zhu等[15]发现放线菌门在健康的大豆植株根际比受到胞囊线虫侵染的土壤中物种数量高。而本研究发现轮作下放线菌门的OTUs占数据的比例、丰度及多样性低于连作下, 且连作时间越长放线菌门所占比例越高。芽单胞菌门及拟杆菌门物种数量所占比例在轮作下高于同地区连作下的比例, 不同年限连作导致这两种种群丰度和多样性都有不同程度的降低, 变化趋势明显。前人一部分发现随着大豆连作年限的增加, 放线菌数量减少, 也有一些研究发现呈增加趋势, 并且在其他作物上也发现类似现象[33-38]。但普遍认为与轮作相比, 连作1~6年土壤微生物三大类群变化的主要特征是细菌总量减少, 真菌总量增加和放线菌变化表现不规律[39]。基于以上研究结果可以说明不同种植方式及生态环境对各类微生物的影响并不一致, 不能一概而论。
4 结论
土壤是一个复杂的生态系统, 种植方式、作物品种甚至是根际范围均与土壤微生物类群密切相关。大豆轮作根际土壤细菌菌群多样性高于连作方式。短期连作, 根际土壤细菌菌群的丰度略有增加; 随着连作年限增加, 细菌菌群丰度及多样性都下降。不同轮作方式细菌菌属丰度差异不明显, 不同年限的连作细菌菌属丰度表现特异性, 土壤功能细菌根瘤菌、链霉菌属、芽孢杆菌属、溶杆菌属、土微菌属在连作下相对丰度较高, 长期连作细菌菌属相似性更接近轮作方式。放线菌及变形菌细菌丰度在不同种植方式下变化明显。
[1] 宋杰. 连作土壤寄生真菌多样性及对大豆胞囊线虫抑制作用. 东北农业大学博士学位论文, 黑龙江哈尔滨, 2016 Song J. Diversity and Suppressive Effect ofParasitic Fungi on Soybean CystNematode in Soybean Monoculture Soil. PhD Dissertation of Northeast Agricultural University, Harbin, China, 2016 (in Chinese with English abstract)
[2] 许艳丽, 刁琢, 李春杰, 潘凤娟, 战丽莉, 田中艳, 张思佳, 胡新. 品种混种方式对大豆胞囊线虫控制作用. 土壤与作物, 2012, 1: 70–78Xu Y L, Diao Z, Li C J, Pan F J, Zhan L L, Tian Z Y, Zhang S J, Hu X. Soybean cultivar mixtures for managing soybean cyst nematode., 2012, 1: 70–78 (in Chinese with English abstract)
[3] 陈立杰, 朱艳, 刘彬, 段玉玺. 连作和轮作大豆对大豆胞囊线虫群体数量及土壤线虫群落结构的影响. 植物保护学报,2007,34: 347–352Chen L J, Zhu Y, Liu B, Duan Y X. Influence of continuous cropping and rotation on soybean cyst nematode and soil nematode community structure., 2007, 34: 347–352(in Chinese with English abstract)
[4] 王进闯, 王敬国. 大豆连作土壤线虫群落结构的影响. 植物营养与肥料学报, 2015, 21: 1022–1031 Wang J C, Wang J G. Effects of continuous soybean monoculture on soil nematode community.,2015, 21: 1022–1031 (in Chinese with English abstract)
[5] 靳学慧, 辛惠普, 郑雯, 台莲梅, 张亚玲, 闫凤云. 长期轮作和连作对土壤中大豆胞囊线虫数量的影响. 中国油料作物学报, 2006, 28: 189–193 Jin X H, Xin H P, Zheng W, Tai L M, Zhang Y L, Yan F Y. Effect of long-term rotational and continuous cropping on soybean cyst nematode number., 2006, 28: 189–193
[6] Hamid M I, Hussain M, Wu Y P, Zhang X L, Xiang M C, Liu X Z. Successive soybean-monoculture cropping assembles rhizosphere microbial communites for the soil suppression of soybean cyst nematode., 2017, 93, doi: 10.1093/femsec/fiw222
[7] Weller D M, Raaijmakers J M, Gardener B B, Thomashow L S. Microbial populations responsible for specific soil suppressiveness to plant pathogens., 2002, 40: 309–348
[8] Mendes R, Kruijt M, de Bruijn I, Dekkers E, Menno van der V M, Schneider J H M, Piceno Y M,DeSantis T Z, Andersen G L, Bakker P A H M, Raaijmakers J M. Deciphering the rhizosphere microbiome for disease-suppressive bacteria., 2011, 332: 1097–1100
[9] 周岚, 杨永, 王占海, 陈阜, 曾昭海. 玉米–大豆轮作及氮肥施用对土壤细菌群落结构的影响. 作物学报. 2013, 39: 2016–2022 Zhou L, Yang Y, Wang Z H, Chen F, Zeng Z H. Influence of maize-soybean rotation and N fertilizer on bacterial community.,2013, 39: 2016–2022(in Chinese with English abstract)
[10] 于镇华, 王艳红, 燕楠, 李彦生, 谢志煌, 金剑. CO2浓度升高对不同大豆品种根际微生物丰度的影响. 土壤与作物. 2017, (6): 9–16 Yu Z H, Wang Y H, Yan N, Li Y S, Xie Z H, Jin J. Effects of elevated CO2on the abundance of rhizosphere bacteria, fungi and denitrification bacteria in different soybean cultivars., 2017, (6): 9–16(in Chinese with English abstract)
[11] Souza R H, Babujia L C, Silva P A, de Fátima Guimarães M, Arias C A, Hungria M. Impact of the ahas transgene and of herbicides associated with the soybean crop on soil microbial communities., 2013, 22: 877–892
[12] Lee Y H, Kim H. Response of soil microbial communities to different farming systems for upland soybean cultivation., 2011, 54, 423–433
[13] Granada C, da Costa P B, Lisboa B B, Vargas L K, Passaglia L M P. Comparison among bacterial communities present in arenized and adjacent areas subjected to different soil management regimes., 2013, 373: 339–358
[14] Zhou J, Davey M E, Figueras J B, Rivkina E, Gilichinsky D, Tiedje J M. Phylogenetic diversity of a bacteria community determined from Siberian tundra soil DNA., 1997, 143: 3913–3919
[15] Zhu Y B, Tian J Q, Shi F Y, SuL, Liu K K, Xiang M C. Rhizosphere bacterial communities associated with healthy and-infected soybean roots., 2013, 58: 32–37
[16] 朱琳, 曾椿淋, 李雨青, 俞冰倩, 高凤, 魏巍, 徐艳丽. 基于高通量测序的大豆连作土壤细菌群落多样性分析. 大豆科学, 2017, 36: 419–424Zhu L, Zeng C L, Li Y Q, Yu B Q, Gao F, Wei W, Xu Y L. The characteristic of bacterial community diversity in soybean field with continuouscropping based on the high-throughput sequencing., 2017, 36: 419–424(in Chinese with English abstract)
[17] 周燕. 间作及接种根瘤菌对大豆种植土壤细菌群落结构的影响. 广西大学硕士学位论文, 广西南宁, 2014Zhou Y. Effects of Intercropping and Inoculating Rhizobias on Soybean Soil Bacterial Community Structure. MS Thesis of Guangxi University, Nanning, Guangxi, China, 2014 (in Chinese with English abstract)
[18] 朱英波, 史凤玉, 张瑞敬, 武云鹏. 黑龙江大豆轮作和连作土壤细菌群落多样性比较. 植物保护学报, 2014, 41: 403–409 Zhu Y B, Shi Y F, Zhang R J, Wu Y P. Comparison of bacterial diversity in rotational and continuous soybean cropping soils in Heilongjiang., 2014, 41: 403–409(in Chinese with English abstract)
[19] Li X G, Ding C F, Zhang T L, Wang X X.Fungal pathogen accumulation at the expense of plant-beneficial fungi as a consequence of consecutive peanut monoculturing., 2014, 72: 11–18
[20] Wang G M, Stribley D P, Tinker P B, Walker C.Effects of pH on arbuscular mycorrhiza: I. Field observations on the long-term liming experiments at Rothamsted and Woburn., 1993, 124: 465–472
[21] 陈雪丽. 黑土区连作大豆根际微生物群落特征研究. 中国科学院大学博士学位论文, 北京, 2015 Chen X L. Characterization of Microorganism Community in the Rhizosphere of Continuous Cropping Soybean in Black Soil. PhD Dissertation of University of Chinese Academy of Sciences, Beijing, China, 2015 (in Chinese with English abstract)
[22] 王晋莉. 大豆连作条件下的根际细菌与氨氧化微生物群落特征及其影响因素. 中国农业大学博士学位论文, 北京, 2014 Wang J L. Rhizospheric Bacterial and Ammonia-oxidizer Communities under Continuous Monoculture of Soybean Crop. PhD Dissertation of China Agricultural University, Beijing, China, 2014(in Chinese with English abstract)
[23] 魏巍. 大豆长期连作土壤对根腐病病原微生物的抑制作用. 中国科学院博士学位论文, 北京, 2012 Wei W. The Suppressiveness Caused by Long-tern Continuous Cropping of Soybean on the Root Rot and Pathogens. PhD Dissertation of Chinese Academy of Sciences, Beijing, China, 2012 (in Chinese with English abstract)
[24] 顾美英, 徐万里, 茆军, 梁智, 张志东, 房世杰. 连作对新疆绿洲棉田土壤微生物数量及酶活性的影响. 干旱地区农业研究, 2009, 27(1): 1–5Gu M Y, Xu W L, Mao J, Liang Z, Zhang Z D, Fang S J. Effects of cotton continuous cropping on the amount of soil microbes and enzyme activities in Xinjiang., 2009, 27(1): 1–5(in Chinese with English abstract)
[25] Sanguin H, Sarniguet A, Gazengel K, Moënne-Loccoz YGrundmann G L. Rhizosphere bacterial communities associated with disease suppressiveness stages of take-all decline in wheat monoculture., 2009, 184: 694–707
[26] Schreiner K, Hagn A, Kyselková M, Moënne-Loccoz Y, Welzl G, Munch J C, Schloter M. Comparison of barley succession and take-all disease as environmental factors shaping the rhizobacterial community during take-all decline., 2010, 76: 4703–4712
[27] Chen S Y, Dickson D W. Biological control of plant parasitic nematodes. In: Manzanilla-Lopez R H, Marban-Mendoza N, eds. Practical Plant Nematology.Jalisco, Mexico: Colegio de Postgraduados and Mundi-Prensa, Biblioteca Basica de Agricultura, 2012.pp 761–811(in English)
[28] 王闯进. 大豆连作对根际土壤生物群落的影响. 中国农业大学博士学位论文, 北京, 2014 Wang C J. The Impact of Continuous Soybean Monoculture on Soil Communities in the Rhizosphere. PhD Dissertation of China Agricultural University, Beijing, China, 2014(in Chinese with English abstract)
[29] Zhu Y B, Tian J Q, Shi F Y, Tian J Q, Liu J B, Chen S Y, Xiang M C, Liu X Z. Effect of soybean monoculture on the bacterial communities associated with cyst of., 2013, 45: 228–235
[30] Chen J, Moore W H, Yuen G Y, Kobayashi D, Caswell-Chen E P. Influence ofstrain C3 on nematodes., 2006, 38: 233–239
[31] Lee Y S, Nguyen X H, Moon J H. Ovicidal activity of lactic acid produced byYS1215 on eggs of root-knot nematode,., 2014, 24: 1510–1515
[32] Orcutt B N, Sylvan J B, Knab N J, Edwards K J. Microbial ecology of the dark ocean above, at, and below the seafloor., 2011, 75: 361–422
[33] 殷继忠, 李亮, 接伟光, 蔡柏岩. 连作对大豆根际土壤细菌菌群结构的影响. 生物技术通报, 2018, 34(1): 1–6 Yin J Z, Li L, Jie W G, Cai B Y. Effects of continuous cropping on bacterial flora structure insoybean rhizosphere soil., 2018, 34(1): 1–6(in Chinese with English abstract)
[34] 谷岩, 邱强, 王振民, 陈喜凤, 吴春胜. 连作大豆根际微生物群落结构及土壤酶活性. 中国农业科学, 2012, 45: 3955–3964 Gu Y, Qiu Q, Wang Z M, Chen X F, Wu C S. Effects of soybean continuous cropping on microbial and soil enzymes in soybean rhizosphere., 2012, 45: 3955–3964(in Chinese with English abstract)
[35] 顾美英, 徐万里, 茆军, 张志东, 唐光木, 葛春辉. 新疆绿洲农田不同连作年限棉花根际土壤微生物群落多样性. 生态学报, 2012, 32: 3031–3040 Gu M Y, Xu W L, Mao J, Zhang Z D, Tang G M, Ge C H. Microbial community diversity of rhizosphere soil in continuous cotton cropping system in Xinjiang., 2012, 32:3031–3040(in Chinese with English abstract)
[36] 刘素慧, 刘世琦, 张自坤, 尉辉, 齐建建, 段吉峰. 大蒜连作对其根际土壤微生物和酶活性的影响. 中国农业科学, 2010, 43: 1000–1006Liu S H, Liu S Q, Zhang Z K, Wei H, Qi J J, Duan J F. Influence of garlic continuous cropping on rhizosphere soilmicroorganisms and enzyme activities., 2010, 43: 1000–1006 (in Chinese with English abstract)
[37] 陈慧, 郝慧荣, 熊君, 齐晓辉, 张重义, 林文雄. 地黄连作对根际微生物区系及土壤酶活性的影响. 应用生态学报, 2007, 18: 2755–2759Chen H, Hao H R, Xiong J, Qi X H, Zhang Z Y, Lin W X. Effects of successive croppingon rhizosphere soil microbial flora andenzyme activities., 2007, 18: 2755–2759(in Chinese with English abstract)
[38] 林茂兹, 王海斌, 林辉锋. 太子参连作对根际土壤微生物的影响. 生态学杂志, 2012, 31: 106–111Lin M Z, Wang HB, Lin H F. Effects ofcontinuous cropping on rhizosphere soil microorganisms., 2012, 31:106–111 (in Chinese with English abstract)
[39] 刘金波, 许艳丽. 我国连作大豆土壤微生物研究现状. 中国油料作物学报, 2008, 30: 132–136Liu J B, Xu Y L. Current research of soil microbial of successive soybean cropping in China., 2008, 30: 132–136 (in Chinese with English abstract)
Bacterial Diversity of Soybean Rhizosphere Soil under Different Cropping Patterns
WANG Fang1, CHEN Jing-Sheng2,and LIU Da-Wei3
1College of Life Sciences and Agroforestry,Heilongjiang Provincial Key Laboratory of Resistance Gene Engineering and Protection of Biodiversity in Cold Areas, Qiqihar University,Qiqihar161006, Heilongjiang, China;2Daqing Branch of Heilongjiang Academy of Agricultural Sciences, Daqing 163316, Heilongjiang, China;3Agronomy College, Northeast Agricultural University, Harbin 150030, Heilongjiang, China
To study bacterial community structure of soybean rhizosphere soil in rotation and continuous cropping, 16S rDNA gene were sequenced of soil samples infected soybean cyst nematode from Heilongjiang Province two regions by the second generation of high-throughput sequencing Illumina MiSeq platform. A total of 25 419 OTUs were obtained from six soil samples and classified into 47 phylum, 147 class, and 709 genera. Proteobacteria, Actinobacteria, Acidobacteria, Gemmatimonadetes, Planctomycetes weredominant bacteria, accounting for more than 90% of all soil bacterial communities. The total OTUs and richness were the highest in four years continuous cropping and the lowest in twenty years continuous cropping. The difference of bacteriaabundance in different rotational cropping years was not obvious (>0.05),but abundance and adversity were significantin continuous cropping (<0.05).The relative abundance of Actinobacteria in different rotations was lower than that in continuous cropping, and the relative abundance of Gemmatimonadetes and Bacteroidetes was higher than that in the same area. The relative abundance of soil functional bacteria,,,, andwere higher in different continuous cropping years than those in rotations. Predominant bacterial abundance in long term continuous cropping was more similar with that in rotational cropping.
soybean; rotation; continuous cropping; bacterial diversity; Illumina MiSeq sequencing
2018-02-05;
2018-07-20;
2018-07-31.
10.3724/SP.J.1006.2018.01539
E-mail: wangfangnd@hotmail.com
本研究由黑龙江省省属高等学校基本科研业务费科研项目(2012K-M21)资助。
This study was supported by the Heilongjiang Provincial Higher-education Basic Scientific Research Project (2012K-M21).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20180730.0948.010.html

