促血小板生成素及其抗体在系统性红斑狼疮伴发血小板减少中的作用
罗雄燕,袁佳莉,罗采南,刘 静,武丽君,陈 勇,袁国华,刘 毅
系统性红斑狼疮(systemic lupus erythematosus,SLE)是由患者机体产生多种自身抗体并由此介导组织和器官损伤而导致的一种自身免疫性疾病。在SLE造成的损害中,血小板减少为常见临床表现之一,部分患者可因严重血小板减少而造成致命性出血性疾病[1]。研究显示,SLE伴发血小板减少与患者存在抗血小板抗体导致的血小板破坏有关。笔者既往研究发现,SLE伴发血小板减少患者存在骨髓巨核细胞功能异常[2],促血小板生成素(thrombopoietin,TPO)在维持骨髓巨核细胞的功能中发挥作用。本文通过对SLE伴发血小板减少患者血清TPO水平及抗TPO抗体产生情况进行研究,探讨TPO及其抗体在SLE伴发血小板减少中的作用。
1 材料与方法
1.1 对象
2016年3月至2017年5月在四川大学华西医院、川北医学院附属医院、新疆自治区人民医院、四川省简阳市人民医院风湿免疫科住院治疗的SLE患者213例,根据患者是否伴血小板减少分为SLE伴血小板减少组和SLE血小板正常组。SLE伴发血小板减少组61例,其中并发严重感染、肿瘤、肾功能不全者8例,另有3例血小板减少者不能排除药物因素的影响,该11例患者被排除。实际纳入SLE伴发血小板减少者50例,包括男4例,女46例。患者年龄13~61岁,平均34.1岁;病程0.5~181个月,中位病程35.4个月。SLE血小板正常组43例,男4例,女39例,年龄11~57岁,平均32.7岁;病程0.5~172个月,中位病程31.8个月。2组患者均符合1997年ACR的SLE诊断分类标准[3]。详细收集SLE患者的临床资料,并按文献报道的方法计算SLE病情活动指数(SLEDAI)[4]。同期选择性别、年龄匹配的健康体检者27人,其中男3例,女24例,年龄16~60岁,平均32.7岁。
本研究方案经四川大学华西医院伦理委员会批准,所有受试者均签署知情同意书。
1.2 方法
1.2.1 主要试剂与仪器: TPO和抗TPO抗体酶联免疫吸附法(enzyme linked immunoadsorption,ELISA)试剂盒(Cusabio Biotech Co.)、重组人TPO注射液(沈阳三生制药有限责任公司)、静脉注射用人免疫球蛋白(武汉生物制品研究所);Dynabeads Protein G(Life Technologies AS,Morway)、噻唑蓝(美国Sigma公司);巨核细胞株MEG-01(上海北诺生物科技有限公司)。酶标仪(Bio-Rad,Benchmark,Japan)。
1.2.2 血清TPO及抗TPO抗体水平测定:采用ELISA检测受试者血清TPO水平及抗TPO抗体滴度,检测按试剂盒说明书进行。取250 μl重组人TPO标准液进行倍比稀释,取100 μl标准液或待测血清加入预包被抗TPO抗体及重组人TPO的96孔板,每例均加复孔。37 ℃温育2 h,弃孔中液体;PBS-T洗涤3次,加入100 μl酶结合工作液,37 ℃温育1 h;以PBS-T洗板3次,加入100 μl 辣根过氧化物酶标记的亲和素,37 ℃温育1 h;用PBS-T洗板6次,加入90 μl TMB底物溶液,37 ℃避光显色20 min,每孔加入50 μl终止液;用酶标仪测定波长450 nm处吸光度(A值)。空白对照以PBS代替待测血清。
1.2.3 磁珠蛋白G法分离血清IgG: 采用磁珠蛋白G方法分别从6例抗TPO抗体阳性SLE患者混合血清池和6例抗TPO抗体反应阴性的SLE患者中分离血清IgG。血清IgG分离按照说明书步骤进行操作,在每管200 μl磁珠蛋白G(含1.5 mg蛋白G)悬液中加入血清200 μl,缓慢摇动并孵育10 min,弃上清,用200 μl PBS-T洗2次,加入20 μl洗脱液晃动2 min,收集上清,用1 mol/L Tris(pH7.5)调整pH值,用考马斯亮法测定蛋白浓度,然后置于-70 ℃条件下保存备用。
1.2.4 MTT法检测细胞增生活性:将巨核细胞株MEG-01按2×104/孔的密度接种于96孔板,置于37 ℃、体积分数5% CO2孵箱中用含10%胎牛血清的RPMI-1640培养液培养24 h,弃培养液,加入不含胎牛血清的RPMI-1640培养液100 μl,同时加入分离的抗TPO抗体阳性或阴性IgG,使终浓度分别达到5、10、20和40 μg/ml,以同样方法加入静脉注射用人免疫球蛋白作为正常对照,细胞培养1 h,再加入重组人TPO至终浓度40 μg/ml,于37 ℃、5% CO2孵箱中培养68 h,每孔加入20 μl质量分数0.5% MTT溶液,继续培养4 h,弃培养液,每孔加入150 μl DMSO,振荡10 min,用酶标仪于490 nm波长处测定吸光度(A值)。
1.3 统计学方法
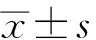
2 结果
2.1 各组受检者血清TPO水平比较
正常对照组、SLE血小板正常组和SLE伴血小板减少组受检者血清TPO水平分别为(63.7±20.6)、(98.5±28.7)和(80.0±24.8)pg/ml,3组间总体比较差异有统计学意义(F=8.213,P=0.000);其中SLE血小板正常组患者血清TPO水平明显高于SLE伴血小板减少组和正常对照组,差异均有统计学意义(P=0.003、0.002);SLE伴血小板减少组患者血清TPO水平略高于正常对照组,但差异无统计学意义(P=0.169)(图1A)。
2.2 各组受检者血清抗TPO抗体滴度比较
正常对照组、SLE血小板正常组和SLE伴血小板减少组受检者血清抗TPO抗体滴度(A值)分别为0.476±0.165、0.679±0.300和0.763±0.348,3组间总体比较差异有统计学意义(F=8.952,P=0.000);SLE血小板正常组和SLE伴血小板减少组患者血清抗TPO抗体滴度均显著高于正常对照组,差异均有统计学意义(P=0.000、0.007);SLE血小板正常组与SLE伴血小板减少组间患者血清抗TPO抗体滴度的差异无统计学意义(P=0.257)(图1B)。将正常对照组受检者血清抗TPO抗体滴度平均值+3SD(即A值>0.977)作为正常上限,大于正常上限值定义为阳性。SLE伴血小板减少组和SLE血小板正常组受检者血清抗TPO抗体阳性率分别为32.0%(16/50)和25.6%(11/43),组间比较差异无统计学意义(χ2=0.462,P=0.497),正常对照组未发现血清抗TPO抗体阳性者。进一步对照抗TPO抗体阳性和阴性患者的糖皮质激素和免疫抑制剂如环磷酰胺、硫唑嘌呤、霉酚酸酯等在检测时的应用情况,组间差异均无统计学意义(P=0.562、0.213)。

图 1 ELISA法测定受检者血清TPO及其抗体水平Fig 1 Measurement of serum TPO and anti-TPO antibody by ELISA
2.3 患者血清TPO及抗TPO抗体水平与血小板计数的关系
SLE伴血小板减少组患者血小板计数与血清抗TPO抗体滴度呈显著性负相关(r=-0.268,P=0.048)(图2),与血清TPO水平无明显相关性(r=0.133,P=0.393)。SLE伴血小板减少组患者中,16例抗TPO抗体阳性患者平均血小板计数为(50.7±25.9)×109/L,明显低于抗TPO抗体阴性患者的(68.2±19.1)×109/L,差异有统计学意义(P=0.012)。SLE血小板正常组患者血清TPO水平和抗TPO抗体滴度均与血小板计数无明显相关性(r=0.028、-0.178,均P>0.05)。SLE伴血小板减少组16例抗TPO抗体阳性患者血清TPO水平为(68.2±22.0)pg/ml,明显低于SLE血小板正常组抗TPO抗体阳性患者的(100.2±30.6)pg/ml,差异有统计学意义(P=0.004)。
2.4 抗TPO抗体对巨核细胞增生活性的抑制作用
抗TPO抗体质量浓度达到10 μg/ml时巨核细胞增生活性开始下降,随着抗TPO抗体剂量的增大巨核细胞增生活性下降逐渐明显。抗TPO抗体阴性SLE患者的IgG质量浓度≥20 μg/ml时巨核细胞的增生活性下降(图3)。巨核细胞在用正常人IgG刺激后呈增生增强现象,可能与注射人免疫球蛋白中含有清蛋白有关。
3 讨论
血小板减少是SLE的常见表现之一,发生率为30%~58%,其中约16%是SLE的首发症状[1,5]。SLE并发血小板减少严重程度不一,轻度(血小板50~99×109/L)、中度(血小板21~50×109/L)和重度(血小板<20×109/L)分别占20%、25%和55%[6]。血小板持续性减少可导致SLE患者10年生存率下降30%左右,因此血小板减少是SLE患者早期死亡的唯一独立因素[7]。目前认为SLE患者体内产生的多种抗血小板成分抗体加快血小板破坏及抗磷脂抗体导致的血小板消耗增多是SLE伴血小板减少的主要原因。但是本研究团队及其他作者在临床研究中均发现,SLE伴血小板减少患者的骨髓巨核细胞数量及血小板的产生功能均较无血小板减少患者为低[2],提示SLE伴发的血小板减少可能还与骨髓巨核细胞功能障碍致血小板的产生减少有关。

图 2 SLE伴血小板减少组患者血清抗TPO抗体滴度与血小板计数相关性分析Fig 2 Correlation of serum anti-TPO antibody with platelet count in SLE with thrombocytopenia patients

图 3 抗TPO抗体对巨核细胞增生活性的抑制作用Fig 3 Inhibition of TPO antibody on proliferative activity of meg-akaryocytes
TPO在调节巨核细胞功能方面发挥至关重要的作用,即通过促进巨核细胞增生及抑制凋亡而增加巨核细胞数量,通过增加巨核细胞体积和多倍核数量而促进血小板的生成和释放。为探讨伴血小板减少SLE患者骨髓巨核细胞功能障碍是否与TPO水平改变有关,本研究进行了TPO水平的检查,结果显示SLE伴血小板减少患者的血清TPO水平明显低于无血小板减少的SLE患者,仅略高于正常人血清TPO水平,而且血清TPO水平与血小板计数无明显的线性关系,这与其他研究结果[8-9]基本一致。
鉴于上述结果,SLE伴血小板减少患者血清TPO水平较正常人并未下降,故推测患者体内可能存在抗TPO的自身抗体而导致TPO不能发挥正常生物学功能,为此本研究对患者血清抗TPO抗体进行检测。结果显示,SLE伴血小板减少患者和不伴有血小板减少的患者血清TPO抗体滴度均显著高于正常对照组,SLE伴血小板减少患者血清抗TPO抗体阳性率为32.0%,SLE血小板正常患者为25.6%,二者比较差异并无统计学意义,正常人中无1例。这一结果与文献报道的SLE患者产生抗TPO抗体发生率20%~43%[9]基本相符。吴晓丹等[10]的研究显示,与抗TPO抗体阴性患者比较,抗TPO抗体阳性SLE患者更易发生血小板减少,而本研究未能发现SLE伴血小板减少患者与SLE血小板正常患者间血清抗TPO抗体阳性率有明显差异,但在SLE伴血小板减少患者中发现,抗TPO抗体滴度与血小板计数呈线性负相关,与抗TPO抗体阴性患者比较,抗TPO抗体阳性患者的血小板计数明显降低。Ziakas等[9]也发现,抗TPO抗体的出现可使SLE患者的血小板平均下降67×109/L,但本研究未能在SLE血小板正常组发现抗TPO抗体与血小板计数间的线性关系,进一步分析抗TPO抗体阳性的SLE伴血小板减少患者与抗TPO抗体阳性的SLE血小板正常患者间血清TPO水平,发现前者TPO水平明显低于后者,提示抗TPO抗体仅在TPO水平较低的情况下发挥病理作用,而不能拮抗高浓度TPO的生物学作用。
为进一步明确抗TPO抗体在血小板减少中的作用,本研究在体外细胞培养过程中观察其对巨核细胞增生的影响。结果显示,抗TPO抗体可显著抑制TPO诱导的巨核细胞增殖,并呈现剂量依赖关系。Ziakas等[11]也证实抗TPO抗体可抑制巨核细胞克隆形成。但本研究观察到,从抗TPO抗体阴性SLE患者分离的IgG对巨核细胞具有一定的作用,表明SLE患者体内还存在其他拮抗巨核细胞功能的抗体。笔者先前的研究中采用间接免疫荧光法证实,SLE患者体内存在抗巨核细胞抗体[12],Kuwana等[13]发现SLE患者还存在抗TPO受体抗体。这些结果表明,SLE伴血小板减少患者的巨核细胞功能障碍可能与多种自身抗体有关。
SLE的病理基础为自身抗体介导的炎症反应,在这一炎症反应过程中可产生大量趋化因子,包括巨噬细胞炎症蛋白-1α(macrophage inflammatory protein-1α,MIP-1α)、单核细胞趋化蛋白-1(monocyte chemoattractant protein-1,MCP-1)、CXC配体13(CXC ligand 13,CXCL13)等。其中MIP-1α对骨髓巨核细胞具有明显的抑制作用[14-15],而SLE患者血清TPO水平明显增高则是机体应对MIP-1α造成巨核细胞损伤的保护性反应[7]。本研究在SLE伴血小板减少的患者中观察到,这类患者血清TPO水平明显低于SLE血小板正常者,说明SLE伴血小板减少患者对MIP-1α损伤所产生的TPO水平虽然略高于正常水平,但不足以抵抗MIP-1a抑制巨核细胞的作用,而此时体内若出现抗TPO抗体,则进一步减弱了TPO拮抗MIP-1α的作用,这也足以解释本研究观察到的抗TPO抗体阳性患者较TPO抗体阴性患者具有更严重的血小板减少。同时,由于血小板正常的SLE患者体内产生大量的TPO,即使抗TPO抗体阳性,也不足以阻断TPO的生物学作用,因而对巨核细胞功能并无影响。
综上所述,SLE患者对炎症反应的保护性TPO表达相对不足以及抗TPO抗体的产生等进一步拮抗了TPO的生物学作用,可能在SLE伴发血小板减少的过程中发挥重要作用,血清TPO和抗TPO抗体的检测可为临床上应用TPO对SLE伴发血小板减少者的治疗提供可靠依据。

