成人Xp11.2易位/TFE3基因融合相关性肾癌6例诊治分析
田子农 徐仁芳 崔笠 薛冬 陈一鸣 王坤 何小舟
Xp11.2异位/TFE3基因融合相关性肾癌(renal carcinoma associated with Xp11.2 translocations/TFE3 gene fusions,Xp11.2 RCC)临床罕见,是2004年由WHO新命名的一种肾癌亚型,其命名源于Xp11.2位点上TFE3基因发生断裂,并与PRCC、ASPL、PSF、CLTC、NonO等相关基因发生平衡易位形成新的TFE3融合基因[1]。Xp11.2 RCC组织形态上与常见的肾透明细胞癌、乳头状肾细胞癌相似,既往非常容易漏诊和误诊。既往研究显示Xp11.2 RCC约占儿童肾细胞的1/3[2],主要影响儿童及青少年,在成人患者中多为散在病例报道。但最近的研究表明Xp11.2 RCC在成人中的发病率可能被严重低估[3],其临床表现、影像学特征、治疗、预后等有诸多特殊之处,导致目前对此型肾癌的认识严重落后于其他肾癌亚型。我科近两年通过特异性的TFE3免疫组化检查,确诊6例成人Xp11.2 RCC,现将初步的诊治经验报道如下。
1 资料与方法
1.1 一般资料
2017年2月—2018年4月我科共收治经术后病理确诊的Xp11.2 RCC成人患者6例。6例中男2例,女4例,年龄20~50岁,平均年龄33.2岁,其中4例患者年龄≤30岁,发病时间5天~3个月。临床表现单纯腰痛3例,腰痛伴血尿1例,无症状体检发现1例,腰腹部包块1例。
1.2 影像学检查
影像学检查主要行螺旋CT检查。6例CT均提示患肾实质性占位,左侧4例,右侧2例,肿瘤最大径5.2~19 cm,平均9.6 cm,呈类圆形或团块状,密度不均。5例肿块边界清晰,1例肿块边界不清。2例可见肿块边缘弧形或其内高密度钙化影(见图1A,图3A)。1例肿瘤破裂出血伴肾静脉癌栓形成(见图1A,图1B),2例可见肿块内部片状低密度坏死区(见图1B,图2A),2例可见腹膜后肿大淋巴结(见图2B),临床分期为T1b~T4期。
1.3 手术方法
6例均行根治性肾切除术,其中5例开放手术,1例为腹腔镜手术。3例同时行区域淋巴结清扫,1例行肾静脉癌栓取出术。
2 结果
2.1 病理学特点
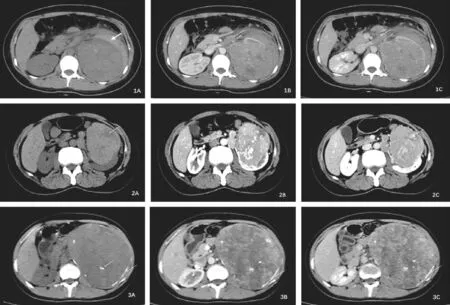
图1 A~C 女,20岁,左肾Xp11.2RCC。A. CT平扫左肾体积增大,左肾肿块内见高密度影,左肾周高低密度混杂影。B.皮质期左肾肿块轻度不均匀强化,内见坏死灶,左肾静脉内见癌栓。C.实质期持续强化,但减弱。左肾周混杂影不强化,考虑左肾肿瘤伴破裂出血。图2A~C 女,50岁,左肾Xp11.2RCC。A.CT平扫左肾体积增大,肿块边界清,稍高密度,内见片状低密度影。B.皮质期左肾肿块中度不均匀延迟强化,腹膜后淋巴结肿大。C.实质期强化明显减弱,整体呈中度、延迟强化。图3A~C 女,30岁,左肾Xp11.2RCC。A.CT平扫左肾体积增大,见巨大肿块,边界尚清,肿块密度不均,内见高密度钙化影,肿块周围见弧形钙化影。B.皮质期左肾肿块不均匀强化。C.实质期肿块持续延迟强化
术后pTNM分期如下:2例T1bNXM0,1例T2aN0MO,1例T3aNXMO,2例T4N1MO。光镜下肿瘤细胞排列成泡巢状、腺泡状或乳头状结构,胞质透亮,部分呈嗜酸性胞质,核大、泡状染色质、核仁明显,沙砾体多见,伴灶状出血坏死。也有肿瘤细胞成实性巢状,癌细胞缺乏大量胞质,核仁不明显,沙砾体少见。免疫组化TFE3均(+),诊断为Xp11.2 RCC。3例Vim、CAIX、CD117、AE1/AE3(+),4例 CD10、P504、Melan-A(+),5例Ki67(+),1例CK8/18、S100、HMB45(+)。见表1。
2.2 预后分析
术后随访2~16个月,6例病人术后均存活。2例T1bNXM0术后分别随访9个月和16个月,病情无进展。1例T2aN0MO术后随访2个月,病情无进展。1例T3aNXM0术后服用索坦治疗,6个月后发现肺部多发转移。2例T4N1MO,术后分别随访2个月和9个月,病情无进展。
3 讨论
近年来随着TFE3免疫组化在肾癌分型筛选诊断中的广泛运用,Xp11.2 RCC的发病率已占到45岁以下肾癌患者的15%。人们认识到以往罕见的Xp11.2 RCC在成人中的发病率被严重低估,导致目前对成人型Xp11.2 RCC的认识严重缺乏,关于此型肾癌的诊断、治疗和预后研究显著落后于其他肾癌亚型。
Xp11.2 RCC最显著的特征是X染色体短臂TFE3基因处发生断裂,并与相应的染色体基因发生平衡易位形成新的TFE3融合基因,包括PSF(1q34)、NonO(xq12)、ASPL(17q25)、PRCC(1q21)、CLTC(17q23)[4-7]。研究显示,TFE3基因的断裂主要发生在启动子和主要功能域之间,新的融合基因与原TFE3基因融合产生新的启动子,异常激活转录因子,使融合后的TFE3基因表达量显著升高,高表达的TFE3蛋白影响细胞对转录调节的干扰作用,导致基因的异常调控,最终造成肿瘤的发生[8]。
Xp11.2 RCC的临床表现与肾透明细胞癌相比,无特异性,仍以腰痛、血尿或腰腹包块就诊,因此从症状难以鉴别,但其在性别和发病年龄上与透明细胞癌相比有明显差异。据文献报道,Xp11.2 RCC在女性的发病率明显高于男性,男女性别比为1∶4[9-10]。本组6例,女性4例,男性2例,女性发病率高于男性,与文献报道相符。本组发病年龄平均33.2岁,显示成人Xp11.2 RCC多发生于青年患者,与国内研究报道相符[11-12]。
CT是诊断Xp11.2 RCC的主要影像学检查手段,表现为平扫患肾有等密度或稍高密度实性肿块影,不均匀中度延迟强化为主,肿瘤内部出现特征性的弧形钙化和不均匀改变是此型肾癌的典型特征[13]。有研究显示,Xp11.2 RCC大多在CT增强幅度方面明显小于肾透明细胞癌[14]。徐晓晨等还提出,对于肾脏占位的儿童或轻患者,如CT值增强量小于50Hu,就要怀疑Xp11.2 RCC的可能[13]。本组2例女性,1例20岁,肿瘤最大径13cm,CT示肿瘤破裂出血伴肿瘤内部坏死改变,多发钙化灶,肾静脉癌栓形成, CT增强幅度小于对侧正常肾实质,延迟强化。1例30岁,肿瘤最大径19cm,CT示肿瘤内部不均质改变,典型的弧形钙化灶伴腹膜后淋巴结转移。我们认为,年轻女性,肾脏占位大,肿瘤内部不均质改变和(或)内部弧形、多发钙化,是术前对Xp11.2 RCC进行预测的依据之一。
Xp11.2 RCC肿瘤切面多为黄褐色,部分伴有出血、坏死,形态与肾透明细胞癌相似,HE染色上也相似,光镜下无典型特征可以鉴别。TFE3免疫组化阳性或强阳性是诊断Xp11.2 RCC的重要依据,特异性和敏感性分别达到99.6%和97.5%[7]。Xp11.2 RCC免疫组化多数表达Ki67、CD10、P504、Melan-A等,较少表达CK8/18、S100、HMB45,但这些免疫组化标记物的作用莫衷一是,对于确诊是否为Xp11.2 RCC不具有特异性。文献报道仅凭TFE3阳性,临床仍有假阳性或假阴性可能,更为准确诊断Xp11.2 RCC的方法是基因检测,近年来利用荧光原位杂交技术可以在基因水平检测出TFE3基因的易位,这是一种更适合临床运用的方法,优点是即使无新鲜标本,仅在石蜡组织标本上也可进行检测[15],方便对既往疑似Xp11.2 RCC患者进行回顾性分析研究。
本组有3例肿瘤巨大(肿瘤最大径>10cm),1例伴肾破裂和肾静脉内癌栓形成,2例腹膜后淋巴结转移,提示成人Xp11.2 RCC的侵袭性强,恶性程度高,预后不佳,易发生淋巴结转移,根治性肾切除术应是治疗的首选的手术方式[12]。但在临床实践中少数Xp11.2 RCC由于术前影像学检查不能确诊,影像学评估也无淋巴转移,而行保留肾单位手术,这些患者由于未行区域淋巴结清扫,理论上有肿瘤残留可能,因此术后的密切随访是改善预后的主要方法。既往研究显示免疫治疗及放化疗,对Xp11.2 RCC基本无效[16]。有报道认为靶向治疗是Xp11.2 RCC淋巴结转移或远处转移患者中唯一可能获益的选择[17],但很多文献报道疗效差异较大。本组1例T3aNXM0(肿瘤最大径13cm,伴破裂出血,肾静脉内癌栓形成)患者行根治性肾切除术后服用索坦治疗,6个月后复查双肺多发转移,病情出现进展,靶向治疗未能取得显著的效果。

表1 免疫组化
本组6例Xp11.2 RCC术后随访2~16个月,6例均存活,1例出现病情进展。但由于随访时间短,并不能准确反映出Xp11.2 RCC的预后。从文献报道看,Xp11.2 RCC普遍表现疾病进展快,预后比肾透明细胞癌差。研究还显示,Xp11.2 RCC不同融合基因类型,其预后也不同,Malouf发现ASPL-TFE3融合性肾癌侵袭性最强,预后最差[18]。而PRCC-TFE3型肾癌更具潜在复发的可能性[19]。有研究显示患者预后与年龄也密切相关,同等条件下都是区域淋巴转移但无远处转移,儿童Xp11.2 RCC患者总生存率几乎是成人患者的3倍[20]。
成人Xp11.2 RCC作为新的肾癌亚型,在TFE3免疫组化检测开展前,有较多漏诊的可能,其在成人中的发病率需要我们再认识。总之,对于年轻、女性肾脏肿瘤患者,术前充分认识到Xp11.2 RCC的可能性,熟悉Xp11.2 RCC典型的CT特征,治疗首选根治性肾切除术。成人Xp11.2 RCC的预后主要取决于年龄、肿瘤分期、不同融合基因类型和严密的随访等因素,相信随着越来越多的成人Xp11.2 RCC被检出,其诊治方案必将越来越完善。

