绿肥配施减量化肥对土壤固氮菌群落的影响
方 宇,王 飞,贾宪波,林陈强,张 慧,陈龙军,陈济琛
(福建省农业科学院土壤肥料研究所,福建 福州 350003)
生物固氮是指在固氮微生物的作用下将空气中的氮气还原成氨的过程,是全球生态系统最主要的氮源[1]。固氮菌群落结构组成对土壤氮素固定及维持氮素循环具有重要意义。固氮菌体内存在一种具有催化功能的固氮酶,固氮酶是由nifD和nifK基因编码的钼铁蛋白和nifH编码的铁蛋白构成。nifH基因只存在于固氮菌中,其核酸序列保守,系统进化关系和16S rRNA基因相一致,是研究固氮菌群落结构的最好标记基因[2]。
为了获得作物高产,化肥施用量不断增加,化肥的过量施用对土壤质量产生了严重影响,导致土壤质量明显下降[3]。因此,改善施肥方式,实现农业的可持续发展迫在眉睫。绿肥是有机肥的一种,它是一种养分完全的优质生物能源,可提供作物所需养分、改善农田生态环境,是保持土壤质量和农业可持续利用的措施之一。紫云英(Astrɑgɑlus sinicus)是我国水稻产区主要的绿肥作物,水稻可以利用紫云英的生物固氮能力,减少对化学氮肥的依赖,降低生态环境压力。在水稻种植区利用冬闲种植绿肥,可以有效改善土壤性状,并在一定程度上替代部分化学肥料,减少氮肥用量[4]。据报道化肥配施绿肥有利于培肥土壤[5]和作物增产[6]。因此建立绿肥化肥配施的施肥体系对于保障粮食安全和节约自然资源具有十分重要的意义。
研究表明施肥制度对土壤固氮菌有一定影响。例如Berthrong等[7]报道添加氮肥明显改变了森林土壤固氮菌的群落结构。Tan等[8]也报道水稻土壤添加氮肥后快速改变了固氮菌的群落结构。然而Wakelin等[9]研究显示施用尿素并没有影响固氮菌群落。黎睿智[10]指出单施有机肥和无机有机肥混施能在一定程度上提升土壤固氮菌的丰富度和多样性,而单施化肥的土壤固氮菌的多样性和丰富度会有所下降。有机肥的施用量对土壤固氮菌也有显著影响,低量有机肥能够增加玉米土壤固氮菌多样性[11]。然而目前关于绿肥对土壤固氮菌影响的研究较少。仅王秀呈[12]发现翻压紫云英增加了土壤固氮菌的丰度。有关绿肥配施减量化肥对土壤固氮菌群落影响的研究尚属空白。因此为了揭示绿肥配施减量化肥对我国南方水稻土壤固氮菌群落多样性的影响,本研究以紫云英化肥定位试验站土壤为研究对象,通过荧光定量和高通量测序技术研究了绿肥配施不同比例化肥处理下土壤固氮菌丰度和群落结构的变化规律及其与土壤理化性质间的相关关系,以期为该区合理施肥提供科学依据,从而促进水稻土壤的可持续发展。
1 材料与方法
1.1 研究区域概况
紫云英定位试验站位于福州市白沙镇,地理位置为北纬26°13′31″,东经119°04′10″,海拔高度15.4 m,年均降雨量1 350.9 mm,年日照时数1 812.5 h,年平均温度19.5℃,无霜期311 d;土壤类型为渗育型水稻土黄泥田。紫云英-水稻长期轮作定位试验始于2008年,试验开始时土壤基础理化性质:有机质24.4 g·kg-1、全氮 1.23 g·kg-1、碱解氮 171.6 mg·kg-1、速效磷13.5 mg·kg-1、速效钾83.4 mg·kg-1、pH 4.78。
本研究共设置5个处理:(1)对照,不施紫云英和化肥,CK;(2)单施化肥,NPK;(3)紫云英配施 80%化肥,MF80;(4)紫云英配施 60%化肥,MF60;(5)紫云英配施40%化肥,MF40。NPK处理的年化肥用量为N 135 kg·hm-2、P2O554 kg·hm-2、K2O 94.5 kg·hm-2。每个处理设3个小区,完全随机排列,每个小区面积为15 m2。紫云英前两年为异地方式翻压,第三年起于水稻成熟前套播紫云英种子(播种密度为22.5 kg·hm-2),于次年4月份翻压。紫云英翻压量2014年前鲜草量为18 000 kg·hm-2,2014年起翻压量为22 500 kg·hm-2。
1.2 样品采集
土样采集时间为2016年8月(水稻分蘖期)。各试验小区内按“S”形取样,随机布点采集耕作层(0~20 cm)土壤样品,混匀后置于无菌自封袋迅速带回实验室。部分土样风干后测定土壤养分;部分土样置于-80℃保存用于分子试验。
1.3 测定方法
1.3.1 土壤理化性质测定
土壤基本养分测定参照鲁如坤《土壤农业化学分析方法》[13]。土壤pH值用蒸馏水浸提(土水比1∶2.5)pH计测定;有机质用K2Cr2O7-H2SO4外加热法;全氮用凯氏定氮法;碱解氮用碱解扩散法;NH+4-N用2 mol·L-1KCl溶液浸提-靛酚蓝比色法;NO-3-N用双波长分光光度法[14]。
1.3.2 土壤微生物DNA的提取
采用 PowerSoil DNA Isolation Kit(Mobio,USA)试剂盒提取土壤微生物总DNA。提取的DNA用1%琼脂糖凝胶电泳检测样品质量,并用Nanodrop核酸蛋白测定仪(Nanodrop 2000)测定DNA的纯度和浓度。
1.3.3 土壤固氮菌nifH基因的荧光定量分析
选用引物nifH-F(AAAGGYGGWATCGGYAARTCCACCAC)和 nifH-R(TTGTTSGCSGCRTACATSGCCATCAT)扩增固氮菌nifH基因[15]。PCR体系为:2×Tɑq PCR Master Mix(Takara,大连,中国)25 μL,上下游引物各2 μL(10 μmol·L-1),DNA模板2 μL,用灭菌超纯水补至50 μL。PCR反应条件:94 ℃ 3 min;94℃30 s,56 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃ 10 min。将PCR产物回收,连接至pMD19-T载体(Takara,大连,中国),转化至大肠杆菌DH5α感受态细胞中,筛选阳性克隆测序分析。提取nifH基因阳性质粒,用Nanodrop核酸蛋白测定仪(Nanodrop 2000)测定质粒浓度,计算nifH基因拷贝数,按10倍梯度进行稀释,用于制备标准品。荧光定量PCR在ABI 7500型荧光定量PCR仪(ABI,CA,USA)上进行,反应体系(20 μL)为:SYBRGreen qPCR Master Mix 16.4 μL,上下游引物各0.8 μL(10 μmol·L-1),DNA模板2 μL。每个样品3次重复。荧光定量PCR采用两步法进行,PCR条件为95℃预变性10 min;95℃15 s,58℃退火延伸1 min,40个循环。
1.3.4 固氮菌nifH基因的高通量测序分析
固氮菌nifH基因采用nifH-F/nifH-R引物扩增,PCR体系:5×FastPfu Buffer 4 μL,2.5 mmol·L-1dNTPs 2 μL,上下游引物各 0.8 μL(5 μmol·L-1),FastPfu Polymerase 0.4 μL,BSA 0.2 μL,模板DNA约10 ng,超纯水补足至20 μL。PCR反应条件:95 ℃ 3 min;95℃30 s,55 ℃ 30 s,72 ℃ 45 s,35个循环;72 ℃ 10 min。扩增时在每个样品的上游引物5′端添加一段长度为6个碱基的特异性碱基序列(barcode),用于区分样品。将扩增的nifH基因PCR产物经AxyPrep DNA Gel Extraction Kit(Axygen Biosciences,Union City,CA,USA)纯化后,使用 QuantiFluorTM-ST(Promega,USA)测定浓度,将每个样品3次重复的PCR产物等摩尔混匀,用Illumina Miseq测序平台进行双末端测序。测序由上海美吉生物医药科技有限公司完成。
采用Flash和Trimmomatic软件对测序结果进行质量控制。首先根据PE reads之间的重叠关系,将成对的reads拼接成一条序列,同时对reads的质量和拼接的效果进行质控过滤,根据序列两端的barcode和引物序列区分样品得到有效序列。数据去杂方法和参数如下:(1)过滤reads尾部质量值20以下的碱基,设置50 bp的窗口,如果窗口内的平均质量值低于20,从窗口开始截去后端碱基,过滤质控后50 bp以下的reads,去除含N碱基的reads;(2)根据PE reads之间的重叠关系,将成对reads拼接成一条序列,最小重叠长度为10 bp;(3)拼接序列的重叠区允许的最大错配比率为0.2,筛选不符合序列;(4)根据序列首尾两端的barcode和引物区分样品,并调整序列方向,barcode允许的错配数为0,最大引物错配数为2。
1.4 数据处理
按样本最小序列进行抽平,之后用Uclust v1.2.22软件对序列进行聚类合并,选择97%作为相似性阈值。主坐标分析(Principal coordinate analysis,PCoA)采用R软件(3.2.1版本)完成。数据方差分析和相关性分析采用SPSS 19.0软件。
2 结果与讨论
2.1 绿肥配施减量化肥对水稻产量和土壤理化性质的影响
绿肥配施减量化肥对水稻产量(2009—2016年8年平均产量)的影响见图1。MF80处理的产量最高,为 8528 kg·hm-2;CK处理产量最低,仅为 7002 kg·hm-2。与NPK处理相比,翻压紫云英配施减量化肥的3个处理水稻产量与其无显著差异(P>0.05)。综合化肥用量和水稻产量,MF60(产量为8194 kg·hm-2)被认为是一种既环保又高产的施肥措施。
绿肥配施减量化肥对土壤理化性质的影响见表1。各施肥处理对土壤有机质含量无显著影响(P>0.05)。与NPK处理相比,绿肥配施减量化肥处理组明显增加了土壤全氮含量(P<0.05),而绿肥处理间无显著差异(P>0.05)。与CK相比,施肥处理(除MF40处理)明显增加了土壤碱解氮(AN)含量,其中MF60处理的AN含量最高;绿肥配施减量化肥处理组(除MF60处理)的土壤AN含量与NPK处理相当。不同施肥处理对土壤铵态氮含量的影响无显著差异。与NPK处理相比,绿肥处理组(除MF40处理)土壤硝态氮含量无明显变化。翻压紫云英处理组土壤pH高于NPK处理。
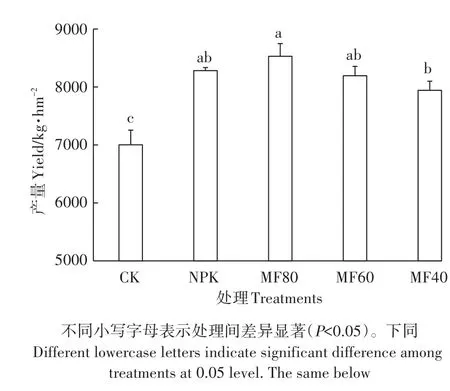
图1 不同施肥处理的水稻产量Figure 1 Rice yield under different fertilizer regimes
2.2 绿肥配施减量化肥对土壤固氮菌丰度的影响
由图2可知,不同施肥处理对土壤固氮菌丰度产生了显著影响。与NPK处理相比,绿肥配施减量化肥(除MF40处理)明显增加了土壤固氮菌丰度。MF60处理nifH基因的拷贝数最高,为每克干土2.45×109基因拷贝数;CK和MF40处理固氮菌丰度最低,为0.73×109基因拷贝数。对土壤固氮菌丰度和土壤理化性质进行相关性分析(表2)得知,固氮菌丰度和土壤碱解氮、硝态氮和pH呈显著正相关。
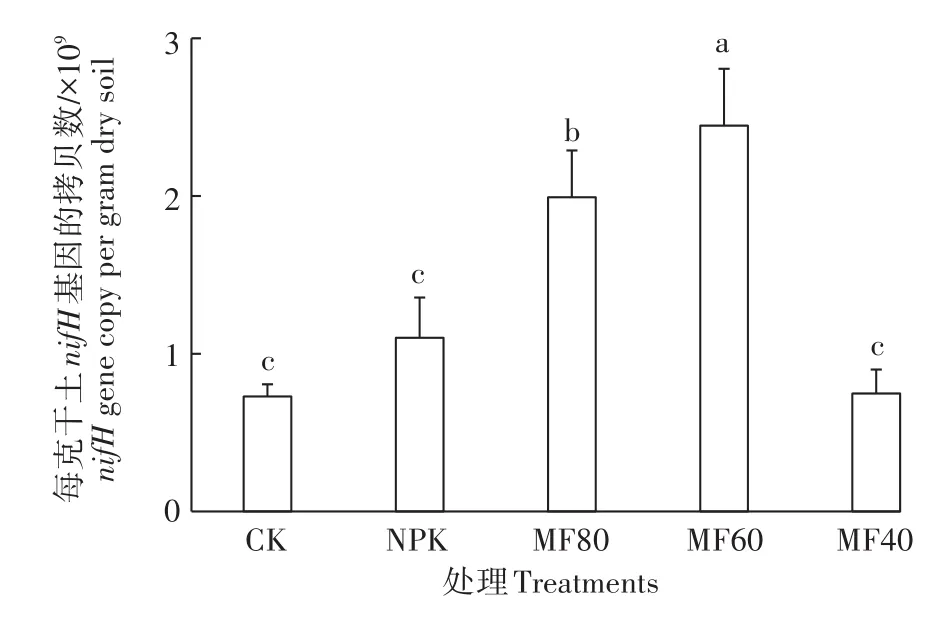
图2 不同施肥处理土壤固氮菌丰度Figure 2 Abundance of soil nitrogen-fixing bacteria under different fertilizer regimes
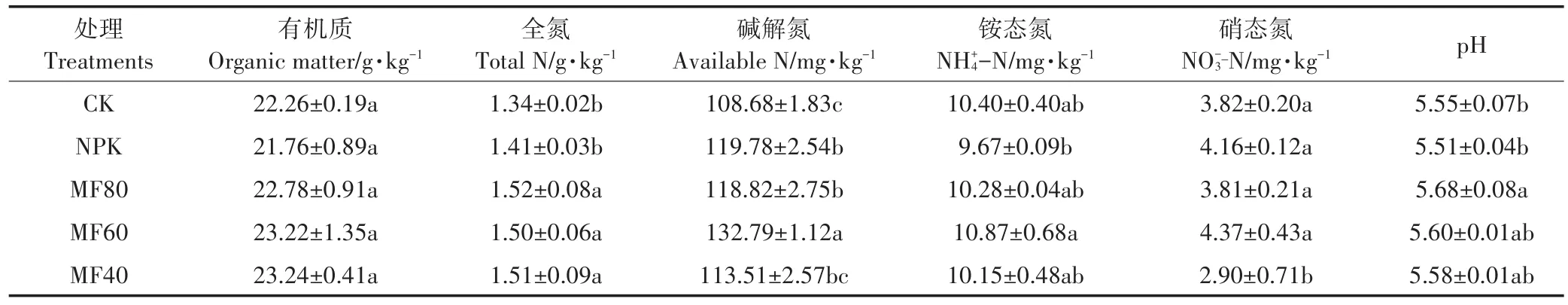
表1 不同施肥处理下土壤理化性质Table 1 Soil properties under different fertilizer regimes

表2 固氮菌丰度和土壤理化因子的相关性分析Table 2 Spearman′s correlation coefficients between the abundance of nitrogen-fixing bacteria and soil properties
固氮菌是环境变化的重要生物学指示,施肥对固氮菌有显著的影响,但是影响效果还没有达成一致的共识。长期施肥会对土壤固氮菌的群落大小产生显著的影响[7,16]。本研究中不同处理固氮菌丰度对施肥的响应明显不同。与单施化肥处理相比,紫云英配施减量化肥处理(除MF40处理)土壤中固氮菌丰度均有大幅度提高。可见,绿肥的施用和化肥的用量对固氮菌丰度都会产生显著影响。氮肥(例如N和NPK)的输入减少了固氮菌丰度可能是由于土壤酸化或高氮含量造成的[17]。Tan等[8]也报道单施氮肥降低了水稻根际固氮菌的丰度,而且高量氮肥也降低了高粱根际固氮菌的丰度[18]。本研究中翻压紫云英配施减量化肥处理增加了土壤pH值,而相关性分析表明固氮菌丰度与土壤pH值呈显著正相关,以及NPK处理含有高量氮肥,可能导致NPK处理的土壤固氮菌丰度较低。因此平衡施肥对控制土壤固氮菌的丰度至关重要。通过相关性分析得知,土壤固氮菌丰度与碱解氮、硝态氮和pH呈显著正相关。而Reed等[19]报道固氮菌丰度与氮浓度呈负相关。侯海军等[20]发现固氮菌的丰度与碱解氮含量呈负相关,氮肥会抑制固氮菌的生长。Wang等[17]认为这些不一致性可能是由于施肥制度对土壤产生的多重影响造成的,例如土壤碳[21]、氮的可利用性[22]、pH[23]、土壤类型[24]、地上作物[8]等都会导致肥料对固氮菌的影响不一致。值得注意的是施肥制度对固氮菌丰度的影响存在季节波动。与取样时间相比,施肥措施仅仅是一个次要影响因子[25-26]。例如Reardon等[27]揭示不同的试验年份相较于施肥对固氮菌丰度的影响更大。多重因子,例如试验地气温、水稻生长状况、土壤类型以及取样时间等都可能引起本研究中固氮菌丰度与环境因子的关系和其他研究的差异。
2.3 绿肥配施减量化肥对土壤固氮菌群落结构的影响
2.3.1 测序结果和多样性指数
使用Illumina Miseq技术对固氮菌进行高通量测序分析,共得到有效序列218 607条,每个样品含有10 891~18 937条序列,平均长度为380 bp。按照97%相似度对非重复序列进行OTU分析,共得到724个OTUs。样品测序覆盖度在97.19%~97.52%,稀释性曲线趋于饱和,表明测序深度可以反映土壤样品固氮菌的信息。
绿肥配施减量化肥对土壤固氮菌多样性的影响见表3。各施肥处理对土壤固氮菌的OTU数目和Chao1指数没有显著影响(P>0.05)。与NPK处理相比,绿肥配施减量化肥明显降低了土壤固氮菌的Shannon指数和均匀度指数;而绿肥处理之间无显著差异。与NPK处理相比,紫云英配施减量化肥的处理下土壤固氮菌的多样性指数降低可能是紫云英秸秆还田后促进了某些优势物种,从而降低了物种的多样性。
2.3.2 土壤固氮菌的群落组成
在门分类水平(图3),变形菌门(Proteobacteria)是固氮菌的绝对优势菌门,占总OTU的59.72%~80.86%,others包括广古菌门和蓝菌门,其余OTU则隶属于未分类的细菌门。与NPK处理相比,翻压紫云英的施肥处理降低了变形菌门的丰度,而未分类的细菌种类增加。可见,翻压紫云英改变了土壤固氮菌优势类群的相对丰度,从而影响了固氮菌的群落组成。在纲水平(图4),土壤固氮菌主要隶属于α-变形菌、β-变形菌和δ-变形菌,还包括少量未分类的变形菌门种类和未分类的细菌种类,others则包括甲烷微菌纲、未分类的蓝菌门种类。固氮菌的种类并不局限于某一属或某一种,而是广泛的分布在细菌界中,如古细菌中的广古菌门和真细菌中的变形菌门、放线菌门、蓝菌门、厚壁菌门及绿菌门等[28]。在本研究中固氮菌主要集中在变形菌门,这与徐鹏霞[29]和Collavino等[30]的研究结果相一致。其他序列少量分布于蓝菌门,还有17%~32%属于未分类的细菌。在变形菌门中,本研究土壤中检测到α-变形菌、β-变形菌和δ-变形菌的存在,而γ-变形菌未检测到。Izquierdo等[31]也报道了一些热带土壤中缺乏γ-变形菌的固氮菌。在属水平(图5),大部分优势类群为未分类的种类,包括 unclassified Alphaproteobacteria、unclassified Proteobacteria、unclassified Deltaproteobacteria、unclassified Beltaproteobacteria。而地杆菌属(Geobɑcter)是唯一一个可分类的优势种群,丰度为6.88%~13.70%。地杆菌属在CK中丰度最高为13.70%,MF40处理中丰度最低为6.88%。与NPK处理相比,翻压绿肥显著降低了地杆菌属的丰度,但绿肥处理间无显著差异。此外土壤中还含有丰度较低(相对丰度<1%)的一些固氮菌属,如铁氧化细菌(Sideroxydɑns)、慢生根瘤菌属(Brɑdyrhizobium)、厌氧黏细菌(Anɑeromyxobɑcter)、念珠藻属(Nostoc)、红螺菌属(Rhodospirillum)、固氮弓菌属(Azoɑrcus)、红微菌属(Rhodomicrobium)、互营杆菌属(Syntrophobɑcter)、微鞘藻属(Microcoleus)、红假单胞菌属(Rhodopseudomonɑs)等。值得注意的是,本研究中与紫云英关系密切的根瘤菌丰度较低,仅为0.55%~0.73%。原因可能是紫云英于每年4月翻压入土,到8月取样时紫云英大部分物质已经腐解[32]。

表3 不同施肥处理固氮菌多样性指数Table 3 Diversity indices of nitrogen-fixing bacteria under different fertilizer regimes

图3 不同施肥处理土壤固氮菌门水平组成Figure 3 Composition of nitrogen-fixing bacteria at the phylum level under different fertilizer regimes
2.3.3 土壤固氮菌群落结构的主坐标分析
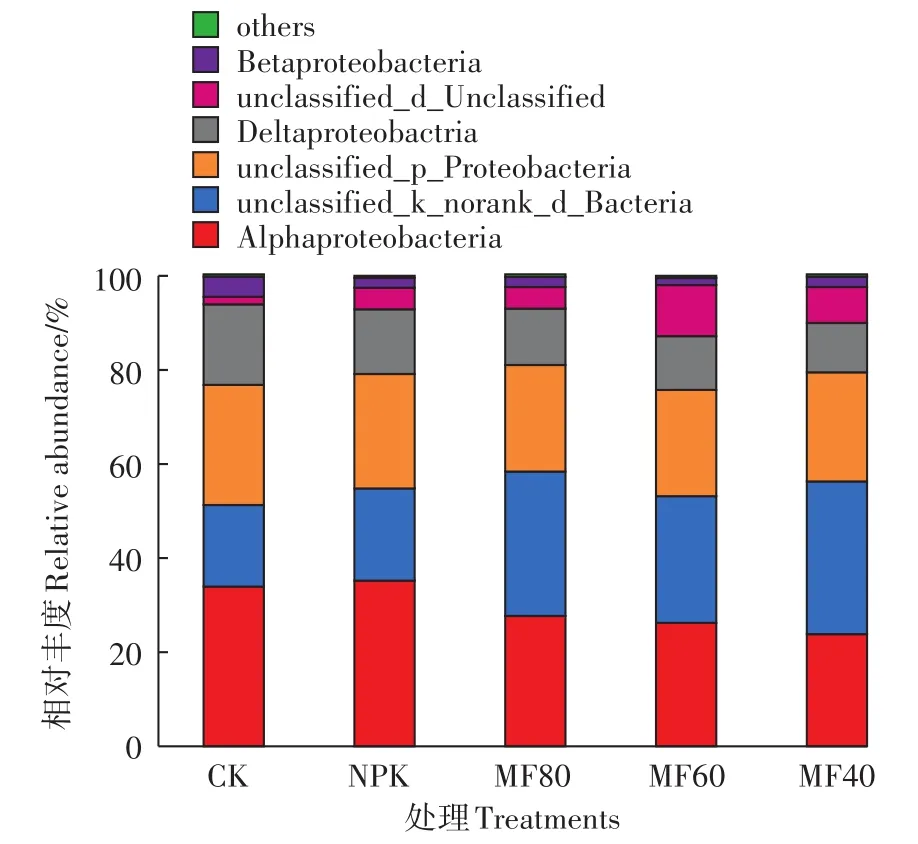
图4 不同施肥处理土壤固氮菌纲水平组成Figure 4 Composition of nitrogen-fixing bacteria at the class level under different fertilizer regimes
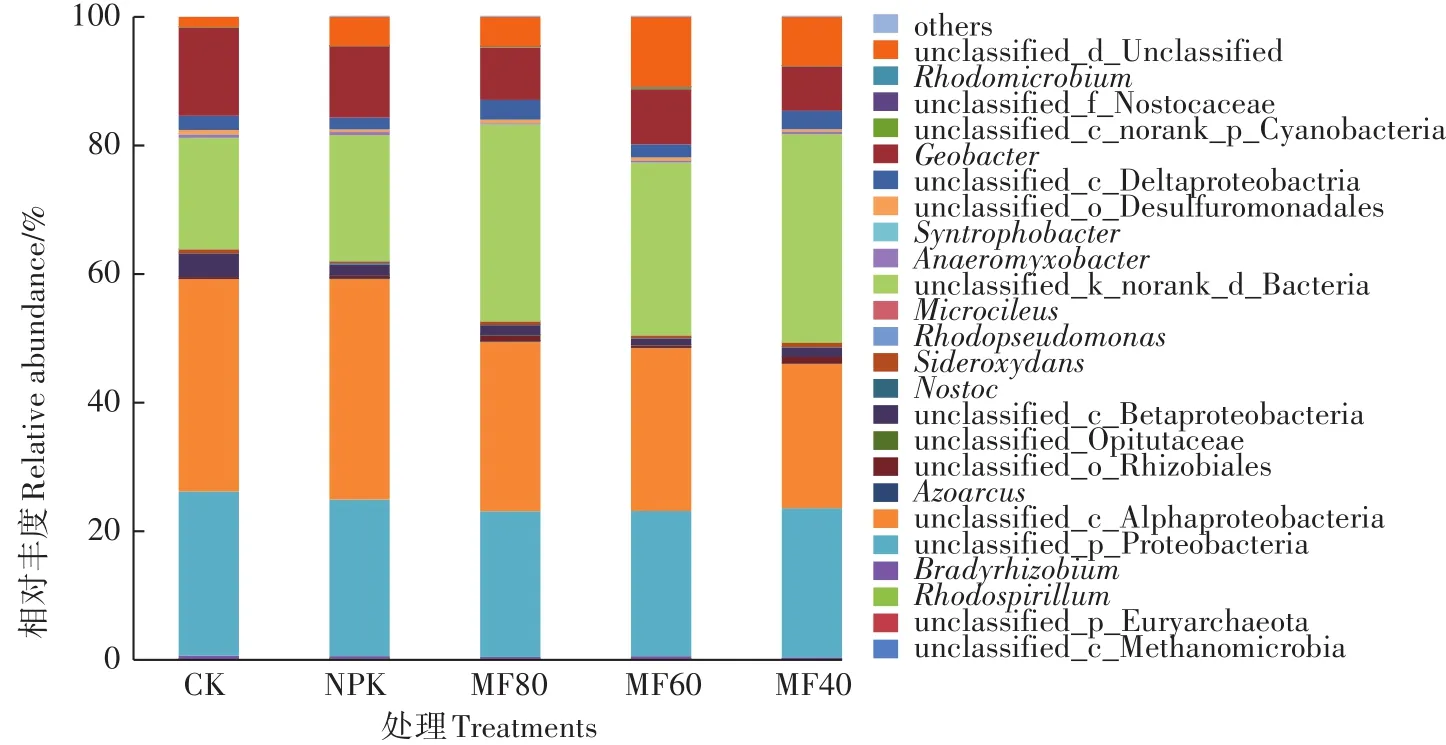
图5 不同施肥处理土壤固氮菌属水平组成Figure 5 Composition of nitrogen-fixing bacteria at the genus level under different fertilizer regimes

图6 不同施肥处理土壤固氮菌主坐标分析Figure 6 Principal coordinates analysis(PCoA)of soil nitrogen-fixing bacteria under different fertilizer regimes based on the bray-curtis distance
我们基于OTU水平对土壤固氮菌群落结构进行主坐标分析(图6)。结果显示:第一和第二排序轴对固氮菌群落变异的解释量分别为36.76%和25.08%,总解释量达到61.84%。由图6可知,施肥处理对土壤固氮菌的群落结构产生较大的影响,CK和NPK处理固氮菌的群落结构较相似,而翻压紫云英的所有施肥处理都与NPK处理距离较远,表明翻压紫云英明显改变了土壤固氮菌的群落结构。而在翻压紫云英的处理间,MF40和MF80处理的样本距离较近,表明两者的固氮菌群落结构较相似,而MF60与它们距离较远。主坐标分析表明紫云英配施减量化肥处理与NPK处理的土壤固氮菌群落结构存在明显的差异。有研究表明,氮肥和有机肥的施用会影响土壤固氮菌的群落组成[33]。本研究中与CK和NPK处理相比,翻压紫云英的减量化肥处理土壤固氮菌组成发生了明显改变,可见绿肥和化肥用量都影响了固氮菌的群落组成。与单施化肥相比,翻压紫云英处理改变了土壤理化性质,而水稻的根系分泌物可能也会随之产生变化,分泌物的变化改变了土壤的微环境,从而引起土壤固氮菌群落组成的变化。
2.3.4 土壤固氮菌与环境因子的相关性分析
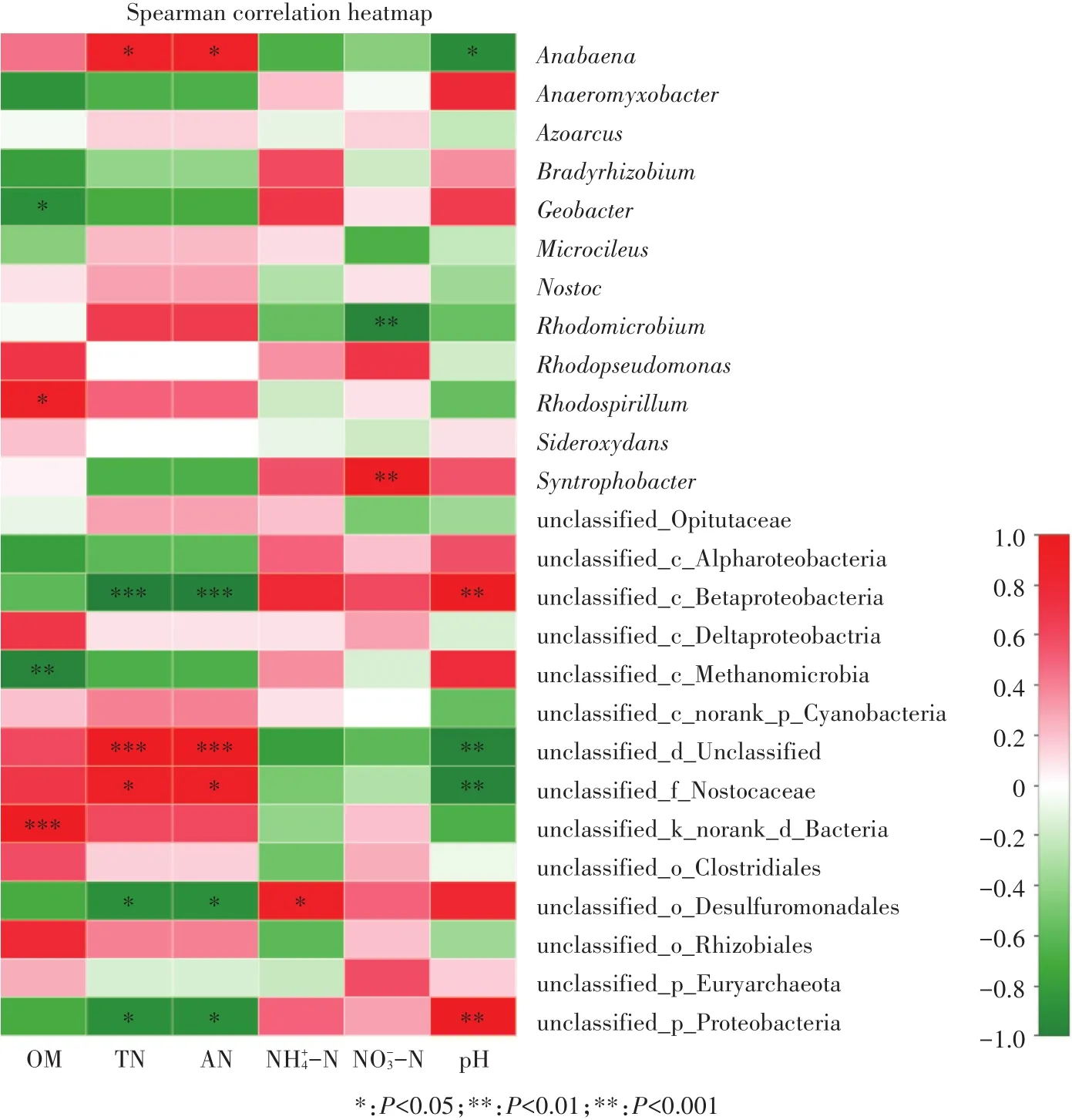
图7 土壤固氮菌群落组成与土壤因子的相关性分析Figure 7 Spearman′s correlation heatmap of nitrogen-fixing bacterial community composition at the genus level and soil properties
对固氮菌群落组成(属水平)和环境因子进行相关性分析见图7。由图7可知,环境因子和土壤固氮菌群落有着显著的相关性,尤其是土壤TN和AN。土壤 TN、AN 含量和 Anɑbɑenɑ、unclassified Nostocaceae呈显著正相关(P<0.05),与unclassified Proteobacteria、unclassified Betaproteobacteria和 unclassified Desulfuromonadales呈显著负相关(P<0.05)。土壤pH与固氮菌丰度也有显著的相关性,例如pH与unclassified Proteobacteria和unclassified Betaproteobacteria呈显著正相关(P<0.05),而与Anɑbɑenɑ、unclassified Nostocaceae呈显著负相关(P<0.05)。Juraeva等[34]研究发现,土壤TN含量能够影响固氮菌的分布。何冬华等[35]和董志新等[36]研究报道pH对固氮菌群落也会产生显著影响。本研究中环境因子与固氮菌群落组成的相关性分析说明土壤中固氮菌的群落结构可由多个土壤性质共同影响和控制。
3 结论
(1)在长期施肥条件下,翻压紫云英配施减量化肥有利于提升土壤肥力和固氮菌的数量,并且提升幅度与化肥用量有关。
(2)翻压紫云英配施减量化肥处理对土壤固氮菌群落结构产生明显影响。翻压紫云英和化肥用量都是影响土壤固氮菌组成的重要因素。

