游离β人绒毛膜促性腺激素定量测定化学发光免疫分析法的建立与性能评价
伍华颖王小艳李志雄董志宁吴英松徐伟文
游离β人绒毛膜促性腺激素(free β human chorionic gonadotrophin,f-β-hCG)是由胎盘合体滋养细胞合成与分泌的一种糖蛋白激素,分子量为22.2 KD,是人绒毛膜促性腺激素(human chorionic gonadotrophin,HCG)的特有结构,决定其分子的生物学和免疫学特性。f-β-hCG在怀孕过程中伴随HCG一起出现及增长,因此是诊断早孕和孕中期的一项重要的检测指标[1-4]。血清中f-β-hCG测定不仅能诊断先兆流产、异位妊娠、葡萄胎、唐氏综合征、子痫前期等疾病[5-7],也是治疗后及预后观察的重要检测指标。f-β-hCG检测还对生殖系统肿瘤如卵巢癌、滋养细胞肿瘤、男性睾丸肿瘤有辅助诊断价值,对一些非生殖系统的肿瘤也有一定辅助诊断意义[8-9]。随着二胎政策的开放,高龄产妇增加,高危妊娠、异常妊娠概率相应增加,因此能准确测定作为孕期重要检测指标的f-β-hCG变得尤其重要。本研究旨在研制一种快速的、灵敏度高、准确性好的f-β-hCG定量测定化学发光试剂盒,以期为临床提供新的可选用的f-β-hCG检测试剂。
1 材料与方法
1.1 材料
1.1.1 样本
确定参考值范围的样本:年龄在21~45岁未怀孕的女性健康查体者血清样本137例,平均年龄为34.5岁;年龄在19~48岁的9~13周低风险的孕妇血清样本635份,平均年龄为31.2岁,其中孕9周125例、孕10周129例、孕11周123例、孕12周131例、孕13周127例。
检测效能比对的样本:年龄在20~46岁的孕妇血清样本209例,平均年龄为38.3岁,其中孕9周11例、孕10周14例、孕11周62例、孕12周68例、孕13周54例。
以上血清样本均来自中国人民解放军兰州军区乌鲁木齐总医院。
1.1.2 试剂
一对配对f-β-hCG单克隆抗体均为美国Meridian公司产品;人源性f-β-hCG蛋白来源于美国Fitzgerald公司;磁微球购自美国的Invitrogen公司;发光物质吖啶盐来自于苏州亚科科技股份有限公司;德国罗氏公司的游离β-绒毛膜促性腺激素定量测定试剂盒(电化学发光法);企业标准品和企业质控品由广州市达瑞生物技术股份有限公司制备。
质控品:含3个不同浓度水平的血清质控品,批号:201701,购自广州邦德盛生物科技有限公司。
1.1.3 仪器
厦门优迈科医学仪器有限公司的全自动化学发光免疫分析仪;德国罗氏公司cobas e601全自动电化学发光免疫分析系统。
1.2 方法
1.2.1 磁微球包被抗体
取0.5 mg f-β-hCG单克隆抗体于超滤离心管中,用0.1 mol/L MES缓冲液重复洗涤8次,收集抗体待用;磁微球用0.1 mol/L MES缓冲液清洗6次后活化20 min,活化后的磁微球再用0.1 mol/L MES缓冲液重复洗涤6次,加入收集好的待用的抗体,放置37℃振荡反应24 h;用0.1 mol/L MES缓冲液重复洗涤2次,再用含5%BSA的Tris缓冲液37℃振荡2 h进行封闭未结合位点;用含5%BSA的Tris缓冲液洗涤2次,加入含有蛋白保护剂的缓冲液,放置于2~8℃保存。
1.2.2 抗体标记吖啶盐
取0.5 mg单克隆抗体于超滤离心管中,用0.1 mol/L PB缓冲液重复洗涤6次后收集抗体,将0.01 mg吖啶盐加入收集好的单克隆抗体中,放置于恒温摇床上避光反应16 h,进行分离纯化,纯化后的标记抗体加入蛋白保护剂,放置于2~8℃保存。
1.2.3 使用浓度的选择
1.2.3.1 磁微球使用浓度的选择
将包被有抗体的磁微球稀释到50 μg/mL、100 μg/mL、200 μg/mL 3个使用浓度,分别加入25 μL抗原及100 μL标记有吖啶盐的抗体,恒温37℃条件下反应30 min后进行清洗,加入预激发液和激发液进行发光值检测。通过发光值比较得出磁微球的使用浓度为200 μg/mL。
1.2.3.2 吖啶盐标记物使用浓度的选择
将标记有抗体的吖啶盐稀释到15 ng/mL、30 ng/mL、60 ng/mL 3个使用浓度,分别加入25 μL抗原及50 μL 200 μg/mL磁微球,恒温37℃条件下反应30 min后进行清洗,加入预激发液和激发液进行发光值检测。通过发光值比较得出吖啶盐标记物使用浓度为30 ng/mL。
1.2.4 反应步骤选择
1.2.4.1 一步法
分别将25 μL样本、50 μL包被有抗体的磁微球、100 μL标记有吖啶盐的抗体依次加入反应杯,恒温37℃条件下反应30 min后进行清洗,加入预激发液和激发液进行发光值检测。
1.2.4.2 一点五步法
将25 μL样本、50 μL包被有抗体的磁微球加入反应杯,恒温37℃条件下反应15 min,再加入100 μL标记有吖啶盐的抗体,继续于恒温37℃条件下反应15 min后进行清洗,加入预激发液和激发液进行发光值检测。
1.2.4.3 两步法
将25 μL样本、50 μL包被有抗体的磁微球加入反应杯,恒温37℃条件下反应15 min后进行清洗,加入100 μL标记有吖啶盐的抗体,继续恒温37℃条件下反应15 min,再进行清洗,加入预激发液和激发液进行发光值检测。
1.2.5 反应原理
f-β-hCG化学发光法的反应原理如图1。
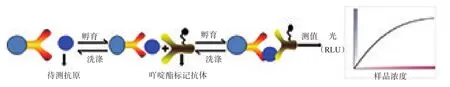
图1 f-β-hCG的反应原理Figure 1 The reaction of f-β-hCG
1.3 分析性能评价
1.3.1 最低检测限试验
用自制的f-β-hCG试剂盒对零浓度校准品进行重复测定20次,计算20次测量结果的平均发光值(mean,M)和标准差(standard deviation,SD),得出M+2SD值,根据零浓度校准品和相邻浓度校准品的发光值进行两点回归拟合得到一次方程,将M+2SD值代入上述方程中,计算得到的浓度即为最低检出限。
1.3.2 准确性试验
用样本稀释液对游离β-绒毛膜促性腺激素国家标准品进行稀释,使其最终浓度约为5 ng/mL和100 ng/mL,将其作为样本重复检测3次,测得的平均浓度记为M,根据公式:测量偏差=(M-理论值)/理论值×100%。
1.3.3 线性试验
用高值样本按5个比例稀释为5个不同浓度样本,其中最低浓度样本的浓度值接近最低检测限浓度值。对5个浓度样本分别进行3次重复检测,计算每个样本的平均值,再用样本的平均值和相应的稀释比例进行四参数拟合,计算线性相关系数r。
1.3.4 重复性试验
用自制的f-β-hCG试剂盒分别对浓度为20 ng/mL、50 ng/mL、150 ng/mL 3个低、中、高浓度的企业质控品进行重复检测20次,再分别计算出每个质控品20次检测结果的平均值(M)和标准差(SD)值,按变异系数(variable cofficient,CV)公式CV=SD/M×100%得出变异系数。
1.3.5 批间精密度试验
用3个不同批次自制f-β-hCG试剂盒分别检测3个低、中、高浓度的企业质控品,重复检测20次,计算60次测量结果的平均值M和标准差SD,计算其变异系数(CV)。
1.3.6 特异性试验
用自制f-β-hCG试剂盒对促甲状腺激素(300 mIU/L)、促卵泡激素(200 IU/L)及促黄体生成素(250 IU/L)进行检测,各检测3次。
1.3.7 参考值范围
用自制的f-β-hCG试剂盒检测经德国罗氏公司β-绒毛膜促性腺激素定量测定试剂盒(电化学发光法)检测的772份血清样本,其中635例为9~13孕周的低风险母体血清样本,137例为未怀孕查体者的血清样本,根据检测结果提供自制试剂盒的参考值范围。
1.3.8 样本检测效能比对
以德国罗氏公司的β-绒毛膜促性腺激素定量测定试剂盒(电化学发光法)作为对照试剂,用自制的f-β-hCG试剂盒检测209例孕妇血清样本,分析2种试剂盒检测结果的相关性和一致性。
1.4 统计学处理
用OrigiPro7.5进行四参数拟合建立自制试剂盒线性相关系数r,及对不同反应模式的浓度梯度f-β-hCG剂量-反应拟合Hill曲线,选择线性关系较好的曲线对应的反应模式。利用SPSS 24.0统计软件统计分析f-β-hCG在各孕周的浓度分布情况及相关性;用Medcalc软件进行Bland-Altman分析,对2种试剂盒的一致性作进一步分析。
2 结果
2.1 反应步骤选择
用包被有抗体的磁微球和标记有抗体的吖啶盐按照一步法、一点五步法、两步法反应步骤,以双抗体夹心法建立f-β-hCG的化学发光免疫分析法,对不同浓度f-β-hCG企业标准品进行检测。将剂量-反应拟合Hill曲线,结果见表1,根据表1结果可知3种反应步骤中一步法不仅本底比较高且曲线线性相关性比较差,两步法本底比较低且曲线线性相关性最好,R2为0.997 6。所以我们选择了曲线线性相关性最佳的两步法。

表1 浓度与发光值的Hill曲线方程Table 1 Hill curve equation of concentration and luminescence
2.2 分析性能评价
2.2.1 自制f-β-hCG试剂盒定标与质量控制
用校准品对自制f-β-hCG试剂盒进行校准曲线定标,定标成功后,再用第三方广州邦德盛生物科技公司的血清质控品进行质量控制,定标结果见图2,质量控制结果见表2。

表2 质控品检测结果Table 2 Measurement results of control
2.2.2 最低检测限
根据零浓度校准品和相邻浓度校准品的浓度-发光值的结果进行两点回归拟合,得出一次性方程,得到零浓度校准品的M值为1 051,SD值为32.41,将零浓度校准品的M+2SD值1 115.82代入上述方程中,得到最低检测限为0.006 ng/mL,不高于0.5 ng/mL。
2.2.3 准确性
对浓度稀释至5 ng/mL和100 ng/mL的2个f-β-hCG国家标准品样本进行检测,浓度为5 ng/mL的国家标准品样本的检测结果为(5.13±0.21)ng/mL,相对偏差为4.43%;浓度为100 ng/mL的国家标准品样本的检测结果为(98.45±2.33)ng/mL,相对偏差为2.56%。本试剂盒准确性相对偏差均在±10%范围内。
2.2.4 线性
用浓度为200 ng/mL高值样本按5个比例稀释为5个不同浓度样本,对5个浓度样本分别进行3次重复检测,计算每个样本的平均值,将检测结果进行四参数拟合,得出线性方程为Y=359 847.365 87+(0.068 94-359 847.365 87)/(1+(X/1 924.888 42)0.99185,线性相关系数R2为1,线性很好(表3、图3)。
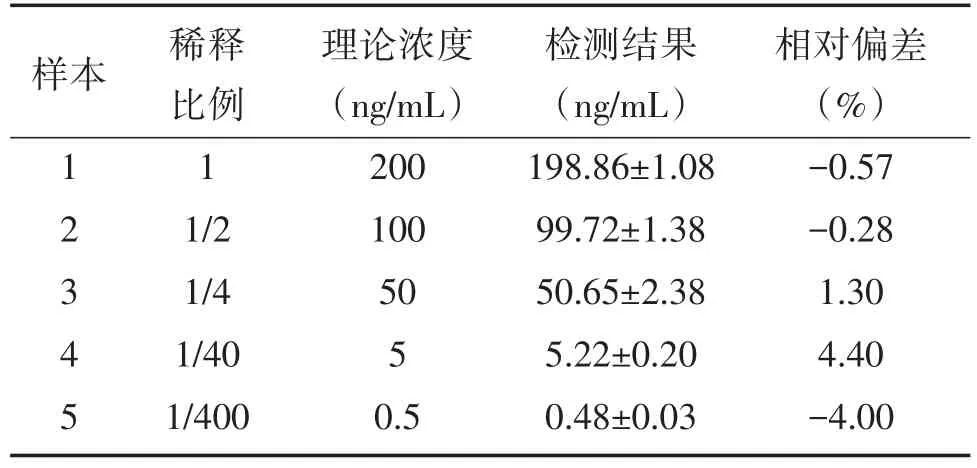
表3 线性检测结果(n=3)Table 3 Measurement results of linearity(n=3)
2.2.5 重复性
其变异系数(CV)在1.83%~4.35%之间,均小于8%,结果见表4。
2.2.6 批间精密度试验
用3个批次自制f-β-hCG试剂盒分别检测浓度为20 ng/mL、50 ng/mL、150 ng/mL 3个低、中、高浓度的企业质控品,其变异系数(CV)分别为2.88%、5.43%、3.67%,均小于15%,结果见表4。

图2 f-β-hCG定标曲线Figure 2 Calibration curve of f-β-hCG
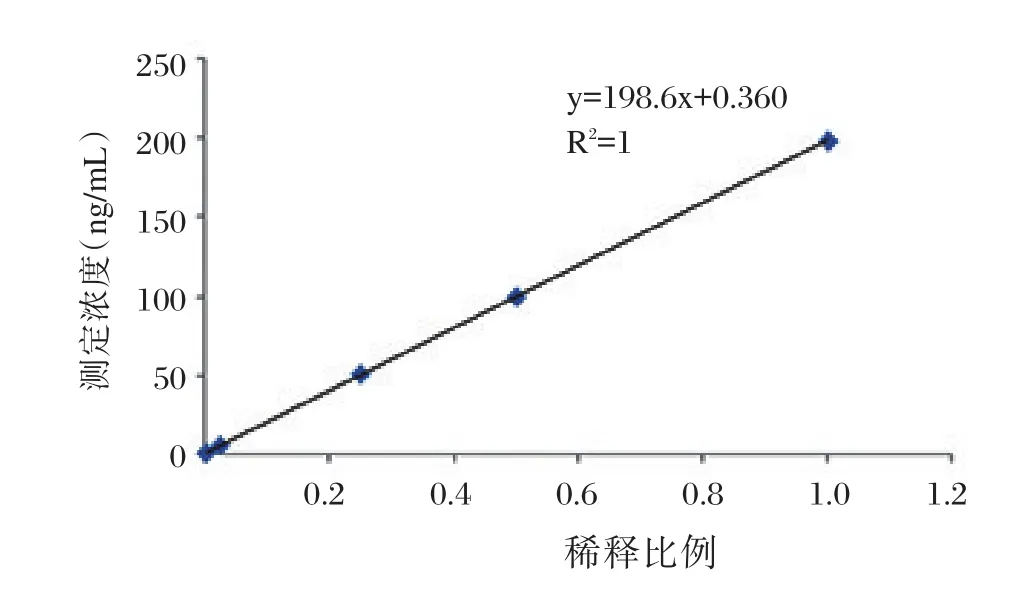
图3 f-β-hCG线性拟合Figure 3 Linear fitting of f-β-hCG
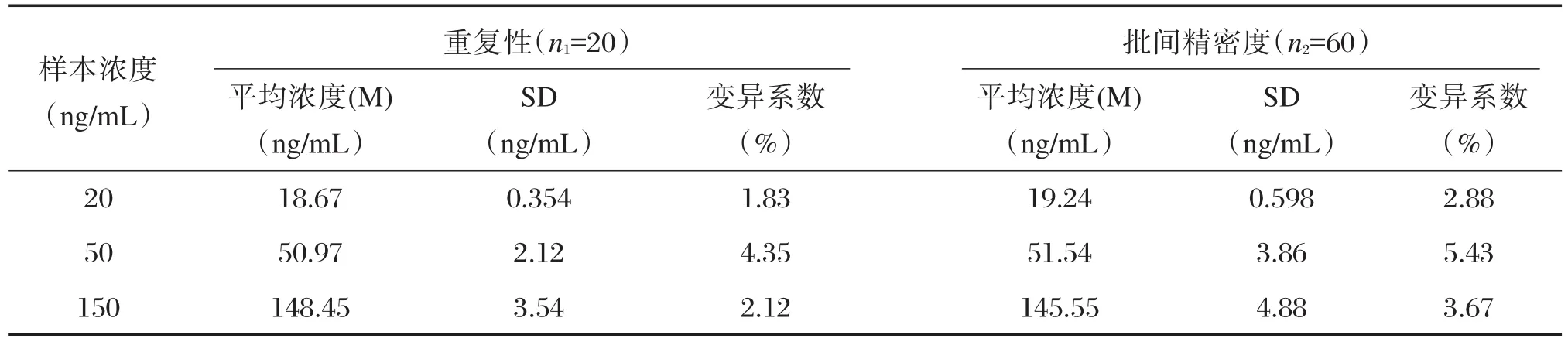
表4 重复性和批间精密度的结果Table 4 The results of repeatability and precision between different assays
2.2.7 特异性
将促甲状腺激素(300 mIU/L)、促卵泡激素(200 IU/L)及促黄体生成素(250 IU/L)作为样本用自制f-β-hCG试剂盒检测,结果见表7,本自制试剂盒对促甲状腺激素检测结果为(0.32±0.015)ng/mL、促卵泡激素检测结果为(0.24±0.031)ng/mL、促黄体生成素检测结果为(0.45±0.024)ng/mL,交叉反应检测结果均不高于0.5 ng/mL。
2.3 参考值范围建立
用自制f-β-hCG试剂盒对137份未怀孕查体者的血清样本进行检测,检测结果用SPSS 24.0统计软件进行统计分析,并对检测结果按百分数法进行排序,得到未怀孕查体者样本研究的参考范围为0~0.5 ng/mL,结果见图4。
用自制f-β-hCG试剂盒对635份9~13周低风险的孕妇血清样本进行检测,分别列出每个孕期的平均值、中位数、第二点五位百分数和第九十七点五位百分数,为自制f-β-hCG试剂盒提供不同孕周f-β-hCG的正常值参考范围,结果见表5。
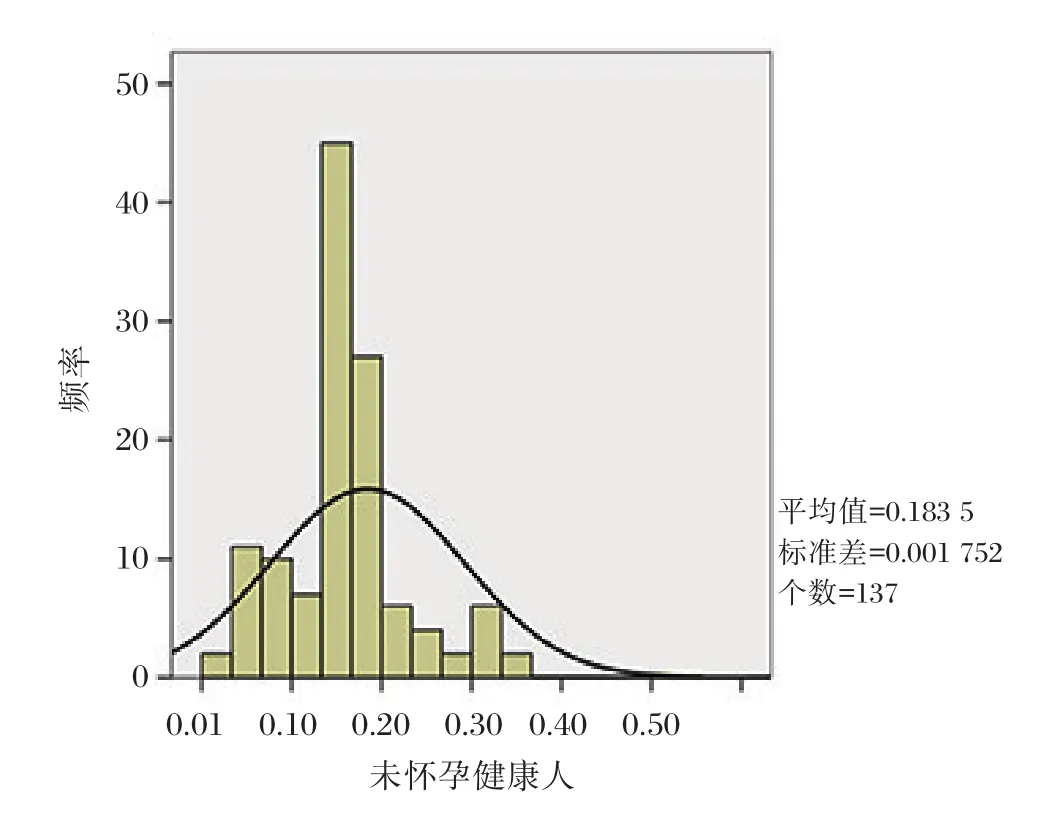
图4 137份未怀孕查体者f-β-hCG测值直方图Figure 4 Historgram of f-β-hCG in 137 unpregnant women
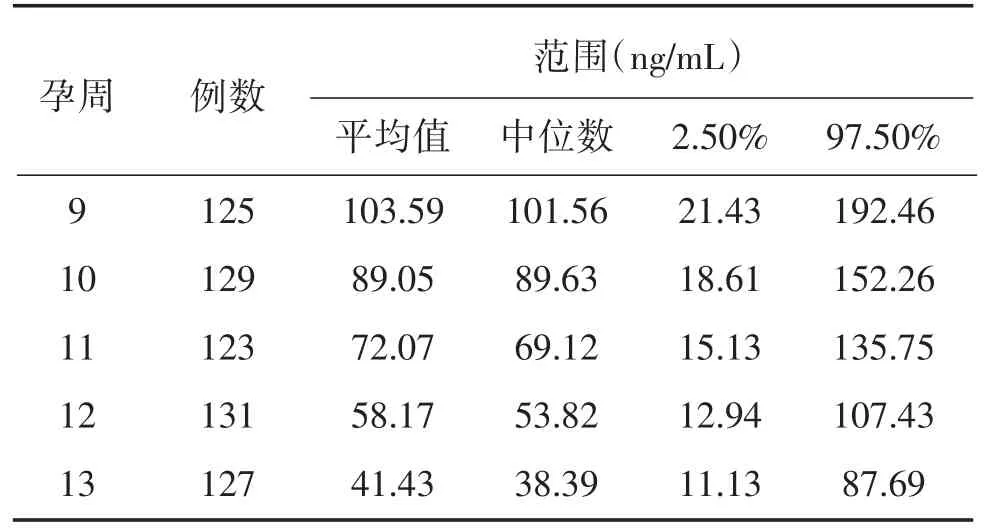
表5 不同孕周孕妇血清中f-β-hCG的浓度Table 5 Concentrations of f-β-hCG in serum at different weeks of gestation
2.4 样本检测效能比对
对年龄在20~46岁的孕9~13周的209份孕妇血清样本进行检测,根据各孕周的正常参考值范围,对照试剂检测出高值样本46例,低值样本33例,正常样本130例;自制试剂盒检测出高值样本46例,低值样本35例,正常样本128例,两者不一致样本有4例,见表6。从定性结果的一致性上分析,自制试剂盒与对照试剂盒的高值异常符合率为97.8%,低值异常符合率为94.3%,正常符合率为99.2%,总符合率为98.1%。
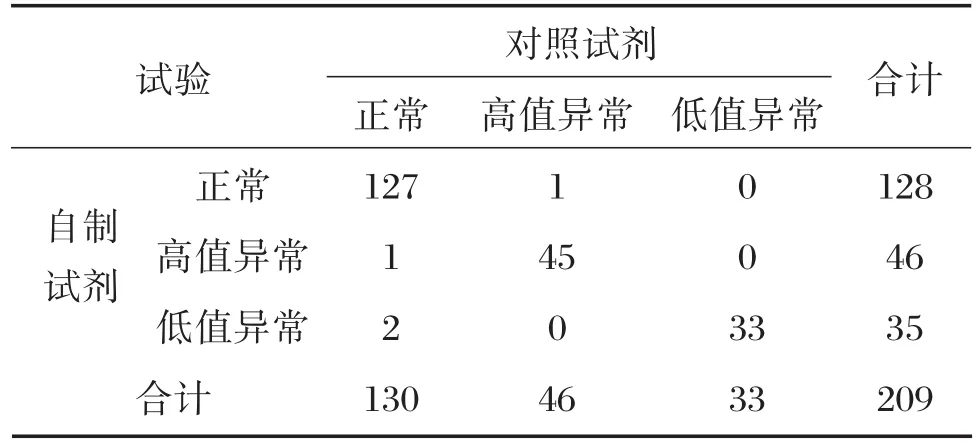
表6 样本统计归纳表Table 6 Table of sample statistics summary

表7 样本一致性的计算结果Table 7 The calculated results of Kappa values for sample

表8 样本相关性分析结果Table 8 The results of correlation analysis for sample
采用SPSS 24.0统计软件计算卡方值及其置信区间、相关性r值、线性回归方程和画出散点图。一致性达0.965(P<0.01,95%置信区间为0.934~0.992)(表7),相关性r值为0.992(P<0.01,95%置信区间为0.989~0.995)(表8),线性回归方程为y=1.131x+0.826(P<0.01,B的95%置信区间为1.111~1.151)(表9),散点图见图5,判定系数R2=0.980。采用MedCalc统计软件作Bland-Altman分析,对自制试剂盒和对照试剂盒的一致性作进一步分析,为了使Bland-Altman分析图成正态分布,将自制试剂盒与对照试剂盒的测值进行对数转换,使用其对数值进行Bland-Altman分析,以自制试剂盒测值对数与对照试剂盒测值对数的均值为X轴,以两者的差值为Y轴,绘制散点图(图6),由图6可见,差值的均数为-0.07,差值95%的分布界限,即95%一致性界限为(-0.01~0.14)ng/mL,经反对数变换,95%一致性界限为(0.98~1.38)ng/mL,偏差在±2.5 ng/mL之间。在95%一致性界限的可信区间之外,仅有6.2%(13/209)的点存在;在95%一致性界限的可信区间之内,其中差值绝对值的最大值为0.02,而其均值为1.90,经反对数变换,差值绝对值的最大值为1.08 ng/mL,其均值为79.4 ng/mL。
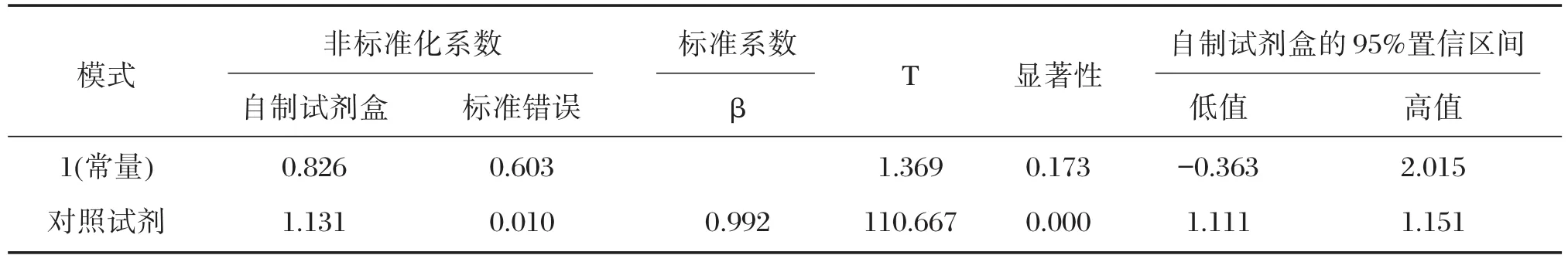
表9 样本线性回归分析表Table 9 The analysis of linear regression for sample
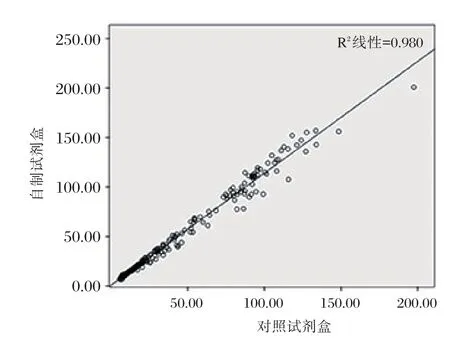
图5 相关性分析散点图Figure 5 The scatter plot of correlation analysis
3 讨论
在女性健康方面,f-β-hCG的测定在临床上有助于诊断和检测妊娠滋养细胞疾病[10-13]及早期诊断不良妊娠,是识别绒毛膜癌和胎盘部位滋养细胞肿瘤的一个标志物。f-β-hCG也是女性多种非滋养细胞恶性肿瘤中的一个标志物,如宫颈癌、卵巢癌、乳腺癌。f-β-hCG联合CA125检测可提高卵巢癌的诊断率。
然而f-β-hCG并非女性的专属肿瘤标志物,在男性生殖细胞肿瘤特别是睾丸癌的检测与跟踪中,f-β-hCG的检测也具有很重要的意义。对于胃肠道、肝部的恶性肿瘤的检出,f-β-hCG的检测同样具有意义[14]。
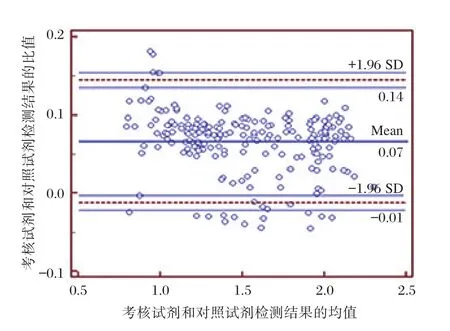
图6 Bland-Altman分析图Figure 6 The chart of Bland-Altman analysis
f-β-hCG检测对预后评价起着重要的作用。在胃肠道肿瘤和卵巢癌中,f-β-hCG是一个独立的预后因子;f-β-hCG在临床上亦用于监控肺癌;f-β-hCG蛋白的高表达是乳腺癌不良预后的明显标志。因此,肿瘤患者在治疗之前检测f-β-hCG可为临床医生提供非常重要的治疗指导作用[15]。
目前临床上用于定量检测f-β-hCG的方法主要有放射免疫分析法、时间分辨荧光法、酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)法、化学发光法等。过去以放射免疫分析法为代表的游离β人绒毛膜促性腺激素测定试剂盒,由于受方法学的限制,存在试剂稳定性差、放射性污染等缺点,且操作过程比较复杂,已基本上退出市场,目前应用较广泛的是酶联免疫检测技术和化学发光技术[16-17]。
本研究以双抗体夹心法建立了一种定量检测f-β-hCG的化学发光技术新方法,用磁微球以共价交联的方式包被抗体作为固相载体,不仅实现管式全自动化,还能增强发光信号,提高稳定性[18]。用吖啶盐作为标记物,以过氧化氢和氢氧化钠为启动剂,直接发光反应、简单、快速、稳定、无放射性同位素损伤和污染。
迄今国内外暂未有用吖啶盐标记测定f-β-hCG的化学发光方法的相关报道,因此,本研究在质控品检测结果均符合要求、实验结果准确可靠的情况下,对自制f-β-hCG试剂盒进行各项性能评价,自制试剂盒的最低检测限能达到0.006 ng/mL,而国内外市场使用率较高的罗氏进口f-β-hCG试剂盒最低检测限为0.01 ng/mL,自制试剂盒灵敏度更优;通过样本效能比对试验,自制试剂盒与罗氏进口试剂盒的相关性达到0.992、一致性达到0.965,总符合率为98.1%,说明自制试剂盒与进口试剂盒具有较好的一致性,同时也说明了自制试剂盒质量甚至更优于进口试剂盒。自制试剂盒的准确度的相对偏差最高为4.43%,其具有良好的重复性和精密性,批内重复性CV值小于8%,批间精密度试验CV值小于15%,线性范围在0~200 ng/mL之间,相关性很好,特异性比较高。
自制试剂盒与罗氏进口试剂盒进行样本检测效能比对,自制试剂盒的一致性达到0.965,相关性r值达到0.992,说明自制试剂盒与应用较广的进口试剂盒具有较好的一致性及等效性。
根据郭翀等人[19]和邹丽萍[20]分别用时间分辨荧光法及光激化学发光法评价f-β-hCG的结果,时间分辨荧光法及光激化学发光法的灵敏度分别为0.09 ng/mL和0.11 ng/mL、重复性均CV值小于10%,而自制试剂盒的灵敏度能达到0.006 ng/mL、重复性CV值小于8%。因此,本研究用化学发光法研究的自制试剂盒各项性能均优于用时间分辨荧光法及光激化学发光法研制的试剂盒。综上所述,用化学发光法建立的游离β人绒毛膜促性腺激素定量测定试剂盒灵敏度高、准确性高、重复性好、线性范围宽、特异性高,有望能替代昂贵的进口试剂应用于临床检测及研究。