LED植物保鲜灯对玫瑰花保鲜的影响
靳肖林,文尚胜,2,付 萌,侯一曼,蔡明兴
(1.华南理工大学材料科学与工程学院,广东 广州 510640;2.华南理工大学发光材料与器件国家重点实验室,广东 广州 510640)
引言
植物工厂极大地提高了作物质量和产率[1,2],其中光环境对植物生长过程中生理活动的调节起着巨大作用[3]。LED的光谱可动态控制,加之其高光能利用率,低能耗,长寿命,使得LED正逐渐成为主流植物照明光源[4-6]。玫瑰是一种具有很高经济价值的花卉,但是玫瑰鲜花花期短[7],而光照处理对果蔬采后生理变化有显著影响,通过影响叶绿素的组成及含量[8],以及抗氧化酶的活性,起到延缓植物衰老的保鲜作用[9-11]。我们将设计的光谱可调LED植物灯用于玫瑰花保鲜实验,通过PWM调光调节RGB LED的光谱组成,探究光质和光照周期对切花玫瑰采后失水率、抗氧化物质含量的影响,并力求探索出最有利于玫瑰花采后保鲜的光照条件,为LED光源在蔬果保鲜和花卉栽培领域的应用提供相应的科学参考。
1 实验材料与实验设计
1)供试材料处理。实验用红色玫瑰花品种“超大号”,釆自于广州市岭南花卉市场,采购时选取大小均匀、成熟度一致、花苞紧实的切花玫瑰(图1)。采购的玫瑰花在2 h内运回实验室。
切花玫瑰的处理:摘掉保护网,去除玫瑰花刺、叶片以及残损的花瓣,以避免与变量无关因素对实验结果的影响。

图1 实验用鲜切玫瑰花Fig.1 Fresh cut roses for experiments
2)保鲜实验光环境设计。根据光子生物学的理论知识,从光质比、光周期、光量子通量密度(PPFD)三个方面对光源参数进行设定。实验中使用的LED光源为设计的光谱可调LED灯具,通过PWM调光模块对光谱进行调控,使得四个实验组红光(R)、绿光(G)、蓝光(B)光质比分别为A组:R+G+B,B组:G+B,C组:R+G,D组:G,对照组为自然光照射,其光照周期由自然环境决定(8 h/24 h~12 h/24 h),其光强为30~150 μmol·m-2·s-1(且仅在中午12:00—14:00才可能达到最大光强)。各组光源的光谱如图2所示。实验中控制每组光源在距离10 cm的接收面上的PPFD值为60 μmol·m-2·s-1,每组内再设置三组光照周期分别为6 h/24 h、9 h/24 h、12 h/24 h的实验组。实验室温度控制在25 ℃±1 ℃,相对湿度控制在65%±1%。将玫瑰花置于A、B、C、D四组光质不同的光环境及对照组下进行实验。实验数据由远方SPIC-200B光谱彩色照度计进行测量。

图2 实验组光谱图Fig.2 Spectra of experimental groups
2 玫瑰保鲜实验指标的测定测定
实验每次测定重复3次,每个指标每次测定取各组的三朵鲜切玫瑰花。
1)失重率测定。每天早上8点用电子天平称每个实验组切花玫瑰(6朵)的鲜重M,14:00称A~D组光照周期为6 h实验组玫瑰花(6朵)的鲜重m1,17:00称A~D组光照周期为9 h实验组玫瑰花(6朵)的鲜重m2,20:00称A~D组光照周期为12 h实验组玫瑰花(6朵)的鲜重m3,实验组玫瑰花日失重率w1由公式(1)计算。
(1)
2)多酚的测定。在6天实验结束后,对玫瑰花内部多酚总含量进行测定。
新鲜花朵取其花瓣,用电子天平准确称取1.5 g,磨碎,用50 ml蒸馏水定容,置三角瓶中,密封,(99±1)℃恒温水浴30 min,提取水溶性物质,迅速冷却,常温(25 ℃)离心10 min,取上清液(花卉粗提液)作为待测试样。
测定方法:吸取l ml待测试样,加入4 ml蒸馏水,加入5 ml酒石酸亚铁溶液,再用100 mmol/LPBS(pH 7.5)定容到25 ml,以蒸馏水代替供试液加入同样试剂作为空白,540 nm波长下测定吸光度(A),重复3次,根据公式(2)计算多酚含量(mg/g)[12]。
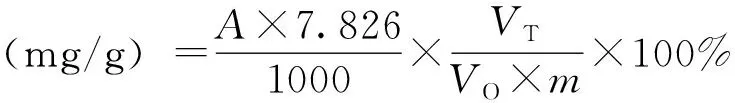
(2)
其中VT为供试液总量,VO为吸取供试液量,m为样品质量;7.826是按上述操作条件,当吸光值等于1.0时,每毫升玫瑰花提取液中多酚类物质的毫克数。
3)类黄酮的测定。在6天实验结束后,对玫瑰花内部类黄酮总含量进行测定。
玫瑰花在40 ℃条件下干燥4 h后粉碎,用精密仪器精确称量2g玫瑰花和过筛的花渣,使用70 W超声波在料液比1∶15和75%乙醇条件下提取30 min,趁热过滤,浓缩至干,用 30%的乙醇溶解定容在100 ml容量瓶中,得到玫瑰花提取液。
黄酮类化合物与铝盐作用后,生成黄色深浅与黄酮的含量成比例关系的黄酮铝盐络合物。以芦丁标准曲线为对标准,对提取液与铝盐作用产物的吸光度进行测定,采用紫外分光光度法测定总黄酮的含量[13]。吸取1 ml提取液于25 ml比色管中,测定吸光度A,并通过标准曲线的回归方程换算成浓度Y(mg/ml),则玫瑰花提取液中总黄酮含量为
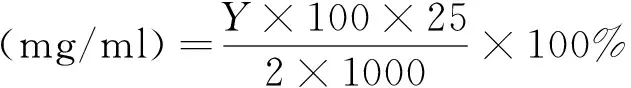
(3)
4)花色苷的测定。在6天实验结束后,对玫瑰花内部花色苷总含量进行测定。
采用经典的pH示差法对切花玫瑰花色苷含量进行测定。测得的总花色苷含量用矢车菊花色苷元-3-葡萄糖苷含量表示。在200~700 nm波长范围内扫描,得到花色苷在此波段的最大吸收波长,然后分别用pH 1.0的盐酸氯化钾缓冲液和pH 4.5的醋酸-醋酸钠缓冲液稀释样品,平衡后在最大吸收波长处测定二者的吸光度。用700 nm处吸光度来作为模糊度的校正[14],花色苷含量计算公式如下:
(4)
其中吸光度A=(Amax-A700 nm)pH1.0-(Amax-A700 nm)pH4.5;MW(以矢车菊-3-葡萄糖苷计)=花色苷分子量(449.2);DF为稀释倍数;ε(以矢车菊-3-葡萄糖苷计)=摩尔消光系数(29600);s为光程。
3 实验结果与分析
3.1 光质与光照周期对切花玫瑰采后失重率的影响
由植物生理学基础可知,切花玫瑰在离开母体后仍进行正常的水分代谢、呼吸代谢,且糖分和蛋白质含量均有变化,消耗自身储备的有机物和水分必将会导致玫瑰花的重量减少,从而引发失重(见图3)。

图3 不同光质组玫瑰的日失重率Fig.3 The daily weight loss rate of roses in different light quality groups
由图3可以看出,在光照周期相同时,前三天自然光对照组失重率最高,后三天自然光组失重率增长速度明显减慢,与此同时(R+G+B)组失重率增长迅速,实验结束时各实验组失重率关系为:(R+G+B)>自然光对照组>G>(B+G)>(R+G)>(R+B)control。实验前对玫瑰花处理,摘掉了其叶片,排除了采后光合作用的影响。实验结果表明,红蓝光对照组失重率最低,我们猜测这种光质可能对玫瑰花采后呼吸作用有一定抑制作用,从而减少呼吸作用消耗的水分和有机物。或者这种光质对玫瑰花体内其他生理活动有促进作用,提高了玫瑰花内部有机物的含量这种解释是不合理的。王春昕等[15]研究表明,红光对植物开花影响作用最大,并且可以提高可溶性糖含量。蓝光可以提高蛋白质含量,有利于蒽醌类次生代谢物的积累。红蓝混合光下明显促进兰花的生物量的增加和生长。据此,红蓝光对照组失重率低的原因可能是这种光质组合促进了玫瑰花内可溶性糖和蛋白质的积累;红绿光处理组红光对生物量的积累作用显著,可能原因是红光对物质积累的促进作用抵消了绿光对失重率的影响,此组实验组失重率仍较低。(G+B)光和G光处理略高,因为绿光对生物量积累作用不显著,且蓝光对积累有机物的作用不如红光明显。由(G+B)、(R+G)对比可看出红光比蓝光保持鲜重的效果更好,因为蓝光在促进蛋白质含量上升的同时也促进气孔开放,加快水分流失。气孔主要存在于植物叶片,但花瓣上也有少量。红绿蓝光实验组和自然光对照组失重率较高,自然光组光谱范围较广,除了较为有用的红蓝光,还包括了其他波长光,因此其对减小失重率的作用甚微。
由图4可以看出,在(R+G+B)和G组,光照周期为12 h的实验组失重率最高,9 h组次之,6 h组失重率最低。在(B+G)组,除第5天9 h组失重率最高外,其他时间12 h组失重率最高,且9 h组与其相差不大,6 h组失重率一直最低。在(R+G)组,12 h组失重率一直最高,且在实验最后一天6 h组与12 h组失重率几乎一样高, 6 h组失重率在第3、5、6天超过9 h组。总体来说,光照周期增长,失重率升高,这可能是因为光处理促进玫瑰花生理活动积累的有机物不能抵消长时间光照时其消耗的水分,造成整体失重率下降。
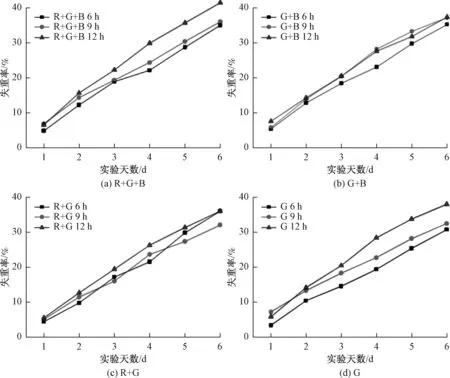
图4 不同光照周期组玫瑰花日失重率Fig.4 The daily weight loss rate of roses in different lighting time groups
3.2 光质与光照周期对切花玫瑰多酚含量的影响
植物多酚的结构复杂,是玫瑰花体内重要的抗氧化剂,对氧自由基有清除能力。对A、B、C、D组内的三个样品多酚含量取平均值,计算其相对于自然光对照组多酚含量的增长比D,如公式(5)所示。数据结果如图5所示。
(5)
四种光质处理均不同程度地促进了多酚含量的上升,使实验组玫瑰花的多酚含量显著高于对照组水平。光照周期为6 h的实验组中,C(红+绿)组多酚含量增长最为显著,高于100%,A(红+绿+蓝)组次之,B、D组样品的多酚含量增长不是很显著。光照周期为9 h的实验组中,A、B组样品多酚含量增长比均超过了100%,C、D组次之。光照周期为12 h的实验组中,四组实验组的增长比均相对9 h组显著下降,其中A、B、C组差别不大,而D组单一绿光光质对多酚含量几乎没有影响。综合实验结果来看,A组(红+绿+蓝)光质、C组(红+绿)光质对促进多酚含量增长作用更为显著。D组单一绿光光质对促进多酚含量作用不明显。

图5 不同实验组相比于对照组鲜切玫瑰多酚含量Fig.5 The content of polyphenols in different fresh cut roses experimental groups
3.3 光质与光照周期对切花玫瑰采后类黄酮含量的影响
类黄酮属于酚类,是天然的抗氧化剂。花黄素类黄酮、黄酮醇及其衍生物统称花黄素类,是广泛分布于植物组织细胞中的一类水溶性色素。
对A、B、C、D组内的三个样品类黄酮含量取平均值,计算其相对于自然光对照组多酚含量的增长比,数据结果如图6所示。
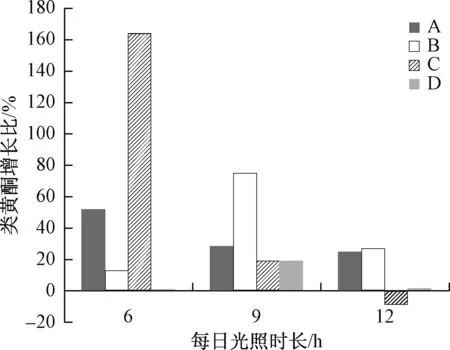
图6 不同实验组鲜切玫瑰类黄酮含量Fig.6 The content of flavonoids in different fresh cut roses experimental groups
B、D实验组中,随光照时长增加,类黄酮含量的增长比先升再降;与此同时,A、C组的类黄酮的增长比一直减小。说明并不是光照周期越长,玫瑰花内部抗氧化剂类黄酮的含量越多,过长的光照周期反而不利于类黄酮含量的积累。6 h和9 h是较适宜类黄酮类物质合成的光照时长。
除了D单一绿光光质,光照时长为12 h组外,四种光质处理均不同程度地促进了类黄酮含量的上升,使其显著的高于对照组水平。光照周期为6 h的实验组中,C(红+绿)组类黄酮含量增长最为显著,超过100%,A(红+绿+蓝)组次之,B、D组样品的类黄酮含量增长不是很显著;光照周期为9 h的实验组中,A、B组样品类黄酮含量增长较为显著,C、D组几乎一样;光照周期为12 h的实验组中,四组实验组的增长比均相对9 h组显著下降,A、B组增长比相近,约为20%;而C组增长比甚至为负值,说明光照周期相同的条件下,本组样品中类黄酮含量比对照组稍低。而D组单一绿光光质对类黄酮含量几乎没有影响。综合实验结果来看,A组(红+绿+蓝)光质、C组(红+绿)光质光照6 h对促进类黄酮含量增长作用更为显著,B组(绿+蓝)光质光照9 h对促进类黄酮含量增长作用更为显著。D组(单一绿光)光质对促进类黄酮含量作用不明显。
3.4 光质与光照周期对切花玫瑰采后花色苷含量的影响
相关研究已证明,花色苷色素具有很强的除去自由基和抗氧化的能力,可以防治许多由自由基引起的疾病。对光照周期为6 h和9 h的A、B、C、D组的三个样品花色苷含量取平均值,计算其相对于自然光对照组花色苷含量的增长比,由于光照12 h组花色苷含量太低而无法测量,只测得6 h和9 h组数据。数据结果如图7所示。
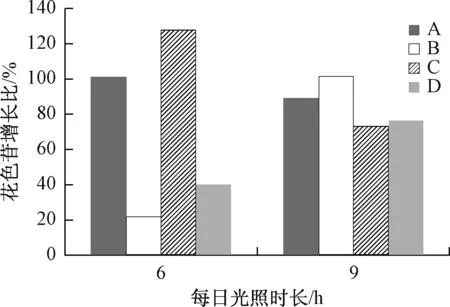
图7 不同实验组鲜切玫瑰花色苷含量Fig.7 The content of anthocyanins in different fresh cut roses experimental groups
(B+G)、G实验组中,6 h处理组花色苷含量较低,随光照时间增加到9 h,样品花色苷含量相对于对照组的增长比均呈现增长趋势,(R+G+B)、(R+G)实验组中,6 h处理组花色苷含量较高,均高于100%,随光照时间增加到9 h,样品花色苷含量增长比减小。
四种光质处理均不同程度地促进了花色苷含量的上升,使其显著的高于对照组水平。红+绿+蓝光质、红+绿光质光照6 h对促进花色苷含量增长作用更为显著。绿+蓝光质、单一绿光光质光照9 h对促进类黄酮含量增长作用更为显著。这与光质对类黄酮含量的影响结果相近。
4 结论
我们将设计的光谱可调LED植物灯用于玫瑰花保鲜实验,通过PWM调光调节RGB LED的光谱组成,得到光质比分别为(R+G+B)、(G+B)、(R+G)、G的实验组,并设置光照周期分别为6 h/24 h、9 h/24 h、12 h/24 h。通过测定不同光处理组玫瑰花采后日失重率以及实验结束后多酚、类黄酮、花色苷三种抗氧化物质的含量,探究最适合玫瑰花保鲜的光条件。实验结果表明,从光照周期的影响来看,过长的光照周期不利于玫瑰花鲜重保持,光质相同的条件下,12 h/24 h组的失重率明显高于其他光照时长组,而抗氧化性物质含量却明显低于其他实验组,不利于玫瑰保鲜。从光质的影响来看,(R+G)在四组实验组中失重率最低,对玫瑰采后鲜重保持效果最好,有利于多酚含量增加的最佳光质和光照时长是R+G+B(9 h/24 h),有利于类黄酮含量增加的最佳光质和光照时长是R+G(6 h/24 h),有利于花色苷含量增加的最佳光质和光照时长是R+G(6 h/24 h)。综合考虑以上因素,我们认为R+G(6 h/24 h)是更有利于玫瑰花采后保鲜的光照条件。

