酸根离子种类对TiO2形貌和性能的影响
鄂 磊,崔 津,王长伟,胡朝阳,胡康慨
(天津城建大学 材料科学与工程学院,天津 300384)
二氧化钛作为光催化材料,其物理化学性质受形貌[1-2]、晶型[3-4]、带隙[5-6]及载流子传输[7-8]等诸多因素的影响,其中形貌和晶型控制一直以来都是研究的热点[9].以草酸钛钾为钛源,在酸性介质中制备二氧化钛是近十年来出现的一种新的制备方法.Li等[10]首次以草酸钛钾为前驱体,盐酸为介质,采用水热法在150℃成功合成了金红石相分级中空3D球状TiO2;Cheng等[11]采用简单水热法,草酸钛钾为钛源,在盐酸介质溶液中合成了海胆状金红石相TiO2中空微球;Yu等[12]以草酸钛钾为原料,在稀硫酸溶液中制备出了核壳TiO2中空微球;赖璐璐等[13]利用低温一步法,将草酸钛钾溶于稀硝酸和双氧水溶液中,制得了金红石相TiO2介晶.从现有文献可知:以草酸钛钾为原料制备TiO2时,不同的酸性介质对其形貌有较大的影响.但对酸性介质种类,即酸根离子种类对TiO2形貌和性能影响的详细研究目前未见报道.因此,笔者分别以盐酸、硝酸、冰乙酸为酸性介质,采用简单易控的低温一步法制备TiO2超细粉体,探讨不同酸根离子种类对TiO2粉体形貌和结构的影响.
1 实验部分
1.1 主要原料及试剂
草酸钛钾(K2TiO(C2O4)2)购于上海麦克林生化科技有限公司,双氧水(H2O2)、盐酸(HCl)、冰乙酸(CH3COOH)、无水乙醇均购于天津市风船化学试剂科技有限公司,硝酸(HNO3)购于北京化工厂,H2O2、HCl、HNO3的质量分数分别为30%、37%、65%~68%.去离子水为实验室自制,甲基橙购于天津基准化学试剂有限公司;所有试剂未经提纯处理,直接用于实验.
1.2 制备过程
实验中HCl、HNO3、CH3COOH三种酸的加入摩尔量相同,以保证由三种酸引入的氢离子的摩尔数相同.以HCl为例,TiO2超细粉体的制备过程如下:取3.5 mL HCl加入到50 mL的H2O2溶液中,将一定量的草酸钛钾加入到上述混合溶液中,使草酸钛钾在溶液中的浓度为100 mmol/L;搅拌溶解后,将该溶液密封在80℃下保温48 h,最终得到白色产物,经水洗、60℃干燥即可得到超细TiO2粉体.
1.3 样品的表征与性能测试
采用日本Rigaku公司生产的X射线粉末衍射仪(XRD,UltimaⅣ)分析物相,日本日立公司制造的场发射扫描电镜(SEM,TDCLS-7800)分析形貌、粒径,使用上海精密科学仪器有限公司的可见-紫外分光光度计(UV,7230G)测定甲基橙溶液的吸光度.
1.4 光催化剂性能检测
以浓度为10 mg/L、pH=3的甲基橙溶液为模拟污染物.取0.1 g所制得的样品分散在25 mL甲基橙溶液中,避光进行暗反应30 min,使样品对甲基橙溶液达到吸附-脱附平衡;然后在紫光灯(30 W,主波长365 nm)下进行光催化降解实验,光照距离10 cm,每隔30 min取上清液进行吸光度At测试,通过公式(1)计算甲基橙溶液的降解率

式中:A0、At分别为反应前和反应t时甲基橙溶液最大吸收峰(λmax=505 nm)处的吸光度值.
2 结果与讨论
2.1 生成产物结构与形貌分析
图1为采用不同种类酸根离子制得的粉体的XRD图.由图1可以发现:采用HCl和CH3COOH制得的 TiO2样品在 2θ为 25.2°、37.78°、48.04°、53.92°、55.1°处均出现明显的衍射峰,与XRD标准卡(PDF#21-1272)对比可知,该5个衍射峰分别对应四方晶系锐钛矿相TiO2的特征峰;而由HNO3制得的样品出现了其它相的衍射峰,与XRD标准卡(PDF#21-1276)对比可知,这些衍射峰为金红石相TiO2的特征峰,即用HNO3制备的样品出现了混晶现象.通过公式(2)计算得出锐钛矿相和金红石相所占质量分数分别为58.74%、41.26%.

式中:IA、IR分别代表锐钛矿相 2θ=25.2°及金红石相2θ=27.4°衍射峰强度.
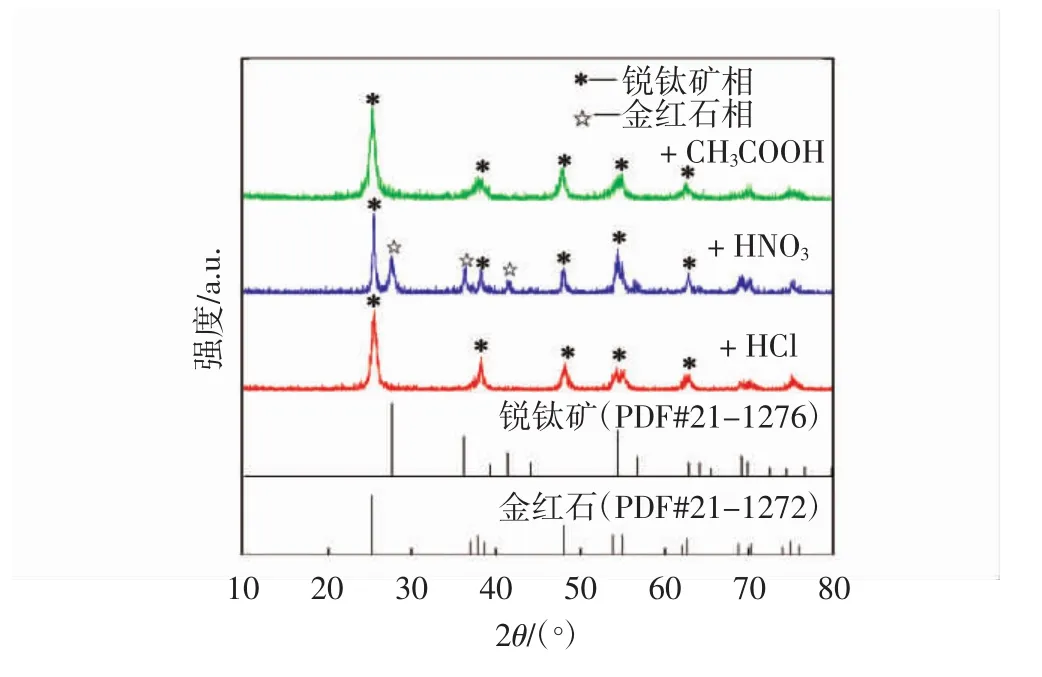
图1 不同种类酸根离子所制得样品的XRD图谱
根据 Scherrer公式[14]计算可以得出由HCl、HNO3、CH3COOH制备样品的一次粒子的粒径分别为5.9,56.0,10.2 nm,这表明采用HCl和CH3COOH为酸性介质更易获得粒径较小的TiO2颗粒.对三组样品进行SEM表征,结果如图2所示.

图2 不同种类酸根离子制备样品的SEM图
从图2a可看出:由HCl制得的TiO2颗粒的形貌为中空类球形,粒径约为2~4 μm,颗粒表面粗糙,其壳由大小约为50 nm的小颗粒组成;图2b为由HNO3制得的TiO2样品的形貌,样品形貌不规则,颗粒大小不均,粒径分布宽,无固定形貌;图2c为选用CH3COOH制得的TiO2样品,颗粒形态为球形,颗粒大小匀称,粒径为500 nm左右,且部分颗粒为中空,可以直观地看到颗粒表面的开孔,孔径约为100 nm.
结合图1-2可知:酸根离子的种类不仅对TiO2样品的形貌有影响,而且对晶型结构也有较大的影响;在相同反应条件下,由HCl和CH3COOH引入氢离子可获得球形、高纯度的锐钛矿相TiO2,而以HNO3为原料制得的产物为无固定形貌的金红石和锐钛矿的混晶.可以认为,氧化性强的酸能够促进金红石相部分主晶面的生长,因此更易在低温条件下获得金红石和锐钛矿的混晶;而采用CH3COOH制备样品时,由于弱酸中H+的缓释作用,降低了H+反应浓度,导致反应物中物质扩散和迁移速度减慢,晶粒成核和生长过程减缓,因而更易获得粒径较小且均匀的产物;另外,弱酸中H+的缓释作用使模板剂H2O2能够缓慢释放氧气[15],为形成中空形貌提供了稳定的软模板.
2.2 中空结构的形成机理
中空结构TiO2形成机理如图3所示.草酸钛钾的分子结构为每个Ti原子由2个[C2O4]2-配位,并桥接2个O原子,形成相互连接的八面体结构.合成过程中,[C2O4]2-在酸性溶液条件下受到多余O2-的攻击,配体交换,随后又经过复杂的分解反应释放氧气,在低温状态下形成共边组成TiO2八面体.无论何种酸性溶液作为介质,形成的TiO2粒子表面均为粗糙状,这是基于[C2O4]2-独特构架的存在所致.H2O2释放出的氧气作为软模板促使粒子自组装形成中空状,H2O2既是模板剂,同时也是配位交换剂.酸性介质H+为整个反应提供酸性环境,调控H2O2释放氧气速率,进而调控粒子成核结晶速率.
整个反应过程中,TiO2空心结构的形成由两个因素控制,即奥斯瓦尔德熟化和气泡模板:奥斯瓦尔德熟化是一个较长的过程,从固体球形的生成到转变为空心结构,球形内部的结晶体溶解,然后到达球形外部后再结晶,生成的微晶在气泡表面不断积累,最终形成空心状;气泡作为模板形成空心结构,当反应溶液中开始形成具有高表面能的小纳米粒子后,这些纳米粒子团簇为较大的纳米粒子,附着于气泡表面生长.当固-液界面表面能各向同性时,由于球体具有最低表面能,这种反应最终会以球形微粒的形式产生.另外,不同尺寸的纳米粒子具有的表面能不同,各向异性导致纳米粒子团聚的程度不同[16],所以,不同种类的酸制备的产物具有不同的粒径及形貌.整个反应方程式如下
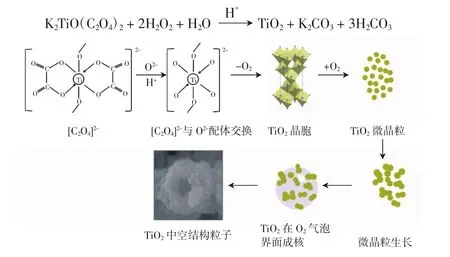
图3 中空结构TiO2形成机理
2.3 TiO2光催化性能分析
将三组TiO2样品进行光催化降解甲基橙溶液实验,结果如图4所示.由图4可知:暗反应0.5 h后,三组样品的甲基橙浓度的降解率均较低,这表明三组TiO2样品对甲基橙分子的吸附性较弱;当打开紫外光源(主波长365 nm,30 W)后,采用CH3COOH制得的TiO2样品在光照0.5 h后,甲基橙浓度降低了99.1%,明显高于HCl和HNO3所制备的TiO2样品的降解率;用HCl制备的TiO2光催化剂在光照3 h后浓度降解率达到88.8%,而采用HNO3制得的样品活性最差,光照3 h后的降解率仅为21.2%.
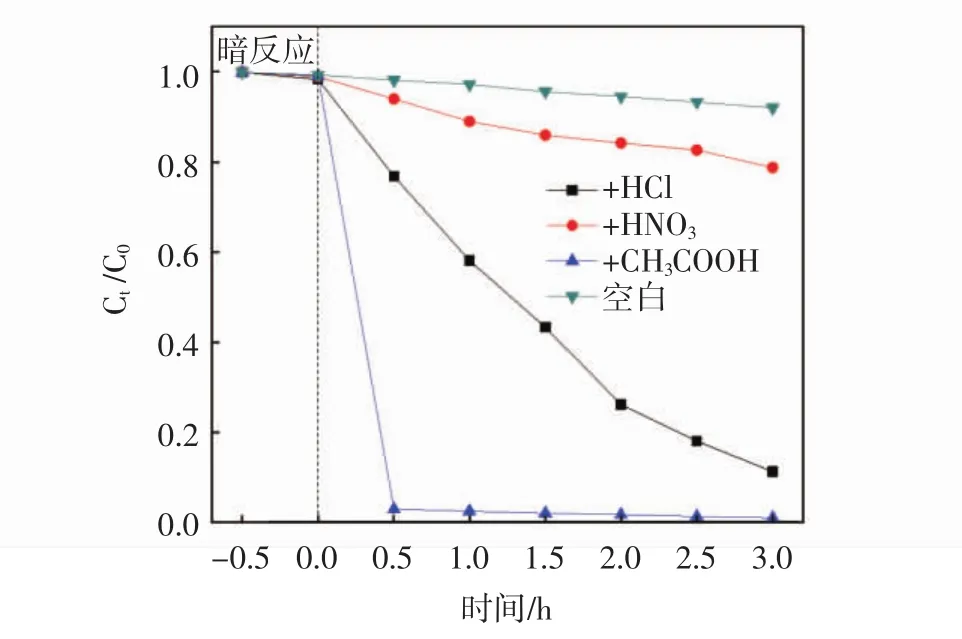
图4 三组TiO2样品的光催化活性降解曲线
对比三组样品的光催化结果可知,用HNO3制备的TiO2产物的光催化活性最差,这可能是其混晶现象导致的.已有文献报道[17],当 TiO2的 w锐钛矿∶w金红石=7∶3时具有比纯锐钛矿或金红石相更高的光催化活性,而本实验中 w锐钛矿∶w金红石≈4∶3,金红石相含量过多导致了样品的活性较差;采用CH3COOH引入H+制得的TiO2样品具有非常高的光催化活性,明显高于其它两组样品.结合XRD(见图1)和SEM(见图2)分析可得,用CH3COOH制备的TiO2产物为粒径较小的中空球形颗粒,相对其它两组样品具有更高的比表面积,有助于电子传递运输、光吸收能力的提升,且晶型为锐钛矿相,因此有更好的光催化活性.
3 结论
研究发现不同酸性介质 HCl、HNO3、CH3COOH 对TiO2光催化剂的形貌、结构及光催化性能有很大影响.
(1)选用HNO3作为酸性介质时能够得到TiO2锐钛矿和金红石相的混晶,采用HCl或CH3COOH作为酸性介质时可制得纯锐钛矿相TiO2.
(2)当采用CH3COOH为酸性介质时,在反应过程中充当H+缓释剂,有助于调控粒子成核结晶速率,可合成粒径均匀、直径约为500 nm的中空球状结构.采用CH3COOH所制得的TiO2样品具有优异的光催化活性,在紫外光照射0.5 h后脱色率达到99.1%.
——以金红石为例

