Pt-Ni双金属催化剂的制备及其乙醇水蒸气重整制氢催化性能研究
孙 晨,郑子良,李 星,王诗瑶,吴 旭,安 霞,谢鲜梅
(1.太原理工大学 化学化工学院,太原 030024;2.山西医科大学 转化医学研究中心,太原 030001)
能源是日常生活中不可或缺的要素,随着社会的快速发展和化石能源的大量使用,一系列问题也随之产生,如全球气候变暖、臭氧空洞以及化石燃料的枯竭等。因此,绿色高效的可再生能源的开发和利用成为全球关注的焦点,而氢能因其清洁、高效的特点引起了研究人员的广泛关注[1-3]。近年来,以生物质乙醇蒸气为原料重整制氢气已成为可再生氢生产最有效的方式之一[4],乙醇蒸气重整反应式可表示如下:
CH3CH2OH+3H2O→6H2+2CO2.
(1)
乙醇水蒸气重整(ESR)反应的特征在于较高的氢产率,但其反应体系由于乙醇中的C—C键以及反应的吸热性质而变得较为复杂,ESR过程中可能同时发生的几种副反应如下[5-7]。
乙醇分解生成CO和CH4
CH3CH2OH→CH4+CO+H2.
(2)
乙醇重整成合成气
CH3CH2OH+H2O→4H2+2CO .
(3)
乙醇脱氢形成乙醛
CH3CH2OH→CH3CHO+H2.
(4)
乙醇脱水形成乙烯
CH3CH2OH→C2H4+H2O .
(5)
Boudouard反应
2CO→CO2+C .
(6)
水煤气变换反应
CO+H2O→CO2+H2.
(7)
逆水煤气变换反应
CO2+H2→CO+H2O .
(8)
副反应的进行取决于所使用的活性金属、载体和反应条件,催化剂和反应条件不同,产物分布及反应途径也随之不同[8]。因此,高活性、低成本的催化剂的研发是当前ESR反应亟待解决的关键问题。
基于组成,将催化剂分为贵金属催化剂、非贵金属催化剂以及其他类型的催化剂。贵金属如Pt,Pd,Rh,Ru,Ir在ESR反应中得到广泛的研究[9-11],因为它们具有较强的C—C键裂解活性,是ESR反应的最佳催化剂候选物。如低温条件下的金属Pt具有最好的总体活性,可以促进乙醇分解和脱氢反应,是非常有前景的催化剂。非贵金属如Cu,Co,Ni因较好的催化性能和低廉的成本也广泛应用于蒸气重整反应中[12-14]。其中,Ni基催化剂对于C—C键具有较强的断键能力,在乙醇水蒸气重整反应过程中表现出优良的反应活性及对氢气的选择性;同时Ni对水煤气变换反应和甲烷重整也具有一定活性,可以降低产物中CO和CH4的含量。然而,贵金属与载体的接触面易产生积碳,成本也较高。这些问题促使研究人员对负载型双金属催化剂的结构和性能展开了研究[15-16]。KUGAI et al[17]研究发现,双金属催化剂的两种金属组分之间的协同相互作用对ESR期间的碳失活会产生有益的影响。此外,ESR反应中,在金属Pt重整过程中添加第二金属活性组分Ni形成的合金除了有利于减缓催化剂的积碳,还可通过金属间协同作用提高Pt去除CO的能力;另一方面,Pt在WGS反应中的活性可用于提高金属Ni的催化性能[18]。
在乙醇水蒸气重整反应过程中,除了金属对反应的影响外,载体的性质也对产物的选择性和催化剂的活性起着重要的作用,如载体的氧迁移率是有利于C去除并避免失活的关键性质。因此,在反应期间具有很高的储存和释放氧气性能以及灵活的氧空位的CeO2被广泛使用在ESR中。CeO2作为催化载体可以容易地实现所得焦炭的气化从而防止催化剂在蒸汽条件下失活;还可以促进WGS反应,有利于CO转化和较高的H2产率。此外,贵金属Pt与CeO2之间会产生一个强的金属-载体相互作用,除了能够稳定贵金属,还有助于提升CeO2的氧化还原性能和氧存储能力[19]。
本文选用不同含量的金属Ni与质量分数2%的Pt负载在不同粒径的CeO2上作为潜在的催化材料。考察不同催化剂在相同反应条件下的催化性能,来确定一种最佳的Pt,Ni双金属催化剂用于氢气生产开发。使用X射线衍射(XRD)、扫描电子显微镜(SEM)、N2吸附脱附分析和H2-程序升温还原(H2-TPR)等表征手段,分析了催化剂的理化性质、还原性能及催化过程。
1 实验部分
1.1 催化剂的制备
粒径可控的纳米级球状CeO2具体制备过程如下:将1.75 g Ce(NO3)3·6H2O加入到5 mL去离子水和35 mL二甘醇的混合溶液中充分搅拌至溶液澄清,称取0.017 2 g的聚乙烯吡咯烷酮(PVP)置于溶液中,高速搅拌1 h,在水热反应釜中180 ℃晶化12 h;随后,冷却至室温,洗涤、离心、干燥,并在550 ℃空气气氛中焙烧2 h,所得产物即直径为50 nm左右的纳米级球状CeO2,命名为CeO2(NP).调节水热反应温度为140 ℃,晶化20 h,可得直径为0.55 μm左右的球状CeO2,命名为CeO2(MP).
通过等体积浸渍的方式(incipient-wetness impregnation,IWI),根据不同负载量称取Ni(NO3)2·6H2O,H2PtCl6·6H2O为原料配制溶液作为金属前驱液。以球状CeO2(NP)作为载体进行活性组分负载,在50 ℃下高速搅拌至水分完全挥发,在80 ℃的恒温干燥箱中干燥12 h;置于马弗炉中,以2 ℃/min升温速率由室温升至550 ℃并保持2 h.最终固体产物命名为2Pt-xNi/CeO2(NP)双金属催化剂,其中x代表所负载Ni的质量分数(x=4%,6%,8%).对比样品为采用同样的水热法以及IWI法以CeO2(MP)负载质量分数2%Pt和质量分数6%Ni的2Pt-6Ni/CeO2(MP)催化剂。
1.2 催化剂的表征
催化剂的X射线衍射(XRD)表征采用日本Rigaku公司D/max-2500型X射线粉末衍射仪测定分析。Cu/Kα作为辐射源,管电压40 kV,管电流100 mA,速率为8 (°)/min对样品进行广角度范围(5°~80°) 扫描测试。利用德拜-谢乐公式(Scherrer公式)对催化剂载体及其活性组分的晶粒尺寸进行计算分析。
采用美国Micromeritics公司的ASAP-2020型全自动物理吸附仪对催化剂进行比表面积(BET)和孔隙度等性质的分析。首先需在200 ℃条件下对100 mg样品进行真空脱气预处理6 h,然后在-196 ℃环境下进行氮气的吸附/脱附检测。实验结果通过BET,BJH以及t-plot模型方法进行理论计算。
催化剂的扫描电子显微镜(SEM)图像通过日本东京Hitachi公司生产的SU-1500型扫描电子显微镜获得。在100 kV的FEI Tecnai G2 F20透射电子显微镜上获得透射电子显微镜(TEM)图像。
催化剂的程序升温还原(H2-TPR)性能通过浙江泛泰公司的FINESORB-3010型全自动化学吸附仪进行分析。取80 mg样品置于石英管中,在流速为30 mL/min且V(H2)∶V(Ar)=1∶9的混合气,以5 ℃/min的升温速率从室温升至900 ℃,通过TCD检测器检测反应信号。
1.3 催化剂的评价
催化剂的性能评价是在常压固定床微反应装置上完成的。首先,称取0.32 g粒度大约为40~60目的催化剂与适量的石英砂进行稀释混合后置于反应器中,N2吹扫30 min,然后在温度为550 ℃的条件下通入V(H2)∶V(N2)=3∶7的混合气并以70 mL/min气体流速对样品进行还原反应,作用时间2 h.还原结束后关闭H2阀门,将温度调整至反应所需温度进行催化测试。反应物为n(乙醇)∶n(水)=1∶6,通过LP2-010-20恒流泵以0.075 mL/min的流量进入120 ℃汽化室汽化,随后与载气N2混合后进入反应体系作用。反应后的气体产物由六通阀进入GC950型气相色谱仪,通过TDX-01和GDX-401两根串连连接的色谱柱进行在线分析,其中H2和N2通过TDX-01色谱柱分离由热导检测器(TCD)检测。TCD检测器灵敏度低,为了防止产物中因CO,CO2含量较低致使分析产生误差这一问题,在色谱中安装了镍转化炉将CO,CO2转化成相应量的CH4,再由FID检测。因此CO,CH4,CO2,C2H4等气体由GDX-401色谱柱和氢焰离子化检测器(FID)进行分离检测。反应后的液体产物经过冷阱收集,然后使用GC-9890B型气相色谱进行分析,手动进样,以H2做为载气通过Porapak Q毛细管柱和TCD检测器对液体产物中的H2O,C2H5OH,CH3CHO等进行分离检测。采用公式(9)和(10)对所测结果进行计算,式中:XEtOH为乙醇的转化率,%;Si为反应后产物的选择性,%;ni为不同产物检测所得摩尔数。
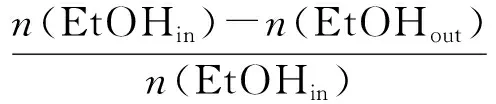
(9)
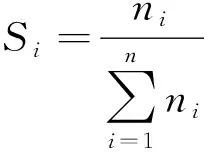
(10)
2 结果与讨论
2.1 催化剂表征分析
图1为Pt-Ni/CeO2双金属催化剂焙烧后的XRD测试图谱。由图可知,四种催化剂均出现明显的衍射峰,主要对应于标准卡片JCPDS 34-0394的(111),(200),(220),(311),(222),(400),(331)晶面,表明所有样品都存在面心立方萤石结构的CeO2晶体。除了CeO2特征衍射峰外,在2θ=37.27°,43.37°,63.23°处检测到微弱的衍射峰,分别对应NiO(111),(200)和(220)晶面。由于Pt的低负载量以及高度分散在载体表面,所以没有检测到PtOx对应的衍射峰[20-21]。从图中可观察到,CeO2衍射峰强度和半峰宽略有变化,这归因于负载量的增加,影响了CeO2的结晶度,使得CeO2的晶粒尺寸减少(见表1)。根据谢乐公式对载体CeO2(111)晶面以及不同负载量NiO(200)晶面进行拟合估算,得出相关的晶粒尺寸并列于表1中。从表1可以看出,当NiO负载量为质量分数6%时,不同载体CeO2(NP),CeO2(MP)上对应的NiO晶粒的大小分别为14.1 nm,19.3 nm.结合N2吸附表征分析可知,载体的比表面积大小对于NiO的粒径有较大的影响,CeO2(NP)作为载体更有利于小颗粒NiO的生成从而提高其分散度。
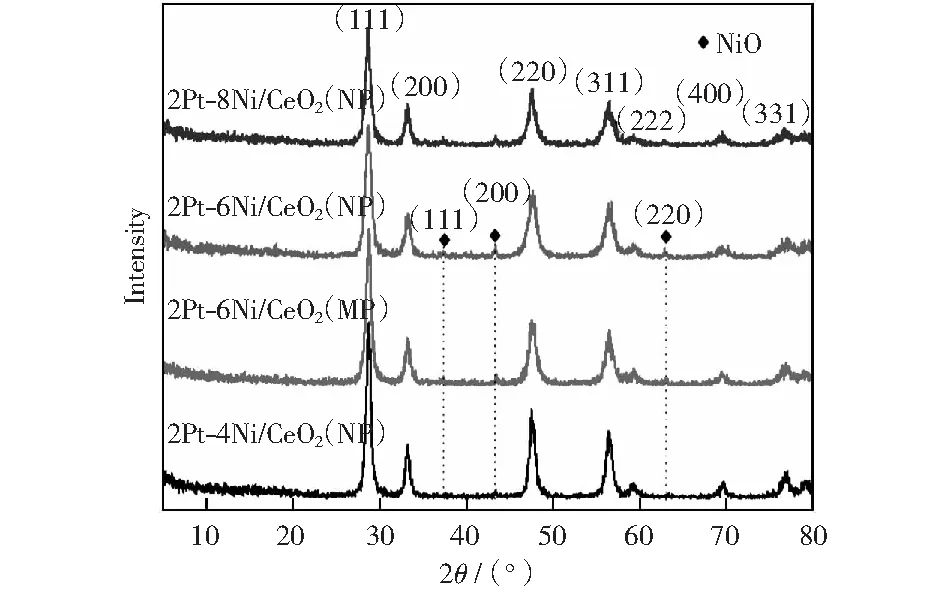
图1 焙烧后2Pt-xNi/CeO2催化剂XRD谱图Fig.1 XRD patterns of calcined 2Pt-xNi/CeO2 catalysts
图2为载体CeO2(NP)的N2吸脱附曲线图。由图可知,该材料的N2吸附-脱附曲线图满足IUPAC定义的典型Ⅲ型曲线,由毛细凝聚现象引起的滞后环类型为H4型,图中滞后环的结点在P/P0为0.45左右;说明样品中有较多的中孔,所制备的样品具有中孔孔道。Pt-Ni/CeO2双金属催化剂通过N2吸附-脱附曲线所得比表面积及孔结构的参数见表1.由表1分析可知,载体CeO2(MP)的比表面积仅为39.69 m2/g;而载体CeO2(NP)的比表面积相对较高为87.20 m2/g,是前者的两倍。通过等体积浸渍法负载金属之后,催化剂的比表面积、孔容均有不同程度的下降,这是由于金属氧化物附着在载体表面或沉积在孔道中。其中,载体CeO2(MP)颗粒较大,金属氧化物在其表面因不能呈现高分散状态而产生聚集,使得以CeO2(MP)为载体的催化剂的比表面积下降较为明显。
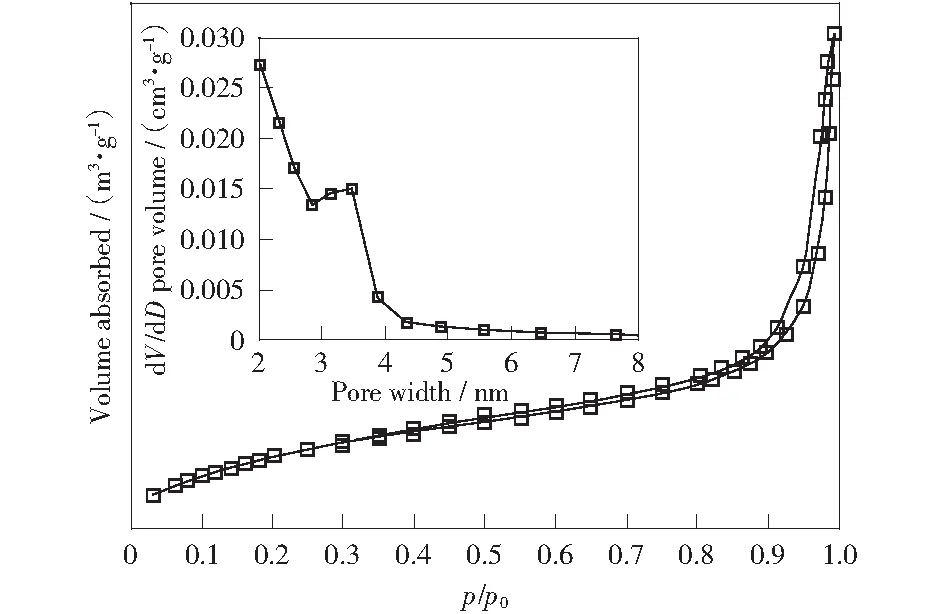
图2 载体CeO2(NP)的N2吸脱附曲线图Fig.2 N2 adsorption and desorption isotherms for CeO2(NP)
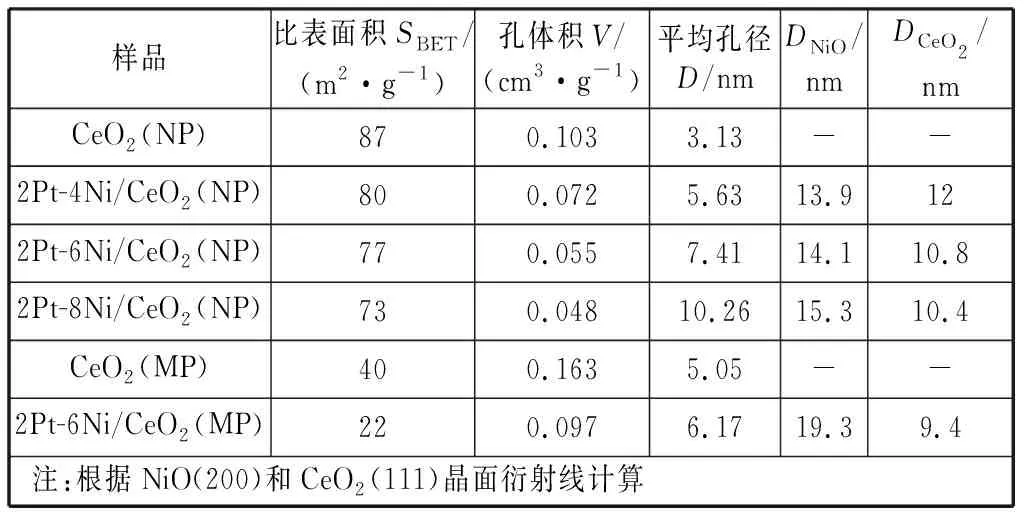
样品比表面积SBET/(m2·g-1)孔体积V/(cm3·g-1)平均孔径D/nmDNiO/nmDCeO2/nmCeO2(NP)870.1033.13--2Pt-4Ni/CeO2(NP)800.0725.6313.9122Pt-6Ni/CeO2(NP)770.0557.4114.110.82Pt-8Ni/CeO2(NP)730.04810.2615.310.4CeO2(MP)400.1635.05--2Pt-6Ni/CeO2(MP)220.0976.1719.39.4注:根据NiO(200)和CeO2(111)晶面衍射线计算
图3为水热晶化法合成的不同粒径CeO2的扫描电镜(SEM)图。图3(a)和(b)分别为不同倍数条件下样品CeO2(NP)的SEM分析图;从图中可以看出,载体CeO2(NP)呈球形结构,粒径为50~80 nm,且分散均匀无团聚现象出现。图3(c)和(d)为CeO2(MP)不同倍数条件下的SEM分析图;从中可知载体CeO2(MP)的粒径为550~800 nm左右,呈类球形,分散均匀。
为了研究在还原过程中载体上氧化物相的行为信息,2Pt-xNi/CeO2催化剂的H2-TPR曲线如图4所示。由图可知,2Pt-xNi/CeO2催化剂在还原温度为100~500 ℃的区间内存在3个相对宽化的还原峰,而催化剂的还原主要发生在两个温度区域。在75~100 ℃范围内开始出现一个较强的还原峰,这归因于PtOx物质的还原;NiO还原为Ni金属单质的还原峰的起始温度范围为200~240 ℃.而在较高温度(450 ℃)出现的低强度的宽化峰是由CeO2上表面覆盖氧的还原导致的。根据文献[22]可知,贵金属的存在强烈地改变了CeO2的特征,因为金属的氢活化和随之而来的迁移到载体(溢出),促进CeO2表面在较低温度下的还原。此外,通过2Pt-4Ni/CeO2(NP)和2Pt-6Ni/CeO2(NP)的H2-TPR曲线对比可知:NiO负载量的增加使得PtOx的还原温度降低。这可能是由于NiO的添加提高了PtOx在载体表面的分散度,从而更容易被还原。而2Pt-6Ni/CeO2(NP)和2Pt-6Ni/CeO2(MP)的H2-TPR曲线不同是由于CeO2(NP)的纳米效应造成的。

图3 CeO2(NP)(a)(b)与CeO2(MP)(c)(d)SEM图Fig.3 SEM images of CeO2(NP) and CeO2(MP) under different magnification conditions

图4 2Pt-xNi/CeO2催化剂的H2-TPR谱图Fig.4 H2-TPR profiles of 2Pt-xNi/CeO2 catalysts
2.2 催化剂的反应性能
图5,图6分别为ESR在Pt-Ni/CeO2双金属催化剂上乙醇转化率及产物分布随温度变化的趋势图。由图5可知,在实验温度范围内所有催化剂对应的乙醇转化率和H2选择性均随着温度的升高而增大,反应温度为450 ℃时,乙醇转化率均达到90%~95%,H2选择性为65%以上,展现出很好的催化性能。在整个反应温度区间内(300~550 ℃),金属Ni的负载量对于ESR存在着较大的影响,2Pt-8Ni/CeO2(NP)催化剂上乙醇的转化率明显高于2Pt-4Ni/CeO2(NP)催化剂,这是由于较高的Ni负载量可以为乙醇转化提供足够多的活性位。乙醇的转化率在2Pt-6Ni/CeO2(NP)上整体高于催化剂2Pt-6Ni/CeO2(MP)这一结果主要得益于CeO2(NP)的尺寸效应,相对较高的比表面积有利于活性组分的均匀分散,对降低活性中心的尺寸、防止活性组分烧结有积极作用,从而能够提供更多的活性中心,有利于提高其催化活性。此外,2Pt-6Ni/CeO2(NP),2Pt-8Ni/CeO2(NP)催化剂在500 ℃以上时,副产物乙醛的消失归功于CeO2(NP)载体优势以及金属Ni的高负载量。
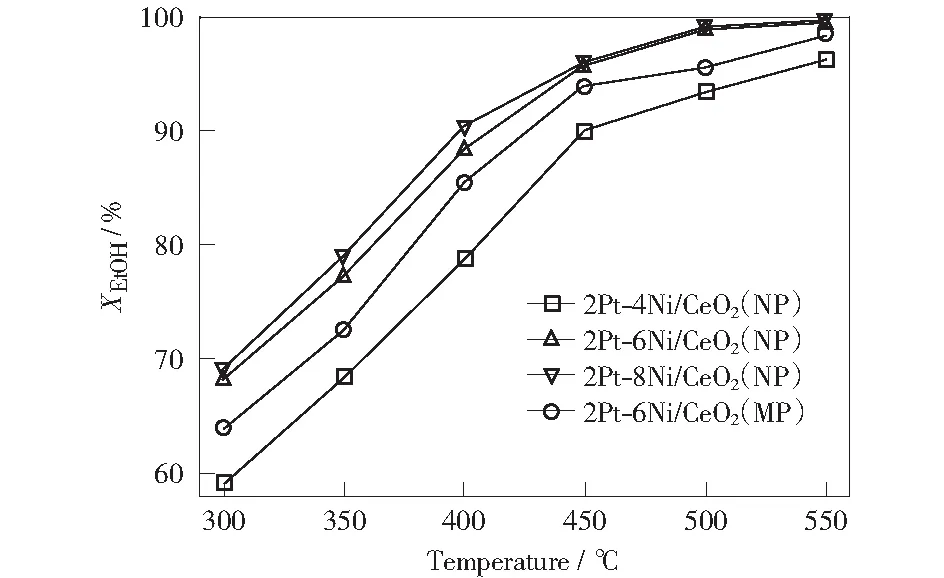
图5 2Pt-xNi/CeO2催化剂的乙醇转化率随温度变化趋势图Fig.5 Temperature effect on the ethanol conversion for ESR over 2Pt-xNi/CeO2 catalysts
由图6可知,较高的温度有利于产物中氢气含量的增加,但CO选择性也会随着温度的升高而增大。而ESR反应中,CO的转化主要是通过WGS实现的。由热力学分析可知,WGS反应是一个放热反应,过高的温度有利于逆水煤气变换反应的进行,从而导致CO含量增加。通过以上分析,450 ℃为研究Pt-Ni/CeO2双金属催化剂体系在ESR反应中稳定性能的适宜温度。图7为2Pt-6Ni/CeO2(NP)和2Pt-6Ni/CeO2(MP)催化剂在该温度条件下进行10 h的稳定性测评。如图7(a)所示,反应初期,2Pt-6Ni/CeO2(NP)催化剂上乙醇转化率无明显变化,接近100%.相对于低选择性的CO(1.5%)以及微量的乙醛分子,H2,CO2具有较高的选择性,分别为69.5%和18.8%.反应时间10 h之后,乙醇转化率以及产物选择性未发生明显变化。对于2Pt-6Ni/CeO2(MP)催化剂,从图7(b)中可以看到,其催化性能明显低于2Pt-6Ni/CeO2(NP),乙醇转化率初始值约为98%;随着反应的进行,4 h后开始出现明显的下降趋势,10 h时乙醇转化率降低为81%.部分产物的选择性随着反应的进行也存在明显的变化趋势,在反应结束时,CO的选择性为6.05%,还有选择性为5.1%的乙醛存在。
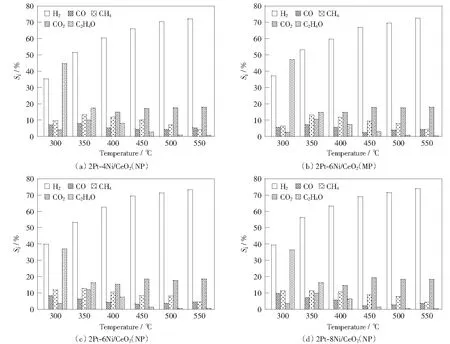
图6 催化剂的产物选择性随温度变化趋势图Fig.6 Temperature effect on the products selectivity for ESR over catalysts

图7 450 ℃反应条件下催化剂稳定性测试Fig.7 Variation of the ethanol conversion and selectivity as a function of the reaction time over catalysts for ESR at 450 ℃
以上结果表明,样品2Pt-6Ni/CeO2(NP)具有较高的催化活性和稳定性;这归因于纳米颗粒的尺寸效应,相对较高的比表面积大大提高了Pt,Ni活性组分的分散度,一定程度上有效地防止了金属烧结。CeO2与活性组分间的交互作用以及Pt,Ni金属间的协同作用增强了Pt的活性,使其更有利于CO的转化。同时,Pt在WGS反应中的活性可用于提高Ni金属的催化性能,加强甲烷重整,能促进CH4的转化,增加催化剂的稳定性。另一方面,CeO2(NP)存在大量的晶格氧,对于CO的转化和积碳的清除也起到了积极作用。
3 结论
本文主要考察了Pt-Ni/CeO2双金属催化剂的理化性质以及在ESR反应中的催化性能。结果表明,2Pt-6Ni/CeO2(NP)催化剂在450 ℃下反应10 h后,仍保持较高的氢气、二氧化碳选择性、较低的一氧化碳选择性以及微量的乙醛,具有较高的催化活性和稳定性。这是由于CeO2(NP)作为载体有助于提高Pt,Ni的分散度和催化剂的抗积碳能力,从而抑制金属的团聚、烧结,提高催化剂的活性和稳定性,延长催化剂的使用寿命。同时,CeO2(NP),Pt和Ni之间的交互作用以及协同效应一定程度上提升了催化剂的催化性能。

