基于稳定同位素分析的野生黄条鰤食物组成研究
李多慧,韩羽嘉,李重实
(1.大连市水产研究所,辽宁 大连 116085;2.大连海洋大学,辽宁 大连 116023;3.辽宁省农业发展服务中心,辽宁 大连 116015)
稳定同位素技术是研究鱼类摄食特征和鱼类迁徙等问题的重要手段[1-3]。与传统胃含物分析法相比,稳定同位素技术反映了消费者较长一段时间内消化、吸收的食物来源,已被广泛应用于生态系统营养结构研究[4]。Furuya等[5]利用稳定同位素技术研究南美鸭嘴鲶(Pseudoplatystomacorruscans)的食物构成时,发现枝角类是其主要食物来源,贡献率高达89.24%;研究发现[6],生存于沿海和河流中的海湾鲟(Acipenseroxyrinchusdesotoi),其食物组成有明显差异。因此,稳定同位素技术能有效反映食物的贡献比率,以及不同生长环境中鱼类食物组成的差异。
黄条鰤(Seriolaaureovittata)是黄渤海海域自然分布的大型鰤属鱼类,其生长速度快,营养价值高,素有“海中牛肉”美称[7]。目前,我国养殖的黄条鰤主要以出口日本为主,且需求量持续攀升。但由于对其摄食习性、繁育等基础研究较晚,我国黄条鰤养殖产量受到较大束缚。食物质量的优劣关系到养殖产量和肉质品质,了解和掌握野生黄条鰤的食物组成对养殖生产中的饵料投喂策略具有一定的指导意义。
本研究通过检测以冰鲜玉筋鱼(Ammodytesperonatus)饲养的工厂化养殖黄条鰤的δ13C,获得各组织的Δ13C,结合大连海域野生黄条鰤及潜在食物的δ13C,推测大连海域野生黄条鰤的食物组成,以期为黄条鰤的摄食习性和实际生产中的投喂策略等提供参考。
1 材料与方法
1.1 样品的采集与处理
工厂化养殖黄条鰤(体长58.38± 2.01 cm,体质量2.49± 0.46 kg):试验期间投喂同一批冰鲜玉筋鱼,并在第0 d、第20 d和第40 d取饵料鱼背部肌肉,第40 d取黄条鰤心脏、鳃、肝脏、肠和肌肉。
野生黄条鰤及其潜在食谱生物:2017年秋季采用底拖网调查(38°28′8.86" N ~ 38°58′33.81" N,120°31′26.58" E ~ 122°17′50.02" E),共取得46种黄条鰤可能饵料生物,调查网具网口目数为900目,囊网网目10 mm,平均拖速2 kn,调查海域水深在5 m~30 m,潜在食谱生物样品数为5。游泳虾形类取腹部肌肉,蟹类取第一鳌足肌肉,头足类取腕部肌肉,鱼类取背部肌肉。
所有组织样品用纯水清洗,放置于烘箱内60 ℃烘干至恒重,经玛瑙研钵充分研磨,用脱脂溶液(甲醇∶氯仿∶水= 2∶1∶0.8)浸泡除脂24 h。脱脂样品经纯水清洗、烘干研磨后,用于测定δ13C值。
1.2 碳稳定同位素测定
所有样品在辽宁省海洋水产科学研究院稳定同位素实验室,用稳定同位素质谱仪—菲尼根Flash 2000 HT型元素分析仪和菲尼根Delta V Advantage同位素比率质谱仪进行测定。稳定C同位素的自然丰度表示为:
δ13C=([R样品/R标准]-1)×103
式中,R代表13C/12C。δ13C是相对于PDB(Pee Dee Belemnite)标准的自然丰度[8]。每个样品测定3个平行样,每测定5个样品后插测1个标准样。δ13C值精密度<±0.15‰。
1.3 数据处理
碳同位素判别值为消费者组织中的δ13C对食物δ13C的富集程度,公式如下:
Δ13C=δ13C消费者-δ13C食物
δ13C在海洋动物营养级间的富集度低(0~1‰),多用于反映捕食者对摄食生物的吸收同化情况[9]。根据所采集饵料生物的类别及生活习性,将其划分成头足类、游泳虾形类、蟹类、中上层鱼类、中下层鱼类和底层鱼类6个组,采用IsoSource线性混合模型[10]计算6组摄食生物的δ13C值对野生黄条鰤的贡献比例。
试验结果均采用平均数±标准差表示,采用SPSS 22.0进行数据分析。
2 结果
2.1 饵料鱼的碳稳定同位素比值(δ13C)
饵料鱼的δ13C变化范围为 -20.87‰~-20.79‰,跨度为0.09‰,经t检验发现,饵料鱼的δ13C值无显著性差异(P>0.05)(表1)。

表1 饵料鱼的δ13C值
2.2 工厂化养殖黄条鰤各组织的碳稳定同位素比值(δ13C)和判别值(Δ13C)
工厂化养殖黄条鰤各组织的δ13C值和Δ13C见表2,δ13C值:δ13C肌肉(-19.82±0.03‰)>δ13C鳃(-19.84±0.07‰)>δ13C肝脏(-20.45±0.01‰)。Δ13C值:δ13C肌肉(1.00‰)>δ13C鳃(0.98‰),δ13C肝脏(0.37‰)。
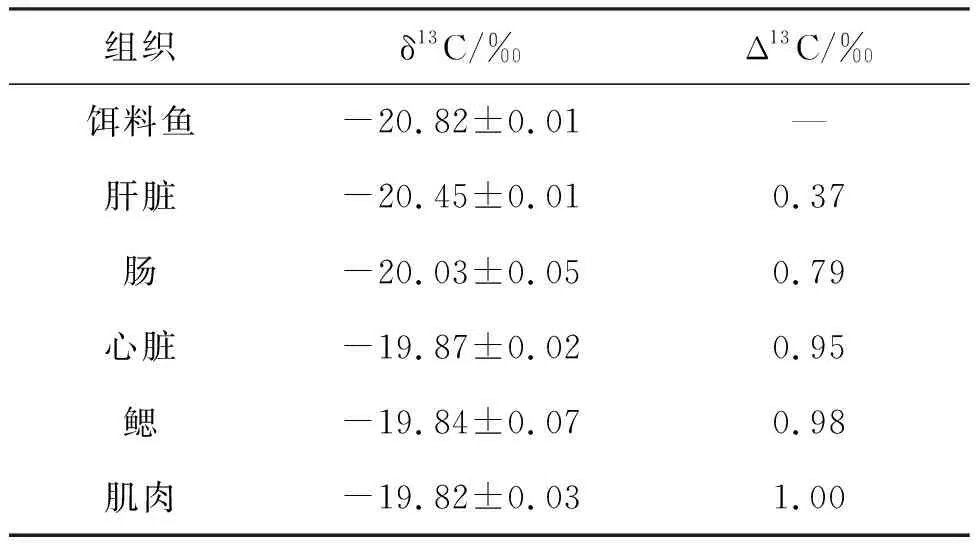
表2 工厂化养殖黄条鰤各组织的碳稳定同位素比值和判别值
2.3 野生黄条鰤及其可能饵料生物的碳稳定同位素比值(δ13C)
野生黄条鰤及其它渔业资源的δ13C值见表3。野生黄条鰤肌肉组织的δ13C值为-19.17±0.05‰。46种可能饵料生物的δ13C值的范围为-21.61‰ ~ -16.84‰。其中,头足类δ13C值为-17.92‰ ~ -17.81‰;游泳虾形类δ13C为-18.81‰ ~ -18.11‰;蟹类δ13C为-18.81‰~-17.92‰;中上层鱼类δ13C为-21.61‰~-17.41‰;中下层鱼类δ13C为-19.96‰~-17.61‰;底层鱼类δ13C为-20.61‰~-16.85‰。
2.4 野生黄条鰤的食物组成
头足类、游泳虾形类、蟹类、中上层鱼类、中下层鱼类和底层鱼类6个类别的平均碳同位素比值见表4。头足类δ13C值最高(-17.88‰),中上层鱼类最低(-19.52‰)。
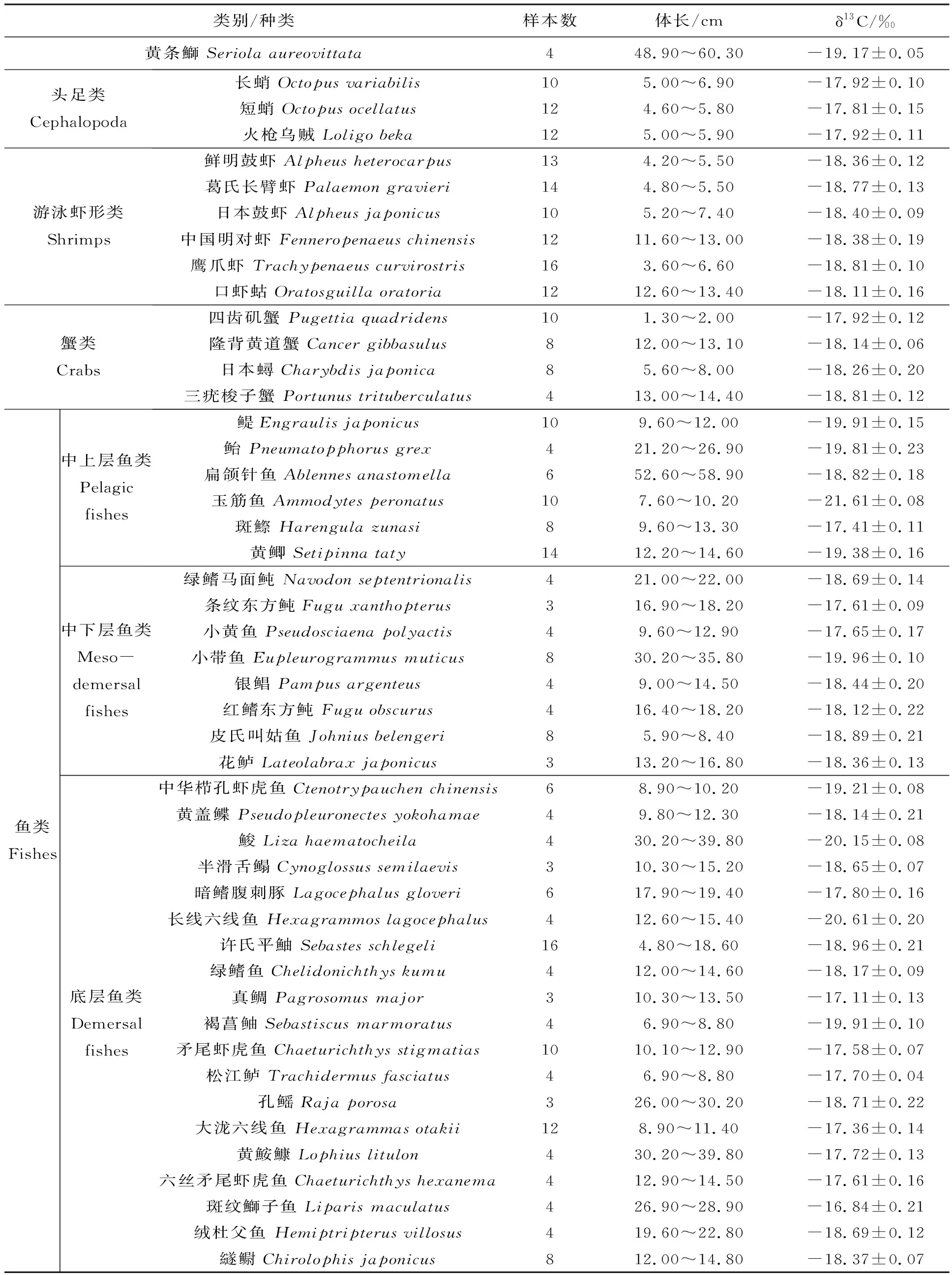
表3 黄条鰤及其潜在饵料生物的碳稳定同位素比值

表4 各类别生物δ13C的平均值
通过工厂化养殖黄条鰤肌肉组织δ13C的判别值(1.00‰),推测野生黄条鰤食物的δ13C值为-20.17‰,结合大连海域野生黄条鰤可能摄食的各类别生物饵料种类的平均碳同位素比值,采用IsoSource软件计算得出不同类别生物饵料对大连海域野生黄条鰤的贡献比例见表5。由表5可知,大连海域野生黄条鰤的主要食物来源由高到低分别依次为中上层鱼类,中下层鱼类、底层鱼类、游泳虾形类、蟹类、头足类,平均贡献率依次分别为66.2%、9.8%、9.0%、6.2%、5.1%、3.7%。
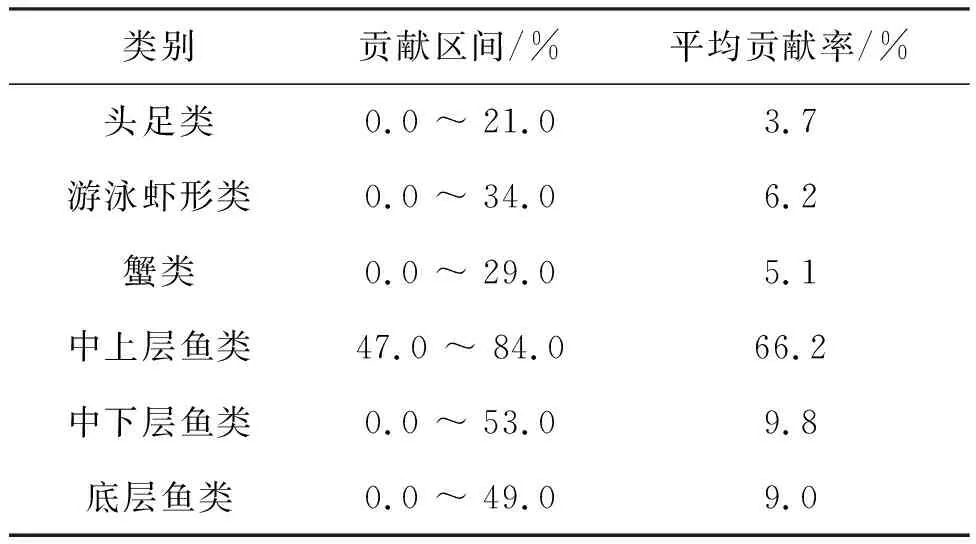
表5 不同类别生物饵料对黄条鰤的食物贡献比例
3 讨论
3.1 工厂化养殖黄条鰤不同组织碳稳定同位素的判别值
稳定同位素判别值是应用稳定同位素技术分析生态系统营养关系、食物贡献率的重要参数[11]。在海洋食物网中13C的判别值为0~1‰,限制了其作为营养级指示剂的作用,但13C的变化可以反应捕食者的食物来源、觅食地点等信息[9]。同时,动物各组织碳稳定同位素分馏效应也存在很大差异:Roth等[12],发现红狐体内血清对食物的△15N 达4.2‰,而肝、肌肉和毛皮为3.3‰~3.5‰。本研究中工厂化养殖黄条鰤各组织Δ13C值依次为肝脏(0.37‰)<肠(0.79‰)<心脏(0.95‰)<鳃(0.98‰)<肌肉(1.00‰),与蔡德陵等[13]对鲈鱼(Lateolabraxjaponicus)的稳定同位素分馏研究的结果相似。各组织之间的分馏差异可能与黄条鰤各组织在新陈代谢过程中物质与能量的流动途径不同有关。
3.2 野生黄条鰤的食物组成分析
传统胃含物分析法对样品的需求量大、食物种类难以辨别、分析时间长,仅能反映较短时间内的食物组成,且包含了难以消化的成分[14]。而稳定同位素技术则可以反映捕食者较长一段时间内消化吸收的食物组成情况,是研究鱼类摄食特征和鱼类迁徙等问题的重要手段[1-3]。由于不同组织的新陈代谢速率不同,其13C的判别值不同,可以反映动物不同时期的食物来源信息。如:肾脏和肝脏等新陈代谢活跃的组织可以反应捕食者短期内的捕食信息;与肾脏和肝脏相比,肌肉组织的新陈代谢速率比较稳定;而毛发、触须和趾甲等组织反映的是捕食者长期的捕食信息[15](Tieszenetal.,1983)。研究发现[16],黄条鰤肌肉组织碳稳定同位素周转时间最长,更适合推断野生黄条鰤较长时间内的摄食特征。本研究利用工厂化养殖黄条鰤肌肉组织的Δ13C 值(1.3‰)推测野生黄条鰤的食物来源,发现大连海域野生黄条鰤的主要食物来源为中上层鱼类(66.2%),其次为中下层鱼类(9.8%)、底层鱼类(9.0%)、游泳虾形类(6.2%),蟹类(5.1%)和头足类(3.7%)。这与姜大为等[17]用胃含物分析法发现黄条鰤主要摄食鳀鱼、玉筋鱼等鱼类的结果相似。同时,Vizzini等人[18]提出饵料贡献比率略低的饵料生物也不可忽视,因此在实际投喂中应全面考虑黄条鰤的营养需求。
受外界条件如洋流、季风、潮汐及海洋营养和生产力水平等[19]和内部条件如海洋浮游生物的洄游习性所引起的生活栖息地的转换、群落结构变化引起的饵料变化、生物个体发育引起的食性转化等影响,不同季节不同海域食物网生物稳定同位素组成存在显著差异[20]。本研究中大连海域野生黄条鰤可能饵料生物种类共46种,其中头足类的δ13C值为-17.88±0.06‰,跨度为0.11‰;游泳虾形类的δ13C值为-18.47±0.29‰,跨度为0.70‰;蟹类的δ13C值为-18.28±0.14‰,跨度为0.89‰;鱼类的δ13C值为-19.05±1.04‰,跨度为4.76‰。这与2015年秋季北黄海海域[21]和2012年春季黄海北部和渤海辽东湾海域[22]的主要渔业资源的碳稳定同位素比值存在差异。分析原因,渔业资源生物δ13C值的差异与采集海域、时间和生物种类等条件的不同密切相关。
ThefeedinghabitsofwildyellowtailSeriolaaureovittatabasedonstableisotopesanalysis
LI Duo-hui1, HAN Yu-jia2, LI Zhong-shi3
(1.Dalian Fisheries Research Institute, Dalian 116085, China; 2.Dalian Ocean University, Dalian 116023, China; 3.Liaoning Agricultural Development Service Center, Dalian 116015, China)
Abstract:δ13C in liver, intestine, heart, gill and muscle from cultured yellowtailSeriolaaureovittataand δ13C in prey organisms were measured,to produce the fractionation in each tissue. Meanwhile, the food sources for the wild yellowtails at Dalian Bay were estimated, in terms of fractionation and measuring the δ13C in muscle of wild yellowtails and its potential foods.The results showed that the highest Δ13C value in cultured yellowtails was in muscle (1.0‰), followed by gill (0.98‰), heart (0.95‰), intestine (0.79‰) and liver (0.37‰).δ13C in samples of 46 kinds of potential prey organisms ranged from -21.61‰~-16.84‰.Due to fractionation from cultured yellowtails in muscle(1.0‰), the contribution rate of prey organisms, from the biggest to the smallest, was as follows: pelagic fishes>mesodemersal fishes>demersal fishes>crabs>shrimps>cephalopoda, with the average contribution rate of 64.0%, 9.8%, 9.0%, 6.2%, 5.1% and 3.7%, respectively.

