哈茨木霉对紫羊茅和草地早熟禾的促生及抗性诱导作用
谢琳淼,常春丽,姚志红,王洪瑞,赵冬雪,张荣沭,敖 红
(1.东北林业大学生命科学学院,黑龙江 哈尔滨 150040; 2.东北林业大学园林学院,黑龙江 哈尔滨 150040)
草地早熟禾(Poapratensis)根茎发达、分蘖能力极强且青绿期长,能迅速形成草丛密而整齐的草坪。此外,作为放牧型禾本科牧草,其放牧时间长,耐践踏,营养价值高,是良好的家畜饲料[1-2]。紫羊茅(Festucarubra)是被广泛应用的草坪植物,其寿命长,色美,可用于机场、花坛、庭院、林下等作观赏用;亦可用于固土护坡、保持水土。由于上述优点,这两种草在我国北方地区及南方部分冷凉地区被广泛应用于园林绿化及牧草种植[3-4]。
然而近年来由于土壤盐碱化、干旱、重金属污染等全球性的生态问题,使得草坪草、牧草种子大多存在萌发率低、出苗不整齐和幼苗抗逆性弱的现象,并且这一现象在我国北方地区表现尤为明显[5-8]。因此,如何提高牧草及草坪草种子的出苗率,促进幼苗生长,提高草坪观赏价值,提高牧草的产量和质量是目前需要重点解决的问题。相比于采用周期长、见效慢的传统农业和土壤改良措施,开发和利用生物制剂提高牧草和草坪草的萌发率,促进幼苗生长,提高植株抗性是一种新思路和新方法[9-10]。
木霉(Trichodermaspp.)是一类自然界中分布广泛的生防真菌,常见于植株残体、土壤、根系、叶茎周围等环境中[11-12]。有研究表明,绿木霉(T.virens)、康氏木霉(T.koningii)、哈茨木霉(T.harzianum)等代谢物可促进种子萌发,促进小麦(Triticumaestivum)胚芽鞘及玉米(Zeamays)、番茄(Lycopersiconesculentum)幼苗的生长;增加根茎生物量[13-17];此外木霉还具有诱导植物产生系统抗性的作用[18-19]。木霉的促生效应及生防效应在多种植物材料上得到证实,但有关木霉的研究多集中在农作物和经济作物上,对牧草、草坪草促生方面的研究还较少。
本研究利用哈茨木霉孢子悬浮液对紫羊茅和草地早熟禾进行处理,通过对多个种子萌发指标、生长指标及生理生化指标的测定,研究哈茨木霉对两种草的促生效应及抗性的诱导作用,以期为如何促进草坪草及牧草的生长、提高草坪质量及适应性提供一定的理论依据。
1 材料和方法
1.1 材料
供试植物种子为草地早熟禾(公园‘Park’)和紫羊茅(梦神‘Rubra’),2016年购于哈尔滨市和平绿化有限公司。
哈茨木霉(Trichodermaharzianum)Th62由东北林业大学园林学院张荣沭提供。
1.2 哈茨木霉提取液浓度设置
种子萌发试验:结合预试验设置4个哈茨木霉浓度,分别为1×102、1×103、1×104、1×105cfu·mL-1,同时以蒸馏水作为对照(CK)。
盆栽试验:结合预试验设置哈茨木霉浓度为1×107cfu·mL-1。
1.3 试验方法
种子萌发试验:选取颗粒饱满的种子,用0.1% KMnO4消毒15 min后,用自来水冲洗至无色,再用蒸馏水冲洗3~4遍,蒸馏水浸种2 h。取干净的带塞试管,每个试管内放入等量供试草种,将配好的各浓度哈茨木霉提取液2 mL分别加入每个试管进行浸种[16],每个处理3次重复,处理3 h。取90 mm培养皿,内设双层滤纸发芽床,每个培养皿内放入50粒经过上述经哈茨木霉浸种处理后的草种,每皿加蒸馏水3 mL,每个处理3次重复。放入光照培养箱培养,模拟自然条件,白天(16 h,25 ℃),夜晚(8 h,15 ℃)。
盆栽试验:将土灭菌后用浓度为1×107cfu·mL-1的哈茨木霉提取液拌土(每400 g土拌350 mL菌液),同时用蒸馏水拌土作为对照。将两个草种分别均匀的撒入盆中,并覆保鲜膜,促进种子发芽。每个处理3个重复。待幼苗长出2片展开叶时再补加一次哈茨木霉提取液,每盆150 mL,补浇哈茨木霉提取液3周后测定生长及各项生理指标。
1.4 测定方法
1.4.1种子萌发指标测定 按照《牧草种子检验规程》(GB/T 2930.4-2001)系列国家标准进行操作,记录草地早熟禾28 d 内的种子发芽数和紫羊茅21 d内种子的发芽数[20]。本研究以胚芽长度达到种子长度一半作为种子萌发标志,并按如下公式计算种子发芽率、发芽势、发芽指数及活力指数[21-22]。培养结束后用游标卡尺测定胚根、胚芽长度。
发芽率=(发芽种子数/供试种子数)×100%;
发芽势=(达到发芽高峰期的发芽种子数/供试种子数)×100%;
发芽指数(GI)=∑(Gt/Dt)。
式中:Gt为处理不同时间内的发芽数,Dt为相应的发芽天数(t=7 d);
活力指数(VI)=GI×S。
式中:GI为发芽指数,S为一定时期内的幼苗长度。
1.4.2生长及生理生化指标测定 地上部分生物量及植株相对含水量用常规方法测定[23];可溶性糖含量测定采用蒽酮法[24];脯氨酸含量测定采用酸性茚三酮法;可溶性蛋白含量测定采用考马斯亮蓝G-250法;超氧化物歧化酶测定采用氮蓝四唑(NBT)法;过氧化物酶测定采用愈创木酚法[25]。
1.5 数据统计分析
运用Excel整理数据、制作相关图表,用DPS 7.05软件进行数据统计分析。
2 结果与分析
2.1 哈茨木霉对紫羊茅和草地早熟禾种子萌发的影响
一定浓度的哈茨木霉对两种草的种子萌发有明显的促进作用(图1)。1×103及1×104cfu·mL-1的哈茨木霉处理后,草地早熟禾种子发芽率显著高于对照(P<0.05),其中哈茨木霉浓度为1×103cfu·mL-1时,草地早熟禾发芽率达到92.0%,比对照高16.9%。1×102、1×103及1×104cfu·mL-1的哈茨木霉显著促进了紫羊茅种子的萌发(P<0.05),其中1×104cfu·mL-1哈茨木霉处理后紫羊茅种子发芽率达到74.0%,比对照高18.1%。但当哈茨木霉浓度为1×105cfu·mL-1时,两种草的种子萌发率与对照之间未见显著差异(P>0.05)。
不同浓度的哈茨木霉对发芽势的影响不同。对于草地早熟禾,哈茨木霉浓度为1×102cfu·mL-1时,其发芽势开始上升,至1×104cfu·mL-1时,其发芽势达到最大,为43.3%,比对照高8.0%。对于紫羊茅,哈茨木霉浓度在1×102及1×103cfu·mL-1时,其发芽势变化不显著;哈茨木霉浓度为1×104cfu·mL-1时,其发芽势达到最大,为58.0%,比对照高6.3%,而当哈茨木霉浓度达到1×105cfu·mL-1时,其发芽势却显著低于对照(P<0.05)。
两种草在哈茨木霉处理后种子的发芽指数变化趋势基本相同(图2)。哈茨木霉浓度为1×102cfu·mL-1时,草地早熟禾和紫羊茅种子的发芽指数显著低于对照(P<0.05);哈茨木霉浓度为1×104cfu·mL-1时,两种草种子的发芽指数达到最大,草地早熟禾种子发芽指数为10.23,紫羊茅种子发芽指数为11.85,与对照相比分别提高14.4%和18.6%,与对照间差异显著(P<0.05);哈茨木霉浓度为1×105cfu·mL-1时,两种草的发芽指数均显著低于对照。
对活力指数的测定结果显示,浓度为1×103、1×104及1×105cfu·mL-1的哈茨木霉提取液均能显著提高紫羊茅种子的活力指数(P<0.05),且1×104cfu·mL-1的哈茨木霉提取液的效果最为明显。在1×102cfu·mL-1哈茨木霉处理后草地早熟禾种子的活力指数显著下降,1×104cfu·mL-1处理后显著提高,其他浓度处理后效应并不显著(P>0.05)。

图1 哈茨木霉对紫羊茅及草地早熟禾种子发芽率和发芽势的影响Fig. 1 Effect of Trichoderma harzianum on the germination rate and germination vigor of Festuca rubra and Poa pratensis
同一植物不同小写字母表示不同哈茨木霉浓度间差异显著(P<0.05)。下图同。
Different lowercase letters within the same test material indicate significant differences among different concentrations ofT.harzianumat the 0.05 level; similarly for the following figures.
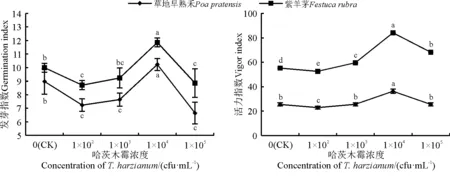
图2 哈茨木霉对紫羊茅及草地早熟禾种子发芽指数和活力指数的影响Fig. 2 Effect of Trichoderma harzianum on the germination index and vigor index of Festuca rubra and Poa pratensis
各浓度的哈茨木霉对草地早熟禾和紫羊茅的胚芽长度均有促进作用(图3),均显著大于对照(P<0.05),且随着哈茨木霉浓度增加,其胚芽长度总体呈上升趋势。哈茨木霉浓度为1×105cfu·mL-1时,草地早熟禾种子的胚芽最长,为3.51 cm,较对照增加44.4%;紫羊茅种子的胚芽最长,为7.71 cm,较对照增加40.2%。
同样各浓度的哈茨木霉处理对两种草的胚根长度均有促进作用。在哈茨木霉处理浓度达到1×105cfu·mL-1时,草地早熟禾种子胚根最长,为3.14 cm,比对照显著增加53.9%(P<0.05);紫羊茅种子胚根最长,为5.45 cm,比对照显著增加64.7%(P<0.05)。
2.2 哈茨木霉对紫羊茅及草地早熟禾生长的影响
1×107cfu·mL-1哈茨木霉对两种草株高均有促进作用(表1),处理与对照间差异显著(P<0.05),哈茨木霉处理后草地早熟禾和紫羊茅株高较对照分别增加4.29和3.89 cm。此外,哈茨木霉处理显著增加了两种草的相对含水量及生物量(P<0.05)。哈茨木霉处理后草地早熟禾和紫羊茅的相对含水量较比对照分别增加9.85%和7.12%,生物量较对照分别增加了56.10%和50.28%。
2.3 哈茨木霉对紫羊茅和草地早熟禾生理特性的影响
哈茨木霉处理后,草地早熟禾和紫羊茅叶片脯氨酸含量分别较对照上升14.0%、160.1%;可溶性糖含量较对照分别上升7.3%、76.0%,且两种草对照与处理间差异均达到显著水平(P<0.05)。哈茨木霉处理后,草地早熟禾的可溶性蛋白含量较对照提高2.14%,但差异不显著(P>0.05),紫羊茅的可溶性蛋白含量较对照提高5.68%,差异显著(P<0.05)。
哈茨木霉处理后,两种草中超氧化物歧化酶(SOD)的活性均显著提高(P<0.05),与对照相比,紫羊茅和草地早熟禾分别提高45.6%和27.1%。从酶活性提高的程度看,哈茨木霉对过氧化物酶(POD)的影响相对较小,紫羊茅的对照和处理间差异未达到显著水平(P>0.05),但草地早熟禾过氧化物酶活性在哈茨木霉处理后与对照相比提高8.8%,且差异显著(P<0.05)。

图3 哈茨木霉对紫羊茅及草地早熟禾胚芽长度和胚根长度的影响Fig. 3 Effect of Trichoderma harzianum on plumule length and radicle length of Festuca rubra and Poa pratensis

种名 Species哈茨木霉浓度T. harzianum concentration/(cfu·mL-1)生物量Biomass/g株高Plant height/cm相对含水量Relative water content/%草地早熟禾Poa pratensis0(CK)0.08±0.00b22.28±2.10b78.91±2.13b1×1070.13±0.00a26.57±2.70a86.68±0.79a紫羊茅Festuca rubra0(CK)0.10±0.01b18.46±1.12b86.85±0.44b1×1070.13±0.01a22.35±1.92a93.03±2.19a
同列不同小写字母表示处理与对照间差异显著(P<0.05)。
Different lowercase letters within the same column indicate significant differences between the treatments and the control (CK) at the 0.05 level.

图4 哈茨木霉处理对两种草叶片脯氨酸、可溶性糖及可溶性蛋白含量的影响Fig. 4 Effect of Trichoderma harzianum on the contents of proline, soluble sugar, and soluble protein in leaves of Festuca rubra and Poa pratensis

图5 哈茨木霉对两种草叶片中SOD和POD活性的影响Fig. 5 Effect of Trichoderma harzianum on the activities of superoxide dismutase (SOD) and peroxidase (POD) in leaves of Festuca rubra and Poa pratensis
3 讨论和结论
有研究表明,木霉可以促进多种植物的种子萌发和幼苗生长[13,16,21],这与本研究的结果一致。本研究中,哈茨木霉浓度为1×104cfu·mL-1时,对两种草种子的萌发均有明显的促进作用,两种草的发芽势、发芽指数及活力指数均达到最大值,并且在(1×102)~(1×105) cfu·mL-1范围内,随着哈茨木霉浓度的增加,两种草幼苗的胚根、胚芽长度也显著增加,说明一定浓度的哈茨木霉可以使两种草种子发芽快、发芽整齐,并且使幼苗生长迅速。
木霉促进种子萌发、生长的机制有多方面。有研究显示,木霉代谢过程中能够产生多种生长素类物质,如吲哚乙酸、吲哚乙醛和吲哚乙醇等[15]。生长素作为信号物质与受体结合后,会启动负责降解蛋白的SCF(SKP1/cullin/F-box)降解下游的生长素反应负调控元件AUX/IAA,激活生长素响应因子ARFs,从而启动相关基因表达,表现出促进种子萌发和伸长生长的效应[26]。另外,由于种子萌发需要消耗大量的营养物质,有学者从营养角度分析木霉的促进机制。朱衍杰等[27]研究指出,当将国槐(Sophorajaponica)的种子用康宁霉素浸种后,可以显著减少种子内部营养物质的外渗,从而使种子内贮藏的营养物质更好地用于种子萌发及幼苗生长。本研究中当哈茨木霉浓度较低(1×102cfu·mL-1)和较高(1×105cfu·mL-1)时,两种草的发芽指数均下降,这可能与哈茨木霉代谢产生的生长调节物质不足有关,也可能与哈茨木霉由于自身生长繁殖的需要与植物间存在营养竞争有关。
本研究结果显示,在土壤中施加1×107cfu·mL-1哈茨木霉后,植株的株高、生物量显著提高。这种促生效应除了生长物质的作用外,还可能与木霉的根际能力及植物的营养状况有关。有研究发现,木霉在植物根际定植后,有效地改善了植物根系的微环境,一方面可以通过分泌有机酸使土壤中难溶或微溶的营养元素溶解度加大,另一方面还可以产生某些还原酶促进植物对氧化型矿质元素的吸收[28-29]。另有研究发现,长枝木霉能够提高6种牧草幼苗的根系活力及蛋白质和可溶性糖含量[30];哈茨木霉能够提高豇豆(Vignaunguiculata)叶片内蛋白质含量,增强根系活力,从而促进豇豆的生殖生长[31],上述结果与本研究结果基本一致。哈茨木霉处理后,两种草叶片中可溶性糖、脯氨酸含量上升,且与对照间差异显著,紫羊茅中可溶性蛋白的含量也显著升高。可溶性糖、可溶性蛋白及氨基酸作为必需的碳源和氮源为植物生长和发育提供必需的物质和能量[32],因而这几种物质的增加有利于促进植物的生长。此外,本研究还发现哈茨木霉可以增强植物根系的吸水能力,提高植物的相对含水量,更好地满足植物生长对水分的需求。当然由于木霉促进植物生长的机制较为复杂,不同木霉菌株对不同植物生长的促进作用及机理各不相同,因此对哈茨木霉的促生机理还需从更多方面进一步研究。
施用哈茨木霉后脯氨酸、可溶性糖及可溶性蛋白含量增加其意义是多方面的。一方面这些物质可作为营养物质促进植物的生长,另一方面它们还可作为细胞内重要的渗透调节物质,起着调节细胞渗透平衡、增强细胞结构稳定性和减少组织氧自由基产生的重要作用[33]。因此这些物质含量的提高,可以增强细胞的持水力,稳定蛋白结构,减少植物胁迫条件下细胞的致死机会[34]。超氧化物歧化酶和过氧化物酶是植物体内重要的抗氧化酶,可清除细胞内在逆境下产生的活性氧,因而可以反映植物的抗逆性。刘连妹等[35]研究表明,哈茨木霉的孢子悬浮液可提高番茄(Lycopersiconesculentum)幼苗叶片中超氧化物歧化酶、过氧化物酶活性。本研究中,经1×107cfu·mL-1哈茨木霉处理后,两种草超氧化物歧化酶的活性显著提高,草地早熟禾过氧化物酶活性显著提高,说明一定浓度的哈茨木霉可通过提高保护酶活性来提高植物的抗逆能力。
综合各项测定指标可以看出,1×104cfu·mL-1哈茨木霉可以显著促进紫羊茅和草地早熟禾种子萌发和幼苗生长;1×107cfu·mL-1哈茨木霉可以通过增加营养物质的含量促进两种草的营养生长,同时可以通过提高超氧化物歧化酶、过氧化物酶的活性及多种渗透调节物质的含量增强植株的抗性。

