糖皮质激素对胰腺癌细胞增殖、黏附、迁移、侵袭生物学行为的影响
苏杰 卢建 黄高翔 胡新根 姜春婷 张宝燕
糖皮质激素(glucocorticoids,GCs)是体内重要的神经内分泌激素,在躯体和心理应激时均明显升高。GCs主要通过糖皮质激素受体(glucocorticoid receptor,GR)的介导发挥生物学效应,包括免疫抑制、抗炎、维持内环境稳定、胚胎发育和创伤修复等[1-2]。近年来研究发现GCs还参与肿瘤的发生、发展,地塞米松是人工合成的GCs,不仅可以作为化疗方案的组成药物直接抑制某些血液系统肿瘤细胞的增殖,并诱导其凋亡;还可以作为实体肿瘤化疗的重要辅助药物,治疗与实体肿瘤相关的某些合并症及肿瘤治疗相关不良反应。胰腺癌是一种恶性程度极高的消化系统肿瘤,90%以上是起源于腺管上皮的胰腺导管腺癌[3]。其诊断和治疗均十分困难,发现时大多已经转移,病死率非常高,5年生存率不足5%,中位生存期仅2~3个月,据美国国立卫生研究院报道其死亡率高
居恶性肿瘤第4位[4]。目前有关神经内分泌激素,尤其是GCs对胰腺癌增殖、黏附、迁移和侵袭等生物学行为的影响了解不多,仅有的研究局限在GCs抑制胰腺癌细胞增殖和增强化疗药物作用下肿瘤细胞存活等方面[5-6]。因此,阐明地塞米松对胰腺癌细胞生物学行为的影响具有重要的理论及临床意义。
1 材料和方法
1.1 细胞株 小鼠胰腺癌细胞株Panc02、人胰腺癌细胞株Mia-paca2购于美国ATCC细胞库。
1.2 试剂和仪器 RPMI-1640培养基、DMEM高糖培养基购自中国基诺生物医药技术有限公司,规格250ml;PBS、二甲基亚砜(DMSO)、无水乙醇、甲醇购自上海化学试剂有限公司,规格250ml;结晶紫购自上海生工生物有限公司,规格5g;地塞米松购自日本Sigma公司,规格5g;0.25%胰蛋白酶购自美国Gibco公司,规格500ml;FBS购自以色列BI公司,规格500ml。Transwell(3422)购自美国Corning公司;MatrigelTM细胞侵袭小室购自美国BD Biosciences公司。
1.3 细胞培养及药物处理 小鼠胰腺癌细胞株Panc02、人胰腺癌细胞株Mia-paca2分别常规培养于含10%FBS的RPMI-1640培养基和DMEM高糖培养基中,置于37℃、5%CO2培养箱中孵育,每周传代2~3次。按实验需求接种细胞于培养板内,继续培养24h后弃去原培养液,预温的PBS清洗细胞2~3遍以去除血清中激素对细胞的影响,将2株细胞分别分为地塞米松处理组和对照组,地塞米松处理组加入含10-7mol/L地塞米松的去激素血清培养液,对照组加入等体积含1‰无水乙醇的培养基。
1.4 细胞增殖实验 将生长状态良好的细胞接种于96孔板,每孔细胞数1 000~3 000个,培养箱中孵育过夜后给予相应药物处理不同时间(24、48、72h),弃去培养液,每孔加入150μl DMSO充分震荡溶解细胞后,采用酶联免疫检测仪检测其在570nm波长处的吸光度(OD)值。
1.5 细胞黏附实验 细胞经药物预处理24h,胰酶消化制成单细胞悬液,接种8×104个/200μl细胞于96孔板,继续培养45min后,PBS轻洗去除未贴壁细胞。每孔加入150μl DMSO充分震荡溶解剩余贴壁细胞后,采用酶联免疫检测仪检测其在570nm波长处的OD值。
1.6 细胞划痕实验 将生长状态良好的细胞接种于12孔板(种板数以第2天细胞长满为宜),培养箱培养过夜;第2天用无菌的10μl枪头于培养板孔底部均匀划痕,PBS轻洗后拍照并标记,按组别给予相应药物处理24h,于100倍镜下观察划痕融合情况,固定视野拍照。并通过画图软件测量24h时划痕宽度及起始划痕宽度,两者比值得出划痕愈合百分比(%),进而体现细胞水平迁移能力。
1.7 细胞侵袭实验
1.7.1 预平衡 于24孔板中加入800μl不含血清的培养液,将Transwell小室和侵袭小室置于24孔板内,37℃培养箱中平衡1h。
1.7.2 细胞处理 接种细胞于6孔板,经过夜培养后,给予相应药物处理24h;细胞经胰酶消化制成单细胞悬液(两组持续给予相应药物),以每孔 4×104个细胞/200μl接种于预平衡处理过的Transwell小室和侵袭小室内,置培养箱中继续培养。
1.7.3 固定染色 24h后,吸去Transwell小室和侵袭小室中残液,棉签轻轻拭去上室侧的细胞,后置于冰甲醇中固定10~15min,置于0.1%结晶紫染液中染色15~20min;PBS清洗后晾干,每孔随机取5个视野于100倍镜下计数并拍照。
2 结果
2.1 地塞米松对胰腺癌细胞增殖能力的影响 胰腺癌细胞株Panc02和Mia-paca2的增殖能力随着培养时间的延长而逐渐增强,但地塞米松处理组在各个时间点(24、48、72h)与对照组比较差异均无统计学意义(均P>0.05),见图 1。
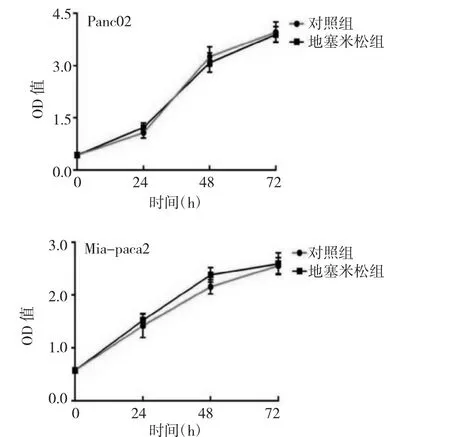
图1 地塞米松对胰腺癌细胞Panc02和Mia-paca2增殖能力的影响
2.2 地塞米松对胰腺癌细胞与细胞外基质黏附能力的影响 胰腺癌细胞株Panc02和Mia-paca2经10-7mol/L地塞米松处理24h后,细胞与细胞外基质的黏附能力较对照组细胞明显增强,分别约为对照组的1.8倍和2倍(均P<0.05),提示地塞米松能够明显增强胰腺癌细胞与细胞外基质的黏附能力,见图2。

图2 地塞米松对胰腺癌细胞Panc02和Mia-paca2黏附能力的影响(与对照组比较,*P<0.05)
2.3 地塞米松对胰腺癌细胞迁移能力的影响 经10-7mol/L地塞米松处理24h后,胰腺癌细胞株Panc02和Mia-paca2的垂直迁移能力显著增加,分别约为对照组的 8倍和 2.5倍(均P<0.05)(图 3a-b,见插页);进一步采用细胞划痕实验观察了地塞米松对胰腺癌细胞株Panc02和Mia-paca2水平迁移的影响,发现地塞米松处理组胰腺癌细胞的水平迁移能力明显增强(均P<0.05)(图3c-d,见插页),提示地塞米松能够明显增强胰腺癌细胞的迁移能力。
2.4 地塞米松对胰腺癌细胞侵袭能力的影响 经10-7mol/L地塞米松处理24h后,胰腺癌细胞株Panc02和Mia-paca2的侵袭能力显著增强,分别约为对照组的6倍和3.5倍(均P<0.05),提示地塞米松能够明显增强胰腺癌细胞的侵袭能力,见图4(插页)。
3 讨论
肿瘤的发生、发展是个非常复杂的过程,除了致瘤因素导致的细胞多步骤多基因突变而产生的增殖、分化、凋亡、迁移等调控环节失常外,还受免疫系统、肿瘤微环境及体内神经内分泌等多重因素的影响[7]。而作为体内重要神经内分泌激素之一的GCs除了具有强大的抗炎和免疫抑制外,还能够直接调控正常或恶变细胞的增殖、分化及凋亡。以往研究表明,GCs对多种实体肿瘤均产生生物学效应,如地塞米松能够抑制非小细胞肺癌、肝癌等的增殖,能够促进乳腺癌、前列腺癌等在低血清或化疗药物作用下的存活[8-11]。尽管如此,GCs对胰腺癌的生物学效应,特别是胰腺癌细胞的迁移、侵袭还不清楚。
Benz等[5]发现GCs能够抑制小鼠胰腺癌AR42j细胞的增殖。Norman等[6]研究也发现地塞米松能够抑制人胰腺癌细胞的增殖,且该效应是剂量依赖性的。而本实验发现10-7mol/L地塞米松在处理72h内未能明显改变2株胰腺癌细胞的增殖,可能与地塞米松作用的时间较短,未发现明显增殖抑制效果有关。本实验还发现10-7mol/L地塞米松能明显增强胰腺癌细胞与其细胞外基质的黏附能力。由于肿瘤细胞与其细胞外基质的黏附能力增强能够激活整合素信号通路,通过激活PI3K/Akt通路促进细胞的存活,是肿瘤细胞产生化疗药物抵抗的机制之一[12-13]。本研究提示地塞米松能够通过增强胰腺癌细胞的黏附能力,从而增加其对化疗药物的抵抗能力。
本实验还研究了10-7mol/L地塞米松对2株不同胰腺癌细胞迁移和侵袭生物学行为的影响。结果发现地塞米松能够明显增强胰腺癌细胞的迁移和侵袭能力,提示GCs对于胰腺癌细胞体内的转移有促进作用,而该促进作用与其促进胰腺癌细胞自身的迁移侵袭有关。另外,Piette等[14]研究显示,在严重联合免疫缺陷(SCID)小鼠的移植瘤模型中,地塞米松能抑制神经胶质瘤的进展和转移。但也有报道在荷瘤裸鼠模型中地塞米松处理的结肠癌HT-29细胞肝脏转移瘤的数目明显增多[15]。由此看出,在不同的肿瘤细胞中地塞米松对其侵袭转移的生物学作用体现出不一致性,提示GCs对肿瘤侵袭转移的生物学作用具有肿瘤细胞特异性。GCs对机体的影响更是多方面的复杂过程,因此在整体实验中证实GCs对于胰腺癌细胞迁移、侵袭等生物学行为的影响更具有临床意义。前期Egberts等[16]报道显示,在SCID小鼠的移植瘤模型中,地塞米松能够抑制胰腺细胞癌的进展和转移。该结果与本实验结果不甚一致,由于采用此种小鼠的结果并不能真实说明GCs在整体中对胰腺癌细胞转移和进展的作用。因此,有必要采用更好的动物模型更深入的研究体内GCs对胰腺癌细胞迁移、侵袭和转移的影响,这也是笔者下一步实验研究的重点。
机制方面,Békási等[17]研究发现在正常胰腺组织和胰腺癌中GR分布有明显不同,这提示了GCs/GR信号通路调控的下游靶蛋白在胰腺癌的发生、发展中具有重要的作用。Huang等[18]研究发现细胞骨架蛋白ROCK介导了GCs促进黑色素瘤的体外迁移、侵袭和体内肺转移的效应。另外,Hidalgo等[19]、Smith等[20]研究发现GCs还可影响肿瘤微环境中的间质成分发挥促肿瘤侵袭转移的生物学效应。以上研究表明,GCs可以通过直接作用于肿瘤细胞来影响其迁移及侵袭,也可以影响肿瘤组织局部(微环境)调控肿瘤细胞的侵袭和转移。
综上所述,本实验发现应激或药理剂量的GCs能够明显增强胰腺癌细胞的黏附、迁移和侵袭能力,但对其增殖能力没有明显影响。该发现有助于进一步阐明应激状况下GCs对胰腺癌发生、发展的作用,从而进一步认识应激激素与实体肿瘤的关系。

