铅胁迫对北海道黄杨和雪中红生理指标的影响
赵志汝,王东超,孟伟芳,郭冠男,汪 健
(河南红枫种苗股份有限公司,河南 郑州 450002)
我国农田土壤重金属中铅的含量居首位,我国西南部的土壤Pb含量出现高值[1],西藏东部以及云南、四川地区,广东西北与湖南交界以及辽宁环渤海土壤Pb含量次之,西北部新疆地区含量较少[2-4]。重金属可随着土壤迁移到农作物从而进入动物以及人体内,严重威胁生态系统,危害人类身体健康。铅(Pb)是重金属污染中最广泛的污染源之一,铅通过汽车尾气及城市污水污染空气、土壤,进而通过植物、动物进入人体,极大危害人类的生命健康,因此铅污染成为当前重金属治理过程中的重中之重。
植物修复作为重金属污染土壤的生态修复手段,植物利用根系吸收重金属,并将重金属污染物吸收于植物体内[5],以及其根系保护重金属污染土壤使其不因风、侵蚀、淋溶以及土壤分散而迁移,减少重金属污染的扩散[6]。因此选择理想的园林绿化树种作为重金属含量高区域的园林绿化树种,是当前生态修复研究的热点问题。
北海道黄杨(EuonymusjaponicusThunb.)为卫矛科卫矛属常绿灌木,原产日本,1986年从日本北海道市引入我国,是一种抗寒性强、抗病强、适生范围广、生长较快的常绿阔叶乔木树种。雪中红(EuonymusjaponicusXuezhonghong)由北海道黄杨中选育出来,除了具有北海道黄杨的优良特点外,其叶片冬季呈现深红色,不落叶,且能安全度过北方冬季,为北方冬季绿化的优选植物[7]。近年来有关铅胁迫在园林植物上的研究主要集中在海桐、杉木、香樟、冬青、杜鹃、桂花等常见园林植物[8-11],未见铅胁迫对北海道黄杨和雪中红生长及铅吸收量的影响。因此本试验选用北海道黄杨和雪中红作为研究对象,研究铅胁迫对北海道黄杨和雪中红的生物量、酶活性以及铅吸收量的影响,以期探索北海道黄杨和雪中红在铅污染土壤修复中的应用效果,旨在为生态修复树种的选择提供理论依据。
1 材料与方法
1.1 试验材料
本试验于2017年4月至2017年9月在河南红枫种苗股份有限公司的郑州市绿化苗木新品种繁育工程技术中心进行。供试材料为北海道黄杨、雪中红,均由郑州市绿化苗木新品种繁育工程技术中心提供。铅溶液用硝酸铅[Pb(NO3)2]配制。
1.2 试验设计
2017年4月1日,选择长势均匀一致、无病虫害、枝叶饱满,株高(50±1) cm的北海道黄杨和雪中红植株分别栽种于1加仑试验盆中,每盆装土6 kg(干重),试验用土选自河南郑州的沙壤土,土壤过筛后装入试验盆,每盆栽植苗1株,苗木定植后,浇定根水,放置于防雨棚内,正常管理。
2017年5月1日开始铅胁迫试验,试剂选用Pb(NO3)2,胁迫质量分数分别为0,500 ×10-6,1 000×10-6,1 500 ×10-6,2 000 ×10-6(以千克风干土中含Pb2+的毫克数计),每个处理设重复3个。5月1日开始浇灌第1次铅溶液,以后每隔5 d浇灌1次含铅溶液,共浇灌4次,每次浇灌含铅溶液250 mL,以后视干旱程度浇灌自来水。试验苗放于室外,雨天遮雨,避免试验盆中铅淋失。
90 d后试验结束,取植株顶部3—5 g新鲜植株叶片测定超氧化物歧化酶(SOD)和丙二醛(MDA)含量。另收集全株植物,用自来水彻底清洗干净,用蒸馏水冲洗,晾干后放入烘箱中,105 ℃杀青30 min,然后在80 ℃下烘干至恒重,称其干重,将植物样品研磨后过100目筛网,测定植物铅含量。
超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)光还原法[12],在分光光度计560 nm处分别测定其吸光度,以能够抑制NBT光还原50%为一个酶活力单位(U);丙二醛(MDA)含量采用硫代巴比妥酸法测定[12];植物样的铅含量测定:秤取研磨过筛的植株样品0.5 g于消化管中,加5 mL浓HNO3+HClO4(容积比5∶1)混合酸,过夜后在电炉上高温消解至无色透明,用AA-7003型原子吸收光谱仪石墨法测定重金属铅的含量[12]。
1.3 数据处理
数据用平均值±标准差来表示,数据分析采用SPASS数据处理系统进行方差分析,显著性比较采用LSD和Duncan’s,所有结果均为3次重复的平均值。
2 结果与分析
2.1 生长指标
从表1可以看出,铅胁迫抑制了北海道黄杨和雪中红的生物量累积,随着铅质量分数的增加,北海道黄杨和雪中红的生物量均呈下降趋势,且在2 000×10-6的Pb(NO3)2溶液处理下生物量的累积达到最低。与对照相比,北海道黄杨的生物量分别减少了21.49%,34.30%,45.18%,47.65% ,且各处理与对照相比,差异均达到显著水平和极显著水平;表明铅明显抑制了北海道黄杨的生物量的累积。与对照相比,雪中红的生物量分别降低了14.04%,26.33%,28.71%,44.13%。当北海道黄杨在1 500×10-6的Pb(NO3)2溶液处理时,雪中红在2 000 ×10-6的Pb(NO3)2溶液处理时,生物量的下降幅度在40%以上。表明雪中红与北海道黄杨相比,耐铅能力更强。
就生物量而言,铅胁迫对北海道黄杨的影响大于雪中红。与对照相比,铅胁迫明显影响了北海道黄杨的生物量累积,每个处理与对照相比,均达到极显著水平。而雪中红以高于1 000×10-6的Pb(NO3)2溶液处理时,与对照显著差异,表明雪中红的耐受性高于北海道黄杨。
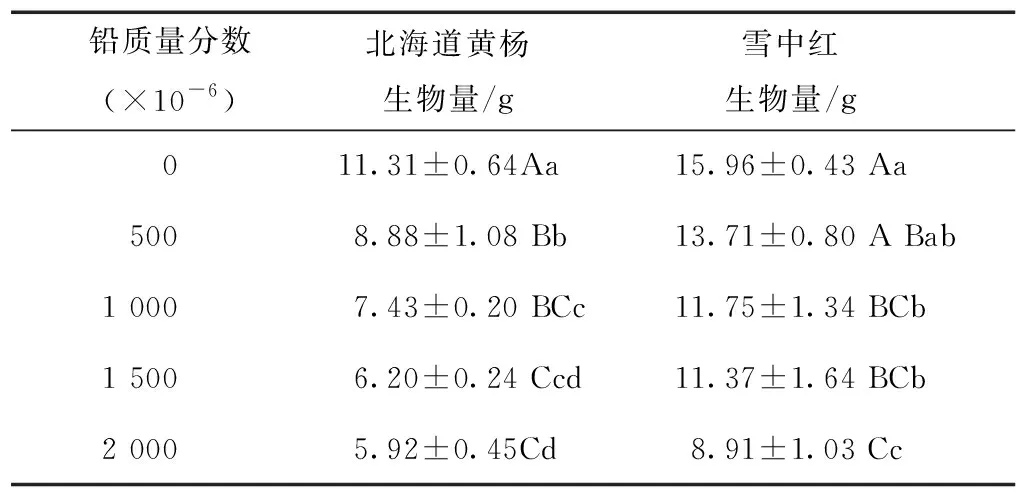
表1 Pb胁迫对北海道黄杨和雪中红生物量的影响
同列数据后不同大写字母表示处理间差异达到极显著水平(P<0.01),不同小写字母表示处理间差异达到显著水平(P<0.05)
2.2 SOD活性和MDA含量
植物受到外界胁迫时,会表现出自身抵抗胁迫的能力。SOD是植物体内清除活性氧自由基最关键的保护酶之一,能有效清除植物体内过多的氧自由基并降低其对膜脂的过氧化程度[13]。植物在逆境胁迫下细胞膜首先受到伤害,膜脂过氧化物增加,MDA作为膜脂过氧化物的产物,其在机体内的累积会对细胞产生毒害作用,是反映植物膜脂过氧化程度最为直接的指标[14-15],其含量可代表膜损伤程度的大小。
表2数据表明,北海道黄杨的SOD活性呈先上升后下降的变化趋势,且在1 500×10-6的Pb(NO3)2溶液处理时达到最大值,是对照的398%,而雪中红SOD活性呈现上升趋势,在2 000×10-6的Pb(NO3)2溶液处理时达到最大值,为对照的469%。表明铅胁迫强度增加促进了植物活性氧的生成,诱导SOD活性的增加。北海道黄杨在1 500×10-6的Pb(NO3)2溶液处理下SOD活性下降,表明自由基的累积超出SOD的保护能力。北海道黄杨和雪中红的SOD活性在各处理间均存在极显著差异,表明铅胁迫对北海道黄杨和雪中红保护酶活性有显著影响。各处理间均表明雪中红的SOD活性大于北海道黄杨的SOD活性,表明铅胁迫下,雪中红清除自由基的能力高于北海道黄杨。
MDA含量与SOD活性表现不同,随着铅胁迫的增强,北海道黄杨和雪中红的MDA含量呈上升趋势,2 000×10-6的Pb(NO3)2溶液处理时,MDA含量最高,分别为对照的257%和215%。雪中红在每个处理间的MDA含量均低于北海道黄杨,表示细胞膜脂过氧化水平高,膜结构受损伤程度加深,植物的抗逆性减弱。表明雪中红对重金属铅的耐受性高于北海道黄杨。

表2 Pb胁迫对北海道黄杨和雪中红SOD活性和MDA含量的影响
同列数据后不同大写字母表示处理间差异达到极显著水平(P<0.01),不同小写字母表示处理间差异达到显著水平(P<0.05)
2.3 铅吸收量
由表3可知,随着铅胁迫的增强,北海道黄杨和雪中红的铅吸收量呈缓慢上升趋势,北海道黄杨分别在500×10-6, 1 000×10-6和1 500×10-6, 2 000×10-6的Pb(NO3)2溶液处理下差异不显著,而雪中红在1 500×10-6, 2 000×10-6的Pb(NO3)2溶液处理下差异不显著,趋于稳定,表明北海道黄杨和雪中红的铅吸收量在质量分数范围1 500×10-6—2 000×10-6的Pb(NO3)2溶液处理达到最高值。除对照处理外,北海道黄杨铅吸收量均低于雪中红,为雪中红吸收量的37%—53%,说明铅胁迫刺激雪中红对土壤中水分和铅的吸收,表现出超强吸附能力。
表3 Pb胁迫对北海道黄杨和雪中红铅吸收量的影响

铅质量分数(×10-6)北海道黄杨铅吸收量/μg雪中红铅吸收量/μg0115.03±16.42 Cc105.44±6.93 Dc500352.37±63.46 Bb949.79±57.11 Cb1 000433.21±30.75 Bb1 125.94±40.07 Bb1 500779.80±59.18 Aa1 600.42±67.93 Aa2 000866.99±52.59 Aa1 648.83±30.40 Aa
同列数据后不同大写字母表示处理间差异达到极显著水平(P<0.01),不同小写字母表示处理间差异达到显著水平(P<0.05)
3 结论与讨论
铅胁迫抑制了北海道黄杨和雪中红生物量的累积,并且随着铅胁迫的增强,北海道黄杨和雪中红的生物量逐渐减少,同李永杰等[16]研究结果,这是因为铅胁迫对北海道黄杨和雪中红植株根系产生破坏作用,导致根系活力下降,从而根系发育受阻,影响植物正常生长。北海道黄杨在1 500×10-6的Pb(NO3)2溶液处理时,生物量下降45.18%,而雪中红在2 000×10-6的Pb(NO3)2溶液处理时,生物量下降幅度为44.13%。就生物量下降幅度而言,雪中红对铅的耐受性要高于北海道黄杨。
铅胁迫下北海道黄杨和雪中红表现出自身抗胁迫的能力和渗透调节保护能力,其中MDA变化趋势同红瑞木[14]和紫穗槐[17]的研究结果,均表现随铅胁迫强度的增加,叶片中MDA含量呈上升趋势。北海道黄杨和雪中红植物叶片中SOD含量变化趋势不同,北海道黄杨表现先上升后下降的趋势,1 500×10-6的Pb(NO3)2溶液处理时SOD酶活性达到最大,变化趋势李春香等[18]研究的一致,北海道黄杨能适应低质量分数铅胁迫,当以高于1 500×10-6的Pb(NO3)2溶液处理时,超过自身抵御能力,SOD酶活性降低,导致其清除活性氧能力也降低;雪中红叶片中SOD酶活性则呈直线上升趋势,在2 000×10-6的Pb(NO3)2溶液处理时酶活性达到最大,而且雪中红的MDA含量在每个处理中表现均低于北海道黄杨,表明铅胁迫下雪中红的耐受性高于北海道黄杨。
重金属累积能力的大小是生态修复物种选择的一个重要指标。本试验中,北海道黄杨和雪中红植物铅吸收量都随铅处理质量分数的升高呈上升趋势,这与前人[19]研究一致。北海道黄杨在500×10-6—1 000×10-6和1 500×10-6—2 000×10-6的Pb(NO3)2溶液时上升平缓,分别没有显著差异。雪中红在1 000×10-6—2 000×10-6的Pb(NO3)2溶液的处理间没有极显著差异(P<0.1),表现为上升趋势平缓,表明北海道黄杨和雪中红植物在受到高质量分数铅胁迫下,植株吸收Pb2+能力逐渐减弱,其调节能力受到限制,植株开始逐渐收到伤害,本试验酶活性和生物量的试验结果也证实了这一点。由于本试验铅胁迫质量分数选择的限制,北海道黄杨和雪中红均在1 500×10-6的Pb(NO3)2溶液处理时植株达到最大吸收量,对高于2 000×10-6的Pb(NO3)2溶液处理下植物的耐受性还需要试验。
在选择重金属污染土壤修复植物时,既要考虑该植物对重金属的吸附能力,还要考虑该植物生物量的大小[20]。本文中同规格苗木,同样试验条件下,雪中红的生物量在各胁迫处理下均高于北海道黄杨,对照条件下,雪中红生物量是北海道黄杨的1.4倍,2 000×10-6的Pb(NO3)2溶液处理下则是1.5倍。雪中红和北海道黄杨对重金属铅的吸收量的比较,也表明了雪中红对铅吸收量高于北海道黄杨。
结合生物量、生理指标和铅吸收量反映,在应对重金属铅的胁迫时,北海道黄杨和雪中红均表现一定的自身抵抗胁迫能力、渗透调节保护能力,相比北海道黄杨而言,雪中红表现出较强的抵抗能力和吸附能力,可作为重金属铅污染地区生态修复的优良树种。

