表面电性可控磁珠微流控芯片在DNA提取中的应用
黄华斌 傅 奇 胡 佳 游其华 庄峙厦, 杨朝勇 王小如*,
1(厦门华厦学院 检验与科学技术系, 厦门 361024) 2(厦门大学 化学化工学院, 厦门 361005)
1 引 言
固相萃取法提取DNA是利用固体物质(如硅、玻璃、离子交换树脂表面[1])与DNA分子发生共价键合或静电作用等,实现DNA吸附。与传统的热法[2]提取相比, 固相萃取法具有操作简便、DNA降解少的优点,且固相萃取技术易与微流控芯片集成[3],有利于实现DNA微全分析,目前已有研究[4,5]将固相萃取技术与PCR扩增集成在微流控芯片中,实现全血DNA的提取与分析。
根据填充物制作方法不同,基于固相萃取的DNA提取微流控芯片可分为非填充式芯片和填充式芯片。非填充式芯片主要在刻蚀出的通道中进行表面功能化修饰加工[6],这类芯片性能稳定,但加工过程繁琐,加工费用昂贵[7]; 填充式芯片是在管道中填充二氧化硅等固定相载体以实现对DNA的提取[8]。Tian等[9]将硅球填充在毛细管内,以硅球为载体提取了DNA,实现了SPE法的小型化; Breadmore[10]利用Sol-gel把硅珠固定填充到微沟道中,实现从血液、细菌和病毒样品中提纯DNA,这类芯片载体更换灵活,但在芯片内不易控制,提取过程易造成管道堵塞。二氧化硅包裹的磁性微球具有操控简单方便[11]、机械强度较高、耐酸碱腐蚀、比表面积大、固定效率高和生物相容性好等优点[12-13],已被应用于生物提取。Shan等[14]对磁性纳米粒子表面进行改性,获得pH可控的磁珠,并成功用于病毒和质粒DNA的提取。由于磁珠的可操控性强,在微流控芯片中有良好的应用优势[15],Choi等[16]通过磁场将表面固定有生物素标记抗体的磁珠固定在芯片通道中,通过磁场控制,可以简单方便地引入或排出磁珠; Zhang等[17]构建了夹层式的磁珠固相萃取芯片,实现了λ-DNA的微量提取; Li等[18]构建了磁珠芯片,提取人类淋巴细胞中的DNA,提取效率虽比市售试剂盒略低,但有助于实现自动化分析。
本研究采用自制的表面电性可控的磁珠[19],用于微流控芯片中,充分利用氨基化超顺磁纳米颗粒容易在通道中固定、DNA分子与表面电性可控磁珠吸附和解吸控制简单且时间短的优势,构建了DNA固相萃取芯片。采用激光刻蚀方法在聚甲基丙烯酸甲酯(PMMA)上烧蚀出所需孔道,通过热压封接孔道,芯片设计简单,操作方便; 灌注磁珠于芯片通道中,磁珠填充操控容易,依靠磁场固定于通道中,提取过程自动化程度高。考察了流速等提取实验的参数,并通过对提取液进行凝胶电泳与PCR实验,与商业化试剂盒进行性能对比,构建了一种便捷的全血中基因组DNA的提取芯片。
2 实验部分
2.1 仪器与试剂
激光仪(美国Spirit公司); JVC-1000热压键合机(苏州汶灏股份有限公司), HARVARD PHD2000微量注射泵(美国Harvard公司); NanoDrop-1000全波长紫外/可见光扫描分光光度计(美国Thermo公司); PowerPac Basic凝胶电泳仪(美国BIO-RAD公司); GeL Logic 200凝胶成像系统(美国Kadak公司); ADL1233 PCR仪(美国BIO-RAD公司); Zetasizer nano Zeta电位分析仪(英国Malvern公司); JEM2100透射电子显微镜(日本JEOL公司)。
聚甲基丙烯酸甲酯(PMMA,2 mm, 深圳日昌有机玻璃化工有限公司); 三(羟甲基)氨基甲烷(Tris碱)、乙二胺四乙酸钠(EDTANa2·2H2O)、无水乙醇、乙酸钠和乙二醇(分析纯,国药集团化学试剂有限公司); 血样为正常人血样,由厦门大学医院提供; 血细胞裂解液、蛋白酶K (美国Invitrogen公司); Taq DNA 聚合酶(1 u/μL,日本TaKaRa Biotechnology公司); 脱氧核糖核酸(dNTPs,美国Promega公司); 琼脂糖(LP0028A, 英国Oxoid公司K); 50 bp Ladder(北京Tiangen公司); 溴化乙锭(EtBr,上海生工生物公司); 超纯水(18.2 MΩ·cm)由Milli-Q(美国Millipore公司)制备。TE缓冲液(10 mmol/L Tris-HCl, 1 mmol/L EDTA, pH 8.0); 扩增片段包括256 bp,正向引物5′-TGC TTG TGA ATT TTC TGA GAC GGA TG -3′,反向引物5′-AAC AGA ACT ACC CTG ATA CTT TTC TGG A -3′ (美国Promega公司)。
2.2 实验方法
2.2.1氨基化SiO2@Fe3O4磁性复合微球制备与表征采用水热法和Stöber法制备具有核壳型结构的超顺磁性SiO2@Fe3O4微球,采用氨丙基三乙氧基硅烷(APTES)对SiO2@Fe3O4微球表面进行修饰,得到表面电性可控的氨基化SiO2@Fe3O4磁性复合微球[19],采用透射电镜表征磁珠形貌。取20 mg磁珠分散于5 mL超纯水中,浓度为4 μg/μL,备用,采测量磁珠(100 ng/mL)在提取核酸时所用几种溶液(吸附溶液,淋洗液,洗提液)中的Zeta电位,研究磁珠在不同溶液中的表面电性。

图1 磁珠芯片设计图: (A) 芯片俯视示意图; (B) 芯片各层示意图Fig.1 Design of magnetic beads chip: (A) Over view of chip; (B) layers of chip
2.2.2芯片设计与制作微流控芯片的通道由聚甲基丙烯酸甲酯(PMMA)经过激光刻蚀后热压封接而成。图1为磁珠芯片的设计图,图1A为芯片俯视图,由图1B中的3片PMMA基片按从上到下顺序热压封接得到。图中的圆环为穿孔的液流口,线条为液流通道。激光仪的工作参数如表1所示。图中上层基片中通道宽约300 μm,深约200 μm; 底层基片中通道宽约500 μm,深约200 μm。
表1 激光仪刻蚀参数
Table 1 Etching parameters of laser instrument
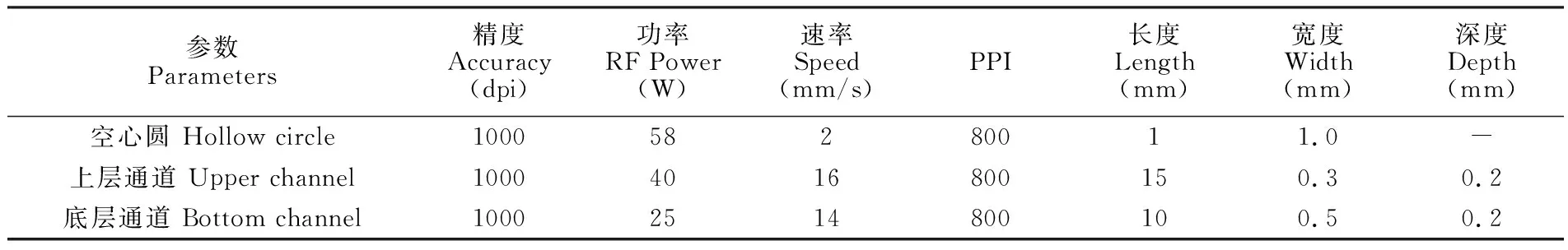
参数Parameters精度Accuracy(dpi)功率RF Power(W)速率Speed(mm/s)PPI长度Length(mm)宽度Width(mm)深度Depth(mm)空心圆 Hollow circle100058280011.0-上层通道 Upper channel10004016800150.30.2底层通道 Bottom channel10002514800100.50.2
2.2.3磁珠芯片用于DNA提取(1)磁珠芯片操作方法:如图2所示,2和3接微量注射泵,7接恒流泵。工作时,首先关闭6和8,磁珠由1处注入,7接恒流泵,牵引磁珠悬浊液进入芯片,磁珠到达5处时,由于5下方放置的永磁铁的作用,磁珠停留在5中,4为图1中2的穿孔小圆圈。待磁珠全部到达5处时,关闭1和7,打开6,微量注射泵从2处注入样品溶液,样品溶液流经5时,溶液中的DNA与5中的磁珠结合,其他未能结合的物质离开5,流出芯片,切换注入淋洗液,淋洗液将冲洗附着在磁珠表面的溶剂和其他未结合物质,并流出芯片。结束后关闭6,打开8,利用微量注射泵从3处注入洗脱液,流经5处时,由于溶液pH值的改变使DNA从磁珠表面脱附,并随洗脱液从8处流出,收集洗脱液,短期保存于4℃,取适量洗脱液进行PCR实验。实验结束,移去磁铁,断开7与恒流泵的接口,1接注射泵依次用2 mol/L NaOH和超纯水清洗各个通道,排出芯片内磁珠,弃去。通道清洗干净后,芯片可重复使用。
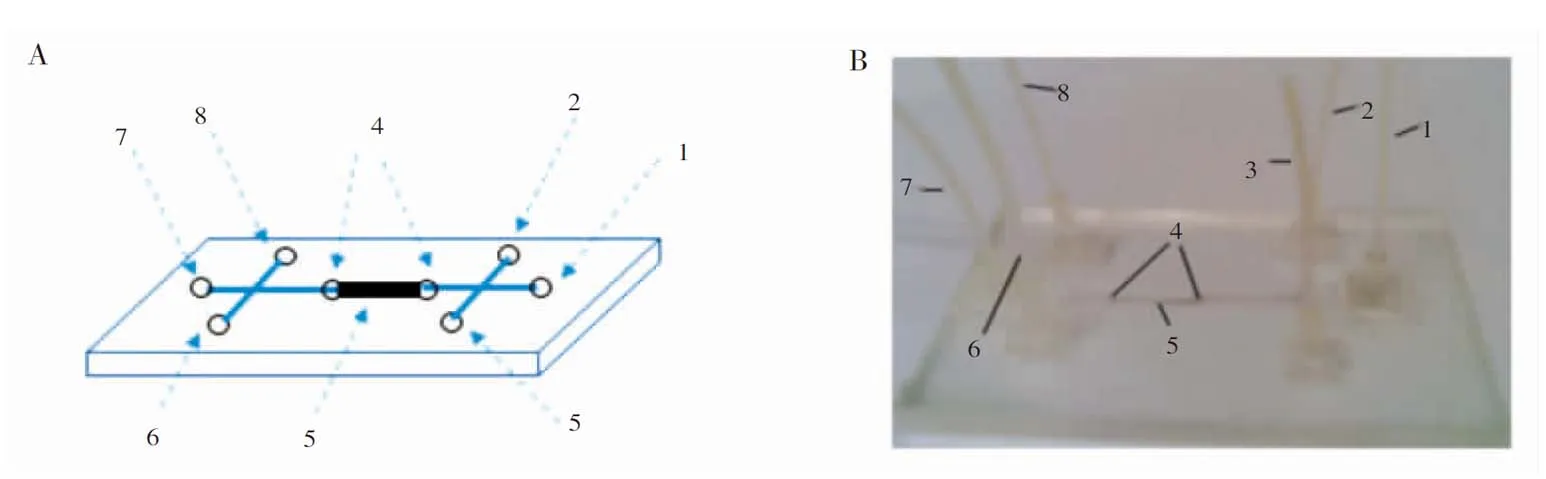
图2 磁珠芯片图: (A)为示意图; (B)为实物照片1. 磁珠溶液进口; 2. 样品与淋洗液进口; 3. 洗提液进口; 4. 双堰; 5. 磁珠固定区域; 6. 样品与淋洗液出口; 7. 磁珠出口; 8. 洗提液出口。Fig.2 Diagram of magnetic beads chip: (A) Sketch map of magnetic beads chip; (B) Physical drawing of magnetic beads chip1. Magnetic beads solution inlet; 2. Sample and eluent inlet; 3. Eluant inlet; 4. Double weir; 5. Beads fixed area; 6. Sample and eluent outlet; 7. Magnetic beads outlet; 8. Eluant outlet.
(2)磁珠芯片提取DNA实验条件优化:全血提取DNA实验中,在20 μL全血中加入200 μL裂解液和2 μL蛋白酶K,混匀,进行裂解反应,裂解反应后加入30 μL NaAc-HAc (2 mol/L, pH 5.0)溶液,混匀。按芯片操作方法进行实验,实验参数按表2设置,收集洗脱液,用Nanodrop检测洗脱液在260 nm的吸收值与纯度,计算磁珠芯片的提取效率。
表2 磁珠芯片提取DNA实验条件
Table 2 Experimental conditions for DNA extraction by magnetic bead chip

步骤Experimental steps溶液组成Solution compositionpH值pH总体积Volume(μL)流速Flow speed(μL/min)时间Time(min)磁珠Magnetic beads20 μL bead (4 μg/μL)+20 μL NaAc-HAc (2 mol/L)5.0401000.4吸附 Adsorption20 μL Whole blood +200 μL lysis solution+2 μL Protenase K+30 μL NaAc-HAc (2 mol/L)5.22521025淋洗 ElutionNaAc-HAc (2 mol/L )5.02002010解吸 DesorptionTE 10× pH 8.08.02054
2.2.4提取产物的分析取5 μL洗脱液进行凝胶电泳(0.6%琼脂糖,80 V,50 min),并与自制磁珠芯片外提取液和商品化提取试剂盒提取液进行对比。取适量的洗脱液进行PCR实验:模板分别为磁珠芯片洗脱液、自制磁珠芯片外提取液和商品化提取试剂盒提取液,并用TE溶液进行空白对照实验。扩增片段包括256 bp,正向引物5′-TGC TTG TGA ATT TTC TGA GAC GGA TG-3′,反向引物5′-AAC AGA ACT ACC CTG ATA CTT TTC TGG A-3′。25 μL PCR 反应体系中含有正反向引物各0.01 μmol、d5 μmol NTP、2.5 μL缓冲液(10×)、0.25 μL Taq DNA 聚合酶及100 ng模板。热循环参数为:94℃预变性3 min; 然后以94℃变性 30 s,56℃退火30 s,72℃延伸30 s; 扩增30个循环; 最后72℃延伸5 min使反应完全。反应完成后,取反应产物5 μL在3.0%琼脂糖凝胶上进行电泳(1×TAE电泳缓冲液,电压70 V,50 min),用凝胶成像系统拍摄电泳图谱。
3 结果与讨论
3.1 磁珠形貌及其表面电性表征
磁珠的透射电镜图如图3所示,磁珠大小约300 nm。DNA提取中所用到裂解液、淋洗液与洗提液的pH值都影响氨基化磁珠的表面电性。实验表征了氨基化磁珠分散在各种溶液时的Zeta电位,如图4所示,淋洗液a为2 mol/L NaAc-HAc (pH 5.0),样品处理液b为:200 μL裂解液+2 μL蛋白酶K+30 μL 2 mol/L NaAc-HAc (pH 5.2),洗脱液c为:TE10×(pH 8.0),样品处理对照液d为:裂解液+蛋白酶K(pH 9.3)。其中a的作用是使磁珠表面电荷为正,并中和裂解液中的碱,作为提取过程中的淋洗液; b为磁珠吸附DNA分子时所处的反应环境; c为DNA分子从磁珠表面解析时所用的洗脱液; d为b的对照实验所需而设计。根据氨基化磁珠的Zeta电位实验结果可知,氨基化磁珠在不同pH值的溶液中表现出表面电性不同.在淋洗液(醋酸缓冲溶液)和样品处理液中,磁珠表面电荷为正,在洗脱液中磁珠表面电荷为负,通过改变溶液的pH可以控制磁珠表面的电性而实现对DNA的提取:低pH溶液中磁珠表面为正电性,此时溶液中若有负电性的DNA分子,则两者由于静电引力作用而吸附在一起,而当溶液的pH值较高时,磁珠表面的电性转变为负电,此时,在其表面的负电性DNA分子由于静电斥力而脱离磁珠表面。对实验过程中芯片的流出溶液(样品处理液、淋洗液和洗脱液)进行DNA纯度测定,分别为:样品处理液A260/A280=1.053,淋洗液A260/A280=0.625,洗脱液为A260/A280=1.72,由此可见,本研究构建的表面电性可控的磁珠芯片可通过控制提取过程中溶液的pH值在液流流动的过程中实现磁珠对DNA的吸附与脱附。

图3 磁珠透射电镜图Fig.3 Transmission electron microscopy (TEM) image of magnetic beads
已报道的DNA萃取主要基于二氧化硅表面与DNA分子形成氢键或其它共价键的形式结合,结合和脱附时间较长,整个提取过程时间通常约为15~60 min,具体时间与样品提取量相关,一般的样品量少于10 μL[5,20]。本研究采用的氨基化磁珠与DNA分子的作用力主要为静电作用力,吸附和脱附时间短,提取20 μL全血的实验过程共需40 min,从单位样品的提取时间可知,本研究构建的芯片提取DNA的速度与已报道的微流控提取芯片相比,速度较快,在微流控芯片中由于反应体系微量化,很多反应需在液体流动过程中进行,因此反应速度快的体系在实际应用中具有更好的优势。
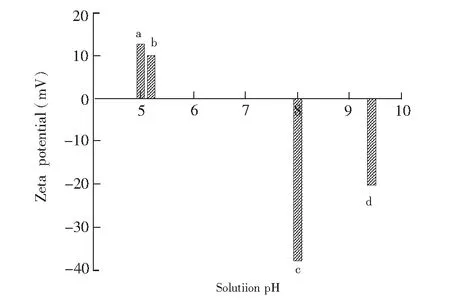
图4 磁珠在不同溶液中的Zeta电位 a,淋洗液; b,样品吸附溶液; c,洗脱液; d,样品对照液Fig.4 Zeta potential of magnetic beads in different solutionsa, Eluent; b, sample adsorption solution; c, desorption solution; d, control sample solution
3.2 芯片的设计
采用PMMA片制作三层式芯片,在激光刻蚀后清洗干净,通过热压键合机快速键合,相比硅片芯片,操作环节简便易操作,且对实验环境和仪器条件要求低; 同时避免了硅羟基对磁珠的共价键合作用。
芯片为三层结构,在中间一层的穿孔相当于芯片的双堰结构,主要是为使液流在此形成涡流,达到搅拌溶液的作用,从而使溶液中的DNA更充分接触磁珠。同时缓冲从1处(图2)流过来的液流,防止磁珠堆积。磁珠通过磁铁固定在提取区域设计成宽扁结构(宽约500 μm,深约200 μm),扁平结构可使磁珠平铺分散在分离通道中,有利于DNA分子与磁珠接触。宽度过大易导致磁珠分布不均,因此选择比其它通道(300 μm)略宽作为扁平分离通道的宽度。
3.3 磁珠芯片的DNA提取
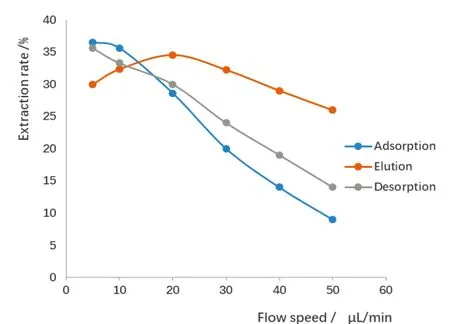
图5 吸附、淋洗和解吸流速对DNA提取率的影响Fig.5 Effect of adsorption, elution and desorption flow rate on DNA extraction rate
3.3.1DNA提取条件的选择和优化在磁珠芯片中,各溶液分阶段持续流经萃取区域,与磁珠进行充分接触,从而实现溶液中的DNA分子与磁珠吸附与解吸附。Cady等[7]在芯片外的磁珠实验中已经对提取过程的磁珠的饱和用量和各溶液组成及其pH进行了探讨,本研究芯片上提取DNA基于芯片外实验研究的基础,选择磁珠用量为20 μL磁珠悬浊液(4 μg/μL),在室温(20℃)下进行。由于流速直接决定了DNA分子与磁珠的吸附和解吸附时间,从而影响提取效率,吸附和解吸过程中,流速越低,萃取效率越高,因此,重点进行了芯片流速的优化。由图5可知,吸附过程中,流速越大,DNA提取率越低,主要是因为流速大,DNA分子与磁珠表面未充分结合就被液流带出磁珠固定区域而使提取得率降低,5 μL/min与10 μL/min的流速时,提取效率接近,为了节省反应时间,选择10 μL/min作为吸附过程的流速。在洗脱过程中,流速越大,提取效率也越低,主要原因是流速太大,使得磁珠的表面电性转变时间不够,而导致DNA分子未能及时地从磁珠表面解吸,而使提取得率降低。由于洗脱液体积较少对实验时间影响较小,因此选择5 μL/min作为洗脱液的流速。在淋洗过程中,流速在20 μL/min时,提取效率较高,因此选择20 μL/min作为淋洗液的流速。
3.3.2全血中DNA的提取效率将磁珠芯片用于人全血中DNA的提取,运用NanoDrop-1000分光光度计分析DNA的浓度与纯度,每次实验结束后排除磁珠,清洗后的芯片可重复使用,表3为5次重复实验得到的结果,通过C=50×A260换算求得洗脱液的DNA浓度, 计算洗提液 (20 μL)中的DNA总量,除以理论总量即可得提取率。成人新鲜血液中DNA含量约为30~60 ng/μL[9],限于实验条件,假设实验用血的DNA浓度为最高含量60 ng/μL,则20 μL全血中的DNA约为1.2 μg,最终求算DNA的平均提取率为34.7%。DNA纯度以A260/A280值为参照,提取的DNA溶液的A260/A280平均值为1.74(表3),所得DNA纯度较高[21,22]。
表3 人全血中基因组DNA提取实验结果
Table 3 Parallel experimental results of genomic DNA extracted from human whole blood
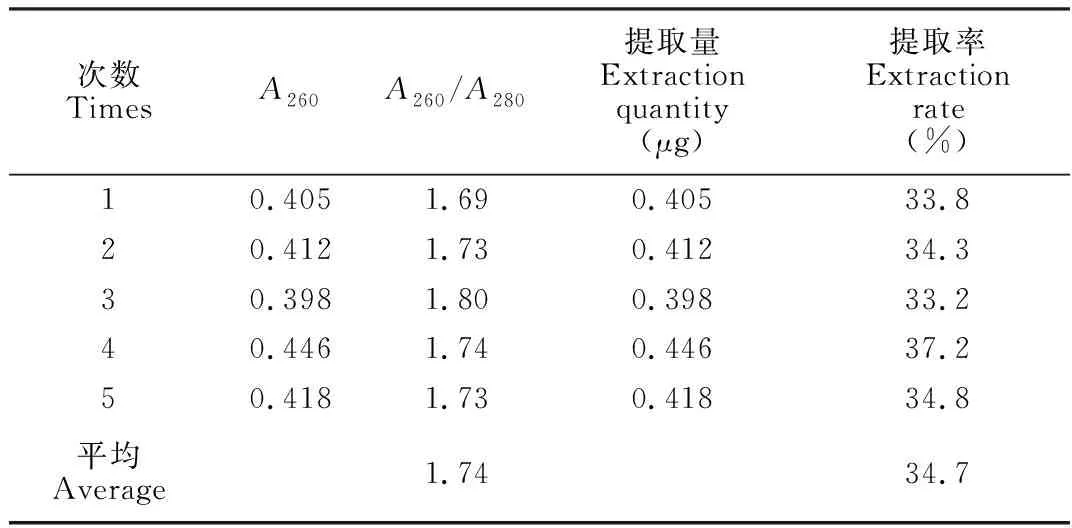
次数TimesA260A260/A280提取量Extractionquantity(μg)提取率Extractionrate(%)10.4051.690.40533.820.4121.730.41234.330.3981.800.39833.240.4461.740.44637.250.4181.730.41834.8平均Average1.7434.7
芯片上DNA平均提取率为34.7%,与Zhang等[17]报道的磁珠芯片用于λ-DNA提取率(50%)相比,提取效率略低。这是由于提取的目标DNA不同,并且本研究的提取芯片提取的DNA总量较大,导致提取效率降低。芯片上的全血中基因组DNA提取率比芯片外磁珠直接提取操作(提取率约70%)低[19],推测因为在芯片中磁珠必须通过磁铁固定在通道中,无法完全充分分散,与芯片外的提取过程中吸打混匀相比,磁珠与DNA分子接触吸附的几率更低。由于DNA分子是在溶液流动过程中与磁珠接触并发生静电作用,因此与芯片外的静止接触相比,DNA分子更难以吸附到磁珠表面。洗提液的纯度与磁珠的芯片外实验[19](A260/A280≈1.81)相比也有所下降,主要因为在芯片外提取实验过程中,通过移液枪吸打淋洗溶液,物理吸附在磁珠表面和DNA分子表面的蛋白质由于吸打的外力而脱离磁珠,使得提取液中蛋白质含量更低,DNA纯度较高; 在芯片中实验过程中,淋洗时磁珠通过磁铁固定平铺在通道中,通过物理吸附磁珠和DNA分子表面的部分蛋白质,在淋洗环节中,由于液流冲力较磁珠外实验吸打操作的外力小,蛋白质较难从磁珠和DNA分子表面脱落,从而使得提取液中蛋白质含量较芯片外实验高,DNA纯度有所下降。为验证提取的DNA无损伤或纯度是否能满足进一步的PCR分析,进一步对提取液的DNA进行凝胶电泳和PCR实验。
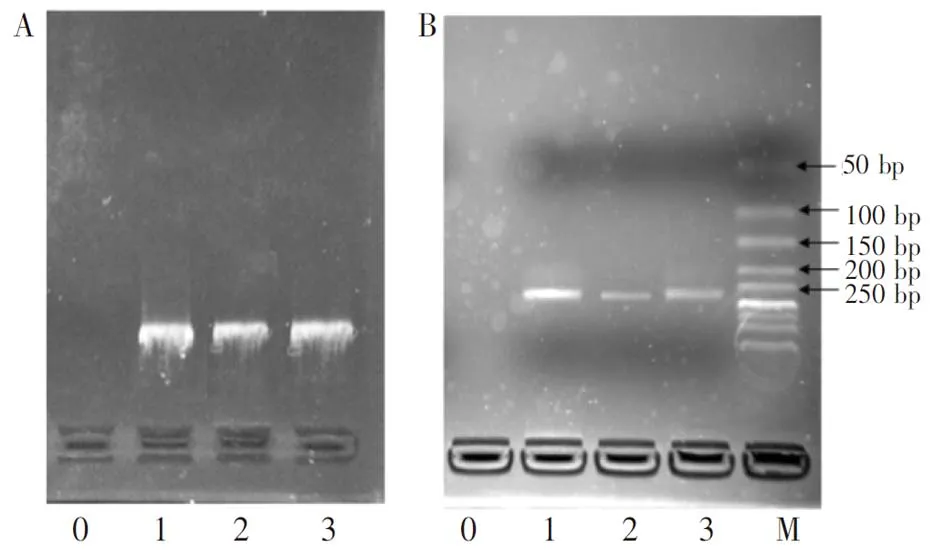
图6 提取液(A)及其PCR产物(B)的凝胶电泳图0. 空白; 1. 商品化DNA kit提取的基因组DNA; 2. 磁珠芯片提取的DNA; 3. 自制磁珠在芯片外提取的DNA; 4. DNA markerFig.6 Gelelectrophoretograms of (A) eluent and (B) PCR products0. Blank;1. Genomic DNA by commercially DNA kit; 2.Eluent by magnetic beads in chip; 3. Eluent by magnetic beads out of chip; M. 50bp marker
3.3.3磁珠芯片提取DNA的凝胶电泳与PCR扩增图6为洗提液的凝胶电泳图(图6A)与PCR产物电泳图(图6B)。图6A中的0、1、2、3分别为空白、商品化基因组DNA提取试剂盒提取液、自制磁珠芯片提取液、自制磁珠芯片外提取液的电泳条带。凝胶电泳结果表明,DNA提取试剂盒提取液、自制磁珠芯片提取液、自制磁珠芯片外提取液的电泳条带基本一致,表明磁珠芯片成功地实现了从全血中提取获得基因组DNA,过程中未发生损伤。提取液的PCR实验结果显示,磁珠芯片洗提液的PCR产物与其它两个PCR产物一致。上述结果表明,本研究制备的的基于表面电性可控的磁珠技术的DNA提取芯片可用于提取全血中的基因组DNA,提取液可直接用于进一步的PCR反应。
4 结 论
芯片上的DNA提取对微全分析具有重要作用。本研究将自制的表面电性可控的磁珠应用于PMMA提取芯片中,磁珠借助外磁场固定于微通道中,利用此芯片成功实现了人全血中基因组DNA的无损提取,洗提液可直接用于进一步PCR反应。此磁珠芯片制作简单,操作方便,自动化程度较高,便于与PCR芯片连接,实现从样品到检测结果的微全分析。

