终末期肝病合并感染诊治专家共识
中华医学会感染病学分会
终末期肝病(end stage of liver disease, ESLD)于 20 世纪 80 年代提出,至今仍无严格定义[1,2]。结合肝脏形态和功能,ESLD 指各种慢性肝脏损害所致的肝病晚期阶段,主要特征为肝脏功能不能满足人体的生理需求。其范畴包括各种慢性肝病的终末期阶段,主要表现为肝功能严重受损和失代偿,包括慢加急性肝功能衰竭(acute-on-chronic liver failure, ACLF)、肝硬化急性失代偿(acute decompensation of liver cirrhosis, ADC)、 慢性肝功能衰竭(chronic liver failure, CLF)和晚期肝细胞癌[3,4]。感染可以诱发或加重 ESLD,也是ESLD 最常见的并发症之一,临床诊治棘手[5]。迄今为止,国内外尚无针对 ESLD 合并感染性疾病的诊治指南、行业标准或专家共识。中华医学会感染病分会联合我国相关领域知名专家共同撰写本共识,旨在指导并提高临床医务工作者对 ESLD合并感染疾病的综合诊治能力。
一、终末期肝病合并感染的流行病学
ESLD合并感染的类型包括腹腔感染、呼吸道感染、胆道感染、泌尿道感染、血流感染、胃肠道感染以及皮肤软组织感染等,局部感染均可发展为血流感染[6,7]。ESLD合并感染以自发性细菌性腹膜炎(spontaneous bacteria peritonitis, SBP)最多见,肺部感染次之[8]。
ESLD合并感染的常见病原体为大肠埃希菌(25.9%~27.4%)、葡萄球菌(22%~23.4%)、肺炎克雷伯菌(12.5%~13.7%)、肠球菌(16.6%~23.9%)、厌氧菌(6.2%~7.8%)以及念珠菌(研究间差异较大)等。腹腔感染的常见病原体为大肠埃希菌,其次为肺炎克雷伯菌,金黄色葡萄球菌、屎肠球菌、粪肠球菌[9,10]。呼吸道感染的病原体以条件致病菌多见,铜绿假单胞 菌、金黄色葡萄球菌、念珠菌、曲菌多见[11,12]。
因 ESLD 患者经常使用抗菌药物,发生院内感染的耐药率相对较高,特别是耐碳青霉烯类的肺炎克雷伯菌和鲍曼不动杆菌[13,14]。
推荐意见:
1.1 建议有条件的医疗机构建立院内病原体监测体系,明确本医疗机构的优势病原株和耐药情况,指导经验性抗菌治疗药物的选择。
二、终末期肝病合并感染的发病机制
ESLD 病理生理特点为肝脏功能明显减退、肝脏微循环障碍、肝脏局部以及全身性炎症反应、免疫麻痹及紊乱和肠道微生态失衡,这些均为感染的危险因素。全身炎症反应(systemic inflammatory response syndrome, SIRS)、代偿性抗炎症反应综 合 征(compensated anti-inflammatory response syndrome, CARS)和混合性拮抗反应综合征(mixed antagonist response syndrome, MARS)在 ESLD 合并感染的发生发展中发挥关键作用。ESLD 相关的级联炎性细胞因子风暴,如白介素 6(interleukin, IL-6)、IL-10、 IL-8、IL-1α、肿瘤坏死因子 α(tumor necrosis factor α, TNFα)、纤维介素样蛋白 2(fibrinogen-like protein 2, Fgl2)、单核细胞趋 化蛋 白 1(monocyte chemotactic protein, MCP-1)、干扰素 γ(interferon γ, IFNγ)促进了感染发生[15-18]。
推荐意见:
2.1 监测 ESLD 患者 SIRS、CARS 和 MARS 的病理生理状态,有助于预判感染的发生和消失。
三、终末期肝病合并感染的临床表现
(一)终末期肝病合并腹腔感染
SBP 是 ESLD 合并感染最常见的腹腔感染类型。常起病隐匿,无症状或症状轻,最常见的症状是腹胀和发热。患者常因大量腹水而无明显的腹部压痛、反跳痛[19,20]。真菌性腹膜炎临床表现与细菌性腹膜炎相近似,多见于免疫力低下或长期使用广谱抗菌药物及糖皮质激素的患者[21,22]。结核性腹膜炎的特征性表现为腹壁柔韧感,合并腹水的临床表现可不典型,多经腹水培养才得以诊断[23-25]。
(二)终末期肝病合并呼吸道感染
患者起病可急可缓,呼吸道细菌感染以发热、咳嗽、咳痰为主要表现。肺部真菌感染具有支气管肺炎的各种症状和体征,但起病隐匿,多在应用抗菌药物治疗中出现或加剧,可有发热、咳嗽、胶冻样痰液,肺曲霉菌感染常出现血痰[26-28]。
(三)终末期肝病合并胆道感染
胆道感染是 ESLD 合并感染的另一类常见感染类型。临床表现常不典型,易漏诊,不易得到细菌学证实。患者多表现为中上腹或右上腹隐痛,或伴发热、恶心、呕吐、嗳气、反酸及腹胀等症状[29,30]。
(四)终末期肝病合并胃肠道感染
ESLD 合并胃肠道感染临床表现多样、病情轻重不一,而且致病病原体种类繁多,主要表现为腹泻、腹痛等,或仅表现为水样便或大便次数增多[27,31,32]。
(五)终末期肝病合并泌尿道感染
ESLD 合并上尿路感染者常有发热、寒战等全身症状,可伴腰痛、肾区叩击痛、输尿管点压痛。下尿路感染者常有尿频、尿急、尿痛、排尿不适等尿路刺激症状。尿液性质常会有改变,如浑浊、有异味、肉眼血尿等[26-28,33]。
(六)终末期肝病合并血流感染(含导管相关性感染)
根据血培养阳性的病原体是否与其他部位感染病原体相关分为原发性和继发性血流感染。继发性血流感染最常见的来源有肺部感染、泌尿道感染、腹腔感染、皮肤软组织感染等。导管相关性血流感染是 ESLD 患者常见的原发性血流感染,血管内导管留置超过 72 小时而出现血流感染,应考虑导管是否为感染的来源。发热、寒战是血流感染最常见的临床表现[34-37]。
(七)终末期肝病合并皮肤软组织等其他感染
ESLD 合并皮肤软组织感染发生不常见,以局部红肿、皮肤破损和压疮表现为主[27,38]。
ESLD 合并颅内感染较为少见,有合并细菌性脑膜炎的报道,临床表现为发热、头痛、呕吐及意识障碍,部分患者出现偏瘫、失语等脑实质损害表现[39-41]。
ESLD 合并胫腓骨骨膜炎少见,临床表现为局部疼痛、患处肿胀及压痛明显[42]。
ESLD 合并感染性心内膜炎,致病菌与普通感染性心内膜炎者不同,起病隐匿,可有低热、乏力、食欲减退、体重减轻等非特异性全身症状,听诊常可闻及心脏杂音[43,44]。
ESLD 合并眼内炎,临床表现为眼痛、畏光、流泪、视物模糊、结膜充血,可出现视力明显下降,眼房内出现片状或块状漂浮物[45,46]。
推荐意见:
3.1 ESLD 合并各部位感染的临床表现常不典型,须仔细问诊和体格检查,进行早期诊断。
四、ESLD 合并感染的诊断
1.高危因素评估:免疫功能障碍、遗传易感因素、肠道细菌异位以及医源性因素[8]。
2.症状与体征:参照临床表现部分。
3.实验室检查:外周血白细胞计数与分类、降钙素原(procalcitonin, PCT)、C 反应蛋白(c-reactive protein, CRP)、γ 干扰素释放试验(interferon gamma release assay, IGRA)、G试验、GM试验、胸腹水常规检查[5,11,48,49]。细胞因子水平如 IL-6、TNF-α 有望应用于 ESLD 合并感染的诊断[8,47]。
4.影像学检查:超声检查、X 线平片、电子计算机体层扫描、磁共振成像是临床上最为常用的辅助影像学诊断手段。
5.病原微生物检测、培养与鉴定:分泌物、体液(胸水、腹水、关节液)、血液、骨髓或组织培养到病原体是确诊 ESLD 合并感染的依据。腹水细菌培养阳性对 ESLD 合并 SBP 具有确诊意义,但普通腹水培养阳性率低,建议抗菌药物使用前进行,使用血培养瓶增菌, 同时送需氧及厌氧培养,接种腹水至少 10 ml。腹水量>10 ml,离心后可提高培养率。腹水培养阴性的中性粒细胞性腹水是 SBP 的一种变异形式。二代测序方法从组织、拭子、抽吸物中提取 DNA 进行分析,可筛查鉴别多种细菌,快速获取病原学诊断。
推荐意见:
4.1 ESLD合并感染的诊断需综合评估高危因素、症状和体征、实验室检查、影像学检查以及病原学检测做出诊断,及时送检各种组织、体液、血液等标本是诊断的重点。
五、ESLD 合并感染的治疗
(一)基础支持治疗
1.营养支持治疗:(1)营养风险筛查:推荐NRS-2002 等营养筛查工具[50,51]。(2)营养评定:推荐人体组成检查、成像技术检查、握力检查等[52,53]。(3)营养干预:根据营养风 险筛查和营养评定结果,对不能主动进食的患者推荐入院后 24~48 h 开始肠内营养。对于经口摄入不能达到目标能量或营养素摄入不够全面时,建议给予口服营养补充剂或管饲肠内营养[54,55]。肠内营养无法接受或达不到目标量60%时,给予补充性肠外营养[56]。饮食摄入模式为少量多餐,每日 4~6 餐,鼓励睡前加餐(late evening snake, LES),LES 应以富含碳水化合物食物为主[57]。ESLD 合并感染患者的能量供应量按 25~35 kcal/kg/d 计算,蛋白质或氨基酸的供给量建议为 1.2~1.5 g/kg/d,肝性脑病患者蛋白质的摄入量为 0.5~1.2 g/kg/d,肝性脑病纠正后可从 0.5 g/kg/d 开始逐渐增加蛋白质摄入量,推荐增加口服支链氨基酸供给[58,59]。预防和治疗低血糖对于终末期肝病患者十分重要,临床上明显的维生素不足需要特别治疗[60]。
2.抗炎保肝治疗:抗炎保肝药物包括抗炎类药物(甘草酸类制剂)、肝细胞膜修复保护剂(多烯磷脂酰胆碱)、解毒类药物(谷胱甘肽、N-乙酰半胱氨酸)、抗氧化类药物(水飞蓟素)、利胆类药物(S-腺苷蛋氨酸、熊去氧胆酸)。可选用 1~2 种机制不同药物联用[61-64]。
3.免疫调节治疗:(1)白蛋白能有效提高肝硬化合并 SBP 患者生存率,但不能改善肝硬化合并其他部位细菌感染患者生存率[65,66]。(2)丙种球蛋白可迅速提高血清中 IgG 水平,从而中和细菌内毒素、外毒素,增加抗炎介质、增强机体抗感染能力[66]。(3)胸腺肽 α1 单独或联合乌司他丁治疗脓毒症患者可能有助于降低 28 天病死率。胸腺肽 α1 用于慢加急性肝衰竭、慢性肝衰竭、肝硬化合并自发性腹膜炎患者,有助于降低病死率、降低继发感染发生率[67-69]。(4)粒细胞巨噬细胞集落刺激因子虽然不能明显改善脓毒症患者的预后,但可增强病灶清除率、降低继发感染发生率[70,71]。(5)粒细胞集落刺激因子:可提高肝衰竭患者的短期生存率[72,73]。(6)糖皮质激素。ESLD 合并感染的糖皮质激素治疗尚无定论,需权衡利弊,谨慎使用[72,73]。
4.病因治疗:对于乙型肝炎相关的 ESLD,推荐在内科综合治疗中,及早给予强效、低耐药的核苷(酸)类似物抗病毒治疗,可迅速降低 HBV DNA 载量,缓解免疫损伤,减轻肝脏炎症反应,降低病死率[74,75]。HCV 相关的 ESLD 患者,如需要直接抗病毒药物治疗,应权衡肝肾功能状况和药物之间相互作用选择合适的直接抗病毒药物(direct antiviral agent, DAA)治疗方案[76]。对于酒精性肝病相关的 ESLD,尽早戒酒,可给予美他多辛治疗[77]。
推荐意见:
5.1 营养支持治疗和抗炎保肝治疗可降低ESLD患者发生感染的风险,促进感染的消除。
5.2 ESLD合并感染患者可酌情使用白蛋白、丙种球蛋白、胸腺肽 α1。
5.3 ESLD合并重症感染患者使用糖皮质激素需权衡利弊,谨慎使用。
5.4 HBV相关的 ESLD患者,无论 HBV DNA 水平高低,均应尽早开始抗病毒治疗,建议选择恩替卡韦或替诺福韦,使用替诺福韦需密切关注患者肾功能改变。HCV相关的 ESLD患者,应根据肝肾功能状况以及合并用药的药物之间相互作用选择 DAA治疗方案。
(二)抗感染治疗
在未获知病原菌及药敏试验结果前,可根据患者的感染部位、发病情况、病原体来源(医院感染或社区感染)、既往抗菌药物用药史及其治疗反应等推测可能的病原体,并结合当地细菌耐药性监测数据,给予抗菌药物经验性治疗。经验性抗感染治疗过程中,需复查炎症因子、腹水实验室检测等指标,评估抗感染治疗疗效,调整抗菌治疗方案或评估诊断。获得病原学依据后,尽快将经验性抗感染治疗转化为目标性抗感染治疗。病原微生物培养结果阴性的患者,应根据经验治疗的效果和患者病情进展情况,采取进一步检测明确病原体或调整经验性抗感染治疗方案。
1. 终末期肝病合并腹腔感染

表1 ESLD 合并腹腔感染的经验性抗感染治疗方案
(1)ESLD 合并 SBP:诊断 SBP 后应积极消除腹水治疗(释放腹水、利尿、补充白蛋白),并开始经验性抗菌治疗。所选抗菌药物除了能覆盖常见 SBP 相关病原体(大肠埃希菌、肺炎克雷伯菌和肠球菌)外,其药代动力学特点优先满足腹腔感染的治疗要求(腹水抗菌药物浓度>致病微生物的 MIC90)[78-80]。ESLD 合并社区相关性SBP(coummunity-associated SBP, CA-SBP),可根据患者基础状况、既往是否反复感染及抗感染治疗、当地细菌耐药情况,可经验性选择 β-内酰胺/β-内酰胺酶复合制剂、头霉素类、氧头孢烯类覆盖产超广谱 β-内酰胺酶(extended-spectrum β-lactamases, ESBLs)菌株,重症患者可选择碳青霉烯类(美罗培南、比阿培南)[81-83]。ESLD 合并医疗机构相关性 SBP(healthcare-associated SBP, HA-SBP),抗感染治疗需覆盖产 ESBLs 菌株,且由于医院感染病原体中革兰阳性菌如肠球菌、葡萄球菌比例增高,必要时需联合万古霉素、利奈唑胺或替考拉宁。难治性腹膜炎可联合使用替加环素。
(2)ESLD合并自发性真菌性腹膜炎(spontaneous fungal peritonitis, SFP):发生率相对较低(0~13%),常见于长期应用广谱抗菌药物或免疫力低下的患者[84]。白念珠菌是最常见的病原体,其次是曲霉菌[21,85]。ESLD 合并 SFP 患者优先选择棘白菌素类药物,氟康唑、伏立康唑可作为治疗备选方案,但须根据患者 MELD 分级或 eGFR 水平决定是否需要减量使用[86]。
(3)ESLD合并结核性腹膜炎(tuberculous peritonitis, TBP):ESLD 患者慎用抗结核药物,可酌情选择肝功能损伤小的方案行抗结核治疗并进行严密监测[87-89],建议参考 2003 年美国胸科协会推荐方案[90]。
推荐意见:
5.5 ESLD 合并腹腔感染的经验性抗感染治疗方案(表1)。
2. 终末期肝病合并呼吸道感染
肺部感染是 ESLD 患者最常见的呼吸道感染。在确立肺部感染临床诊断并安排合理的病原学检查后,需要根据患者的年龄、基础疾病、临床特点、实验室及影像学检查、疾病严重程度、肝肾功能、既往用药和药物敏感性情况分析最有可能的病原并评估耐药风险,选择恰当的抗感染药物和给药方案,及时实施初始经验性抗感染治疗,须区分社区获得性肺炎(community-acquired pneumonia, CAP)和医院获得性肺炎(hospitalacquired pneumonia, HAP)[80,91]。
ESLD 合并 CAP 推荐使用:(1)青霉素类/酶抑制剂复合物;(2)第三代头孢菌素或其酶抑制剂复合物、头霉素类;(3)喹诺酮类[8,79]。
ESLD 合并轻、中症 HAP[92]:一般状态较好,早发性发病(入院≤5 d)、机械通气≤4 d),无高危因素,生命体征稳定,器官功能无明显异常者,常见病原体为肠杆菌科细菌、流感嗜血杆菌、肺炎链球菌、甲氧西林敏感金黄色葡萄球菌(MSSA)。抗菌药物可选择:第三代头孢菌素(不必包括具有抗假单孢菌活性)、β内酰胺类/β 内酰胺酶抑制剂;青霉素过敏者选用氟喹诺酮类。
ESLD 合并重症 HAP[92]。符合下列 1 项主要标准或≥3 项次要标准者可诊断为重症肺炎。主要标准:(1)需要气管插管行机械通气治疗;(2)脓毒症休克经积极液体复苏后仍需要血管活性药物治疗。次要标准:(1)呼吸频率≥30 次/min;(2)氧合指数≤250 mmHg(1 mmHg=0.133 kPa);(3)多肺叶浸润;(4)意识障碍和(或)定向障碍;(5)血尿素氮≥7.14 mmol/L;(6)收缩压<90 mmHg 需要积极的液体复苏。晚发性发病(入院>5 d、机械通气>4 d)和存在高危因素者,即使不完全符合重症肺炎规定标准,亦视为重症。重症 HAP 的常见病原体为铜绿假单胞菌、耐甲氧西林金黄色葡萄球菌(MRSA)、不动杆菌、肠杆菌属细菌、厌氧菌。抗菌药物可选择喹诺酮类或氨基糖苷类联合下列药物之一:抗假单胞菌 β 内酰胺类如头孢他啶、头孢哌酮、哌拉西林、替卡西林、美洛西林等;广谱 β 内酰胺类/β 内酰胺酶抑制剂(替卡西林/克拉维酸、头孢哌酮/舒巴坦钠、哌拉西林/他唑巴坦);碳青霉烯类(如亚胺培南、美罗培南、比阿培南);必要时联合糖肽类或利奈唑胺(针对 MRSA)。真菌感染可能性大时应选用有效抗真菌药物[93]。
推荐意见:
5.6 ESLD 合并肺部感染的经验性抗感染治疗方案(表2)。

表2 ESLD 合并肺部感染的经验性抗感染治疗方案
3. 终末期肝病合并胆道感染
ESLD合并胆道感染诊治的主要原则有:(1)建议尽可能早期规范的胆汁培养及药敏试验,确定病原菌;(2)及时进行经验性抗感染治疗;(3)根据感染的严重程度选用抗菌药物;(4)药物在胆汁内有足够的浓度以杀灭感染菌群;(5)避免对肝肾功能造成较大损害;(6)必要时进行抗感染联合用药。
目前 ESLD 的胆汁培养数据较少,我国多项非ESLD 研究数据提示革兰阴性菌占 70%~75%,前三位依次是大肠埃希菌、肺炎克雷伯菌及铜绿假单胞菌,革兰阳性菌有明显上升趋势,以屎肠球菌和粪肠球菌为主)[92,94,95]。经验性抗感染治疗应以革兰阴性菌为主,兼顾革兰阳性球菌和厌氧菌。如果病情较轻,推荐哌拉西林、哌拉西林/他唑巴坦、头孢哌酮/舒巴坦,也可选用第二、三代头孢菌素、氨苄西林和氨基糖苷类等药物,可加用甲硝唑或替硝唑。如治疗 3~5 d 后临床症状改善不明显,应考虑合并有革兰阳性菌感染,可换用或联合使用对革兰阳性菌敏感度的抗菌药物,如万古霉素、替考拉宁等。胆道严重感染患者推荐碳青霉烯类(美罗培南、比阿培南)、万古霉素、替考拉宁等抗菌药物。胆道感染部位局部清除和引流十分重要,必要时可考虑外科及时干预[96-98]。
推荐意见:
5.7 ESLD 合并胆道感染的经验性抗感染治疗方案(表3)。

表3 ESLD 合并胆道感染的经验性抗感染治疗方案
4. 终末期肝病合并泌尿道感染
单纯性尿路感染的主要致病菌为大肠埃希菌,经验性抗感染治疗可选择呋喃妥因、复方新诺明、氟喹诺酮类、第三代头孢菌素和阿莫西林/克拉维酸[8]。复杂性尿路感染中大肠埃希菌感染比例下降,肠球菌比例升高。对于轻中度患者或初始经验治疗可选择氟喹诺酮类、第三代头孢菌素。对于重症患者或初始经验性治疗失败患者可选择氟喹诺酮类(如果未被用于初始治疗)、哌拉西林/他唑巴坦、第三代头孢/酶抑制剂、碳青霉烯类(亚胺培南、美罗培南、比阿培南),必要时联合糖肽类[8,99,100]。近年来,泌尿道真菌感染所致脓毒血症的比例逐渐上升,可在上述基础上联合采用抗真菌治疗方案[101,102]。
推荐意见:
5.8 ESLD 合并泌尿道感染的经验性抗感染治疗方案(表4)。

表4 ESLD 合并泌尿道感染的经验性抗感染治疗方案
5. 终末期肝病合并血流感染
血流感染病情危急,一旦临床疑似诊断确立,尽早开始经验性抗菌治疗。继发性血流感染的经验性抗感染治疗方案须评估患者原发病灶、免疫功能状况、病原体来源及其他流行病学资料,综合考虑其可能的病原菌,抗菌药物可单用或联合使用[37,103]。疗程需至体温恢复正常后7-10 天,有迁徙病灶者需延长疗程,直至病灶消失,必要时需配合外科引流或清创等措施。对于导管相关性血流感染,须积极进行导管相关病原体培养检测,尽早去除导管,根据导管所在部位确定经验性抗感染治疗方案[35,36,104]。
推荐意见:
5.9 ESLD合并血流感染须区分继发性血流感染和原发性血流感染。继发性血流感染须评估感染原发病灶,给予经验性抗感染治疗。导管相关性血流感染,须尽快去除导管,根据导管存在部位确定经验性抗感染治疗方案。
6. 终末期肝病合并皮肤软组织感染
ESLD 合并皮肤软组织感染常见病原菌为:金黄色葡萄球菌、化脓性链球菌、铜绿假单胞菌、肠杆菌科、厌氧菌等[105,106]。对于感染程度较轻的患者,仅需要外用抗菌药物,可选择外用抗菌药物莫匹罗星软膏。此外,夫西地酸乳膏也有较强抗菌作用。大多数浅表皮肤感染疗程 7~10 d。蜂窝织炎等深部软组织感染,多由金黄色葡萄球菌或化脓性链球菌引起,可选择使用头孢唑林静脉用药,如为 MRSA 应选择万古霉素、利奈唑胺、达托霉素、替考拉宁等[8,107,108]。
推荐意见:
5.10 ESLD合并皮肤软组织感染的经验性抗感染治疗方案(表5)。

表5 ESLD 合并皮肤软组织感染的经验性抗感染治疗方案
7. 终末期肝病合并胃肠道感染
ESLD 患者合并胃肠道感染需根据患者自身的具体情况来制定个体化的治疗方案,必要时联合使用抗菌药物。经验性治疗选用广谱抗菌药物,一般首选针对革兰阴性菌药物,严重感染者联合应用抗菌药,同时注意革兰阳性菌感染[109-113]。
推荐意见:
5.11 ESLD 合并胃肠道感染的经验性抗感染治疗方案(表6)。

表6 ESLD 合并胃肠道感染的经验性抗感染治疗方案
8. 终末期肝病合并感染抗菌药物的使用及应用原则
ESLD 患者抗菌药物的选用需要注意药物的肝脏损害。抗菌药物导致的肝脏损害既有剂量相关型,也有剂量无关型,既可能导致肝细胞损害,也可能造成胆汁淤积。ESLD 患者所存在的病理生理状态,也是药物选择所需要关注的内容(如肝病患者出血倾向),须重点关注各类抗菌药物对肝脏的不良反应[114-117]。
(1)β-内酰胺类抗菌药物:绝大多数 β-内酰胺类药物安全性高,主要经肾脏或肝肾双重排泄,ESLD 时大多可按正常剂量使用,肾功能不全者则需要调整剂量。青霉素类中阿莫西林/克拉维酸、耐酶青霉素(包括苯唑西林、氟氯西林等)、美洛西林、 磺苄西林、羧苄西林等可能导致转氨酶增高或胆汁郁积。头孢菌素大多安全性良好,可按照常规剂量使用。对出血倾向明显患者,尽量避免使用结构中含有四氮唑环结构药物,以减少患者出血危险,如头孢哌酮、头霉素(头孢美唑、头孢米诺)、氧头孢烯类(拉氧头孢、氟氧头孢)等。碳青霉烯类药物(亚胺培南、美罗培南、比阿培南)大多通过肾脏排泄,对肝脏安全性好,可按正常剂量使用。
(2)喹诺酮类药物:具有肝肾双重排泄特点,ESLD 患者一般可按正常剂量使用。喹诺酮类导致转氨酶升高和胆汁淤积,部分药物须避免使用,如氟罗沙星、依诺沙星、洛美沙星、加替沙星等。
(3)氨基糖苷类药物:氨基糖苷类药物主要经肾脏排泄,ESLD 患者可按正常剂量使用,但 ESLD 患者具有容易发生肾脏损害的危险因素,应用氨基糖苷类药物也需加以注意。
(4)大环内酯类药物:大环内酯类药物大多需要经过肝脏代谢,具有一定肝脏毒性,尤其是红霉素酯化物可以导致肝脏胆汁淤积,阿奇霉素、克拉霉素以外的本类药物应避免使用。
(5)四环素类药物:四环素类药物可导致肝脏脂肪变或胆汁淤积,一般应避免使用。多西环素和米诺环素的肝毒性较低,可酌情使用。替加环素在Child-Pugh C 患者需减量使用。
(6)抗结核药物:异烟肼、利福霉素类、吡嗪酰胺等抗结核药物肝脏毒性明显,ESLD 患者要谨慎应用。
(7)其他抗菌药物:克林霉素和林可霉素需要在肝脏代谢,且具有一定肝脏毒性, ESLD 患者慎用。硝基咪唑类(甲硝唑、奥硝唑等)大多在肝脏代谢且具有一定肝毒性,临床应用需要调整剂量。磺胺类大多具有肝毒性,ESLD 患者需避免使用。万古霉素虽然以肾脏排泄为主,但研究发现肝硬化患者药物浓度明显增加,建议临床用药时注意监测血药浓度。利奈唑胺可导致肝脏损害,长疗程者可能导致血小板减少和乳酸酸中毒,需谨慎使用。
推荐意见:
终末期肝病合并感染抗菌药物的比较使用及应用原则
5.12 对于 ESLD 患者,β-内酰胺类(青霉素类、大部分头孢菌素、碳青霉烯类)、氨基糖苷类、部分喹诺酮类(左氧氟沙星、环丙沙星)、糖肽类抗菌药物对肝脏损伤小,宜优先选用。
9. 终末期肝病合并侵袭性真菌感染及药物选择
目前临床用于 ESLD 患者的抗真菌药物主要有三类[118]:(1)多烯类。包括两性霉素 B 及其衍生物,对各种酵母菌和曲霉菌的疗效确切。因其有一定的肝毒性,对于 ESLD 患者须慎用。(2)三唑类。包括氟康唑、伊曲康唑、伏立康唑和泊沙康唑等,部分在肝脏代谢,ESLD 患者使用时,多选择肝毒性相对较小的伏立康唑,根据肝功能情况调整药物剂量,并密切监测肝功能。(3)棘白菌素类。主要包括卡泊芬净、米卡芬净和阿尼芬净等,对念珠菌属、曲霉菌属引起的深部真菌感染有广谱抗菌作用,对耐唑类药物的白念珠菌、光滑念珠菌、克柔念珠菌及其他念珠菌均有良好的抗菌活性。棘白菌素肝毒性小,轻度肝功能障碍时不需减量,中度肝功能障碍时需要减量,是ESLD 常用的抗真菌药物。推荐根据患者肝功能Child-Pugh 分级选用抗真菌药物和剂量调整[119]。
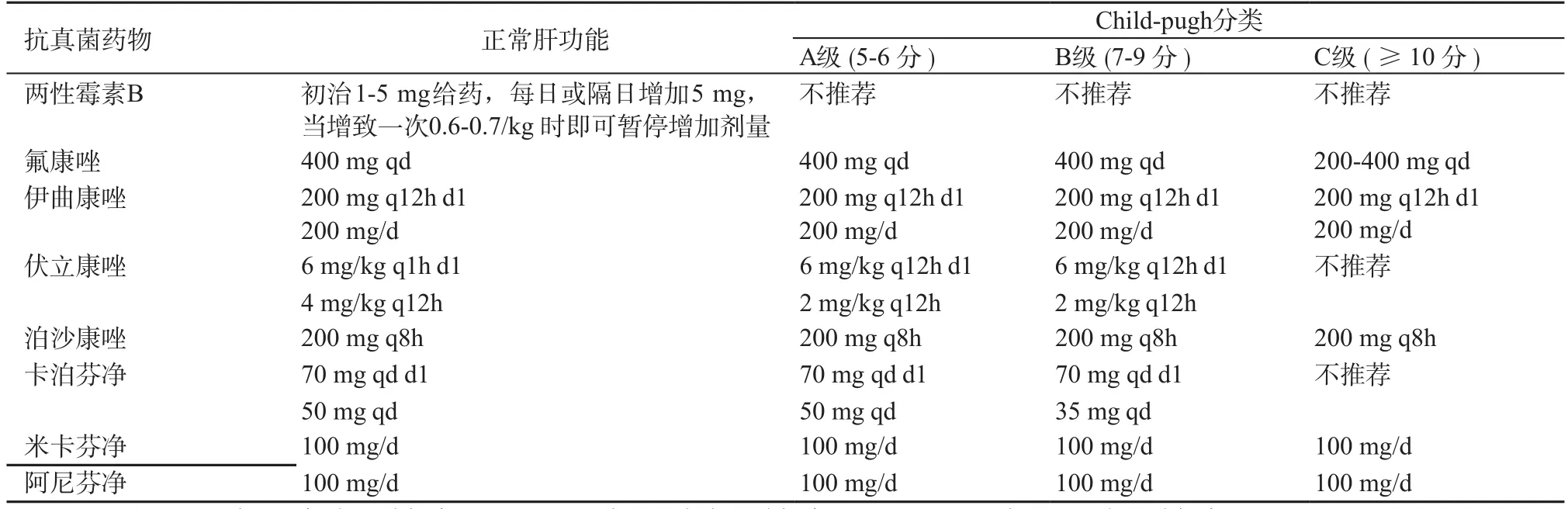
表7 常见抗真菌药物对于肝损伤患者的剂量调整
推荐意见:
终末期肝病合并侵袭性真菌感染
5.13 ESLD 抗真菌治疗应高度关注抗真菌药物的安全性,做到积极治疗,权衡利弊,慎重选择,密切监测。
5.14 棘白菌素类抗真菌药物对肝脏损伤小,对于敏感真菌应首先考虑使用。三唑类药物(氟康唑、伏立康唑等)应根据肝功能情况减量使用,并密切监测肝功能。两性霉素 B 类需谨慎使用。
(三)ESLD 合并感染的微生态治疗
ESLD 患者肝功能障碍与肠道微生态之间相互影响,形成恶性循环。肠道微生态紊乱,益生菌数量减少,肠道有害物质不能很好分解代谢以及氨类、酚类、内毒素等大量产生和吸收,从而加重肝脏解毒负荷,同时也促进肝衰竭的发展。肠道微生态治疗必须作为肝衰竭综合治疗的一个不可缺少的方面[120,121]。
肠道选择性脱污染治疗是用窄谱抗菌药物去除肠道革兰阴性杆菌及真菌,尽可能保护肠道专性厌氧菌,减少肠道革兰阴性杆菌过度繁殖,降低肠道内毒素水平,减少细菌异位,减少感染的发生率[122]。利福昔明是非吸收性广谱抗菌药物,可减少小肠细菌量,减少细菌易位,降低肝硬化感染发生率,甚至可以降低 SBP 风险率达 72%[123]。
乳酸杆菌对肠粘膜有保护作用,可以降低肠道 pH 值,阻止致病菌定植,调节肠道免疫,改善肠道功能。益生元、乳酸杆菌活菌制剂可显著降低肝硬化自发性腹膜炎发生率。 粪便细菌移植可显著改善肝衰竭患者生存率,降低腹腔感染的发生[124]。
推荐意见:
终末期肝病合并感染肠道微生态治疗
5.15 益生菌、合生元是 ESLD 合并感染的有效辅助治疗方法。
5.16 粪菌移植以及肠道选择性脱污染治疗可有效降低 SBP 发生风险。
(四)终末期肝病合并感染的血液净化治疗
ESLD 患者合并感染时,选用不同模式的血液净化(胆红素吸附、血浆置换、分子吸附再循环系统)可清除炎症介质和毒素,改善内环境,促进免疫重建,稳定血流动力学,改善肝功能,协同抗感染治疗。可在内科综合治疗的基础上,酌情选择血液净化治疗,如李氏人工肝等[125-127]。
推荐意见:
5.17 血液净化能够有效清除 ESLD 合并感染患者炎症介质和毒素,稳定内环境,促进免疫功能重建,酌情选择人工肝等血液净化系统治疗。
六、终末期肝病合并感染的预后
ESLD 合并感染的预后判断涉及肝脏疾病状态和感染的严重程度。肝病和感染严重程度,以及相关预测模型可用于 ESLD 合并感染的预后判断。推荐综合采用 CTP 评分、MELD 评分、同济预后预测模型(TPPM)、CLIF-SOFA评分以及 PCT联合 hs-CRP 评价 ESLD 合并感染的预后[128-134]。
七、终末期肝病合并感染的预防
ESLD 合并感染的预防措施包括[135-138]:(1)积极治疗原发病,改善肝脏功能。(2)强调支持治疗。加强营养支持,稳定内环境,维护肠道正常菌群,改善机体免疫状态。(3)重视早期诊断。ESLD 合并感染早期表现多不典型,仔细评价患者病情变化,及时留取标本送检病原体检查,力争做到早诊断、早治疗。(4)合理应用抗感染药物。严格掌握抗感染药物使用和停药的指征、剂量及疗程,应尽可能根据药敏结果或医院感染监控结果选用抗菌药物。预防性及联合应用抗菌药物应严格掌握适应证。预防性使用抗菌药物遵循足量、短程原则。 勿滥用激素等免疫抑制剂。(5)多环节控制医院感染的发生,如定期病房的消毒和空气通风、 加强医务人员手卫生、严格掌握侵袭性操作的指征、加强口腔护理等措施。
共识专家组名单(按姓氏笔画):于岩岩、王宇明、毛青、王明贵、王贵强、王福生、韦嘉、 宁琴、李太生、李兰娟、李军、吕晓菊、李家斌、李智伟、刘正印、张文宏、肖永红、陈佰义、张跃新、陈智、陈韬、孟庆华、宓余强、郑波、尚佳、俞云松、胡必杰、胡瑾华、侯金林、赵英仁、段钟平、赵彩彦、赵鸿、唐小平、唐红、贾继东、盛吉芳、黄建荣、彭劼、谢青、魏来
共识执笔兼编写秘书组长:陈韬
编写秘书组:陈韬、郭威、许东、倪明、马科、陈广
利益冲突:无。
编后语编辑部对所刊载内容未作编辑加工

