富马酸磷丙替诺福韦的相关专利分析
王晓晨 陆皞然
摘要:富马酸磷丙替诺福韦是一种新型核苷类逆转录酶抑制剂(NRTI),临床用于治疗慢性乙型肝炎。本文通过对富马酸磷丙替诺福韦的相关专利进行分析,为我国医药企业对于该药物的研究提供建议。
关键词:富马酸磷丙替诺福韦;专利;分析
中图分类号:R969.1 文献标识码:A 文章编号:1003-5168(2018)18-0052-03
Analysis of the Patent about Tenofovir Alafenamide Fumarate
WANG Xiaochen LU Haoran
Abstract:Tenofovir Alafenamide Fumarate is new NRTI. It is used to treat hepadnaviridae. This paper analyzed the patent about Tenofovir Alafenamide Fumarate, in order to make recommendations for pharmaceutical companies.
Key words:Tenofovir Alafenamide Fumarate;patent;analysis
1 概述
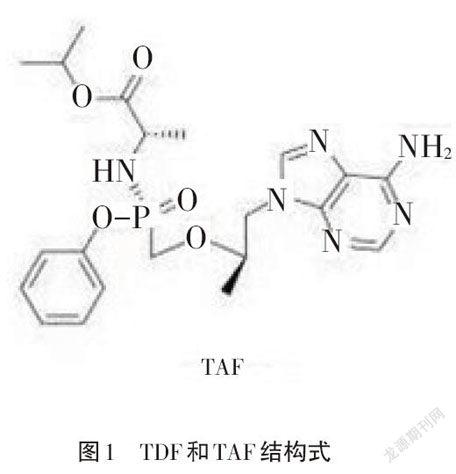
富马酸磷丙替诺福韦(Tenofovir Alafenamide Fumarate,TAF),是美国吉利德科学公司(Gilead Science)研制的新型核苷类逆转录酶抑制剂(NRTI),于2016年11月10日获得美国食品药品监督管理局(FDA)批准上市,商品名Vemlidy,用于慢性乙型肝炎患者的治疗,于2016年12月19日获得日本医药品医疗器械综合机构批准上市,又于2017年1月9日获得欧洲药物管理局批准[1]。
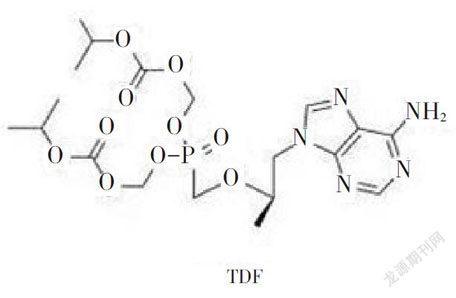
TAF是吉利德已上市药物Viread(替诺福韦酯,TDF)的升级改良版。TDF作为国外乙肝初始治疗首推药物,它的抗病毒效果非常强,而且具有8年零耐药的数据,是乙肝治疗“高效、低耐药”的理想药物,唯一的缺点是长期服用可能对肾脏和骨密度有影响。
相比之下,TAF在血浆中的稳定性更好。TAF在血浆中的半衰期为90min(TDF为0.4min),相比TDF更能有效地将TFV送达到肝细胞。且TAFⅢ期研究的96周疗效和安全性结果显示,TAF在保持较高病毒抑制率的情况下,没有发现耐药。在肝细胞中,TAF被分解成为有活性的代谢产物——二磷酸替诺福韦。要达到相同活性代谢产物浓度所需的给药剂量,TAF仅为TDF的约1/10(25mg/300mg),这使得TAF在血液系统中的暴露量减少了89%,并拥有更好的骨骼安全性和肾脏安全性。与原乙肝药物TDF相比,TAF能有效改善骨骼安全性系数,降低骨质疏松症风险,且对肾脏的危害更小。TAF被誉为“久违了十年之久的乙肝新药”“乙肝患者的新希望”。在欧洲肝脏研究学会(EASL)发布的《2017乙型肝炎管理指南》中,TAF被推荐为针对慢性乙肝患者的一线药品。
TDF和TAF结构式如图1所示。
2 专利申请情况分析
近年来,中国的企业和研究所针对该药物进行了一系列研究并申请了专利。本文以全球和中国范围内的专利申请数据为分析样本,对TAF相关专利申请进行统计分析,总结该领域的专利申请现状以及研究进展,以期为该领域相关研究人员提供参考。
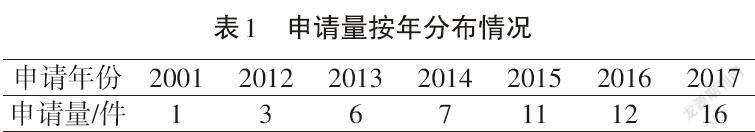
截至2018年4月,全球已公开的富马酸膦丙替诺福韦(TAF)相关专利共56件,申请量分布见表1、图2。
可以看出,最早的专利出现在2001年,经查,该专利是由美国吉利德公司通过PCT(专利合作协定)途径申请的Vemlidy的化合物专利,在全球范围进行了化合物的保护,其国际公开号为WO0208241A2。目前,该化合物专利在中国、欧洲、日本、美国等药品主流市场均获得授权,这一专利最早于2021年7月在中国、欧洲和日本到期,在美国的专利获得了291天的延长期,化合物的专利保护期延长到2022年5月。
在2012至2017年,关于TAF的专利申请出现了逐年上升的情况,其中,从专利申请的国别分类(见图3)。可以看出,关于TAF的申请以PCT申请方式为主,共占总量的70%以上,另外,中国的申请超过了20%,说明中国申请人在这一领域投入了科研力量。通过表2进一步对PCT申请进行分析,可见上述PCT申请中有13件进入中国。
可以看出,进入中国的PCT申请中,美国的吉利德公司申请量最多,另外,印度西普拉公司、加拿大的Replicor公司、美国的CHDI也有相关申请。进一步对上述13件专利的技术内容进行分析,在吉利德公司的9件专利中,有2件已授权,国际公开号分别是WO2002008241,WO2013052094,其中,专利WO2002008241 的国内授权号为CN1291994C,专利到期日为2021年7月20日,权利要求的保护范围涉及通式化合物、富马酸磷丙替诺福韦、组合物、用途;专利WO2013052094的国内授权号为CN103842366B,专利到期日为2032年10月3日,权利要求的保护范围涉及化合物的制备方法。由于上述化合物专利(CN1291994C)将于2021年7月到期,美国吉利德公司于2012年8月15日提交了PCT申请WO2013025788,国内公开号为CN103732594A,目前该申请处于合议组审查阶段,权利要求涉及富马酸磷丙替诺福韦化合物、晶体、组合物、制备方法、用途。吉利德公司进入中国的另外6件专利申请涉及组合物、用途,目前有1件处于视撤阶段,其余申请尚未结案。
印度西普拉公司、加拿大的Replicor公司、美国的CHDI,这3个申请人的申请的专利目前均没有授权,其中,印度西普拉公司(Cipla Limited, India)的2件专利,涉及组合物、用途,一件已经视撤失效,另一件尚未结案,而加拿大的Replicor公司、美国的CHDI的专利申请涉及组合物、用途,目前均未结案。
与国际申请相比,国内申请人从2014年开始对TAF进行专利申请,目前共有12件国内申请,来自11家不同的企业,技术内容涉及合成方法、晶体、新的盐、组合物、用途。其中,成都苑东药业有限公司的专利申请(CN105237571B)已授权,技术内容涉及新的盐(半琥珀酸盐、半酒石酸盐)及其制备方法,另外的11件国内申请中,2件驳回,9件尚未结案。国内的专利申请见表3。
3 结语
通過上述对TAF的专利申请分析,可以看出,美国吉利德公司作为该药物最早研发和上市销售的公司,在化合物、制备方法、晶体、组合物、用途等多方面进行了专利申请并获得了授权,随着化合物专利在2021年即将到期,吉利德公司随后的PCT申请WO2013025788,国内公开号为CN103732594A,目前该申请处于合议组审查阶段,权利要求涉及富马酸磷丙替诺福韦化合物、晶体、组合物、制备方法、用途,国内药品生产企业和研究机构要对该申请的最终结案情况引起关注;同时,国内企业已经开始在合成方法、晶型、新的盐等方面进行了研发投入并申请了相关专利,可以看出,国内企业已经在该领域积极寻找技术创新点,以规避吉利德公司的相关专利,随着国内企业和研究机构的科技水平不断提升,专利保护意识不断增强,国内的申请人可以考虑借鉴美国吉利德公司、印度西普拉公司的专利申请模式,以PCT申请的方式走出国门,在更多地区获得知识产权保护,同时提升中国制药行业的影响力。
参考文献:
[1] 马帅,魏玮,贾景雨,等.富马酸替诺福韦酯的合成工艺改进[J].中国药物化学杂志,2013(5):372-376.

