土壤灭菌处理对入侵植物南美蟛蜞菊 及其伴生种生长的影响
张丽娜 陈学林 王桔红 陈文 李张伟
摘要: 该研究以温室盆栽法对南美蟛蜞菊重度入侵土壤进行高温高压湿热灭菌、添加杀真菌剂灭菌和添加杀细菌剂灭菌的处理后,将三种植株定植96 d后测定各生理指标参数,研究重度入侵土壤中各微生物类群对南美蟛蜞菊及其伴生种金腰箭和狗肝菜生长的影响。结果表明:在杀真菌、杀细菌以及高温高压湿热灭菌和未处理的南美蟛蜞菊重度入侵土壤中,三种植物生长情况均存在较大差异。在高温高压湿热灭菌土壤中南美蟛蜞菊的生长受到显著抑制,与未处理土壤中的生长情况相比,株高降低了17.59%,叶片数降低了38.10%,生物量降低了56.00%,电子传递速率变化不明显。在杀真菌土壤和杀细菌土壤中金腰箭的生长也受到显著抑制,与未处理土壤中的生长情况相比较,杀真菌土壤中的金腰箭株高降低最多(为42.28%),叶片数降低了38.89%,生物量降低了16.99%,电子传递速率变化不明显;在杀细菌土壤中金腰箭株高降低了36.64%,叶片数降低最多(为38.89%),生物量降低了33.67%,电子传递速率升高了11.11%。由此可见,不含微生物的土壤对南美蟛蜞菊生长有较强的抑制作用,不含真菌和细菌的土壤对金腰箭的生长有明显抑制作用。南美蟛蜞菊重度入侵土壤不仅适合南美蟛蜞菊的生长,也适合金腰箭的生长,对狗肝菜影响不大。
关键词: 南美蟛蜞菊, 入侵植物, 伴生种, 土壤微生物, 生长
中图分类号: Q948文献标识码: A文章编号: 10003142(2018)03031608
广西植物38卷3期张丽娜等: 土壤灭菌处理对入侵植物南美蟛蜞菊及其伴生种生长的影响收稿日期: 2017-05-27
基金項目: 国家自然科学基金(31770584,31470021);广东韩山师范学院科研团队项目(LT201204) [Supported by the National Natural Science Foundation of China(31770584, 31470021); Guangdong Hanshan Normal University Research Team Program(LT201204)]。
作者简介: 张丽娜(1990- ),女,甘肃张掖市人,硕士研究生,主要研究方向为植物学,(Email)linazhang15@163.com。
*通信作者: 王桔红,博士,教授,主要从事入侵生物学研究,(Email)wjuh1918@163.com。Effects of soil sterilization on growth of invasive
plant Wedelia trilobata and its associated species
ZHANG Lina1, CHEN Xuelin1, WANG Juhong2*, CHEN Wen3, LI Zhangwei4
( 1. College of Life Sciences, Northwest Normal University, Lanzhou 730070, China; 2. College of Life Sciences and Food Technology,
Hanshan Normal University, Chaozhou 521041, Guangdong, China; 3. College of Geography and Tourism Management, Hanshan
Normal University, Chaozhou 521041, Guangdong, China; 4. College of Chemistry and Environmental Engineering,
Hanshan Normal University, Chaozhou 521041, Guangdong, China )
Abstract: Invasive plant Wedelia trilobata and its associated species of Synedrella nodiflora and Dicliptera chinensis were utilized by potted plant method in greenhouse to compare the effects of soil microorganism on the growth of three plants. The plant height, biomass, leaf number, photosynthetic electron transport rate of three plants were determined after cultivated in the Wedelia trilobata invaded soil for 96 d. The soil sterilized by high temperature and high pressure, or adding fungicide and bactericide sterilization. The experiment indicated that the growth of the three plants described above was different in disparate soil. The strongest growth inhibition was W. trilobata in sterilization soil. Compared with the growth of plants in untreated soil, the plant height was decreased by 17.59%, the number of leaves decreased by 38.10%, biomass was reduced by 56.00%. The growth inhibition of Synedrella nodiflora was the greatest in antifungal soil. Compared with the plant in untreated soil, the height, the number of leaves, biomass, the electron transfer rate of S. nodiflora was decreased by 42.28%, 38.89%, 16.99%, 7.41%. The growth inhibition of S. nodiflora was also the greatest in antibacteria soil, compared with the growth in untreated soil, the plant height was decreased by 36.64%, the number of leaves was decreased by 38.89%, biomass was reduced by 33.67%, the electron transport rate was increased by 11.11%. The soil without microbes had strong inhibitory effect on the growth of Wedelia trilobata. The growth of fungi and bacteria in the soil of Synedrella nodiflora had obvious inhibitory effects. The soil invaded by Wedelia trilobata was not only suitable for W. trilobatas growth, but also for its associated species of Synedrella nodifloras growth. However, it had little effect on the Dicliptera chinensis. The invasion of alien plants into the new habitat, under appropriate conditions, spread, resulting in the loss of local biodiversity. In the whole process, soil microbes played a bridge role. The effects of different soil microbial communities on plant growth and feedback function, explained the ecological effects of soil microbes in the invasion process, and revealed the significance of the mechanism for the invasion. Explained study aimed at different groups of soil microbes including the effects on the growth of invasive plant Wedelia trilobata and associated species Synedrella nodiflora and Dicliptera chinensis. The index of the three kinds of plants were exploratory experiment, in order to find the influence of different kinds of microbes associated with the growth of invasive plants. And further analysis on vegetation and soil microbial community mutual relations, explored the mechanism of exotic plant invasion from the below ground plants on the ecological point of view. This study provides effecient ways for the effective prevention and control of alien invasive plants, and maintaining the stability of the ecosystem.
Key words: Wedelia trilobata, invasive species, associated species, soil microorganism, growth
外来植物的成功入侵是一个特殊的生态过程(Prentis et al, 2008),主要取决于入侵种的竞争能力、繁殖能力以及对新生境的适应能力(Beckmann et al ,2011)。有学者认为外来种的入侵可以改变入侵地土壤微生物群落的结构,使本土植物不再能够适应其土壤环境而在竞争中处于弱势,同时增大外来种的适应能力,实现其入侵性。另外,外来植物在入侵过程中,往往会释放一些特殊的化学物质,这些化学物质可消灭抑制其生长的病原微生物,从而实现入侵(王从彦等, 2012;郑曦等,2014)。土壤微生物参与养分循环和物质代谢的过程,地上植被的种类会引起地下土壤微生物群落的改變,土壤微生物群落也会通过多样性的改变反作用于植被,与植被形成相互作用的反馈体系(吴则焰等,2013a)。因此,土壤中不同微生物群落作为土壤微生物学特征的关键指标,近年来逐渐得到了研究者们的重视(马晓霞等,2012;吴则焰等,2013b)。Philip et al(2001)研究发现,入侵北美西部湿地的主要植物千屈菜(Lythrum salicaria)根际AMF存在时,植物地上和地下生物量显著减少,植株的形态特征发生变化,花序产生在植物茎干的更高处,而且植物花序中花的分布也发生变化。
研究不同土壤微生物群落对植物的生长反馈作用,可进一步认识土壤微生物在外来种入侵过程中的生态作用,对于揭示外来种的入侵机制意义重大。本研究针对土壤不同类群微生物对三种植物包括入侵植物南美蟛蜞菊及其伴生种金腰箭和狗肝菜各生长指标的影响进行探究性实验,旨在发现不同类群微生物对入侵植物及其伴生种的生长影响。进一步解析地上植被和土壤微生物群落的相互关系,试图从植物地上地下生态学角度探究外来植物入侵机制,为有效预防和控制外来入侵植物、维持生态系统的稳定提供信息。
1材料与方法
1.1 研究地概况
研究地位于粤东潮州市郊(114°54′E—117°10′ E,22°37′—24°91′ N),该地域属于亚热带海洋性季风气候,年均降水量1 300~2 400 mm,相对湿度达80%以上;年日照时数1 900~2 400 h;≥10 ℃的积温7 300~7 890 ℃;年均气温21.4 ℃,极端最高气温为39.6 ℃,极端最低气温为-0.5 ℃。土壤为酸性砖红壤,腐殖质较少,有机质含量为24.6~27 g·kg1,全氮含量为1.67~2.04 g·kg1,速效磷含量为26~27.99 mg·kg1,速效钾含量为111~116.44 mg·kg1。
1.2 研究方法
1.2.1 取样及处理在多年南美蟛蜞菊重度入侵区内随机选取多个取样点,人工去除南美蟛蜞菊后,取其 0~10 cm的表层土壤并充分混合,为南美蟛蜞菊重度入侵地土壤。对土壤进行高温高压湿热灭菌、添加杀真菌剂、添加杀细菌剂和不作处理(对照)四种处理方式。其中,高温高压蒸汽灭菌选用蒸汽灭菌锅,灭菌条件为 121 ℃,30 min,灭菌3次,以保证充分除去土壤中的微生物和微生物孢子(Callaway et al, 2010);杀真菌剂使用苯菌灵50%可湿性粉剂(有效成分为 1正丁氨基甲酰2苯并咪唑氨基甲酸甲酯)杀细菌剂为盐酸土霉素,均可有效除去土壤中的真菌和细菌群落。
1.2.2 盆栽实验采集入侵植物南美蟛蜞菊及其伴生种植物狗肝菜和金腰箭,将其统一修剪(株高、叶片数、叶片大小基本保持一致)后放在水中进行泡根,选择幼根生出且植株生长状况良好的植株备用。盆栽种植模式设置为南美蟛蜞菊、狗肝菜、金腰箭三种植物各16盆(花盆大小为40 cm × 50 cm),每种植物的每种处理方式(共四种处理方式,即高温高压湿热灭菌、添加杀真菌剂、添加杀细菌剂和不作处理)各4盆(即4盆重复),每个花盆种植相应的植物12株(即12株重复)。
盆栽种植规模为植物种类(3 种)×处理类型(4 种)×重复数(4个)=48盆。
植株种植规模为植物种类(3种)×处理类型(4种)×重复数(4个)×单盆植株数(12个)= 576株。
将盆栽做好标签后随机合理摆放,以保证光线等条件的均一性。扦插前先将每钵盆栽的土壤充分整平,然后按实验设置要求分别浇上足够的相应处理过的水(高温高压蒸汽灭菌水、添加杀真菌剂的水、添加杀细菌剂的水、未处理的自来水)。对杀真菌剂处理、杀细菌剂处理的盆栽,在植物生长过程中每月喷施药剂3次,以保证土壤中的真菌和细菌群落得到持续抑制。
1.2.3 测定指标植株定植20 d后开始测定生理指标参数,包括植物的株高、生物量、叶片数和光合电子传递速率,每隔12 d从相应花盆中随机拔出植株进行测量,持续监测植物生长情况,以保证植物生长稳定。盆栽实验共96 d。各生物指标于植物生长第96天后进行测量,每个指标重复测量3次后求平均值。
株高为地上植株高度(从土壤表层到植物主茎的最顶端),采用精密刻度尺测量。生物量包括植株地上和地下生物量,地上生物量指植物地上茎叶的总干重,地下生物量指植物在土壤地下部分(根)的干重,测量时将植物地上茎叶与地下根分别烘干至恒重后用万分之一电子天平精确称量。相对电子传递速率采用PAM 2500叶绿素荧光仪测量,计算表观光合电子传递速率(ETR)(Zhang,1999),每株植物测3个叶片,每个叶片测5个值,最后取其平均值(测量前先使叶片在黑暗条件下适应30 min)。
1.3 数据统计
本研究采用单因素方差分析和最小显著差异法在P<0.05概率水平上分析不同处理土壤中植物各生理指标的差异性。数据分析和处理采用Microsoft Excel 2010和SPSS19.0软件。
2结果与分析
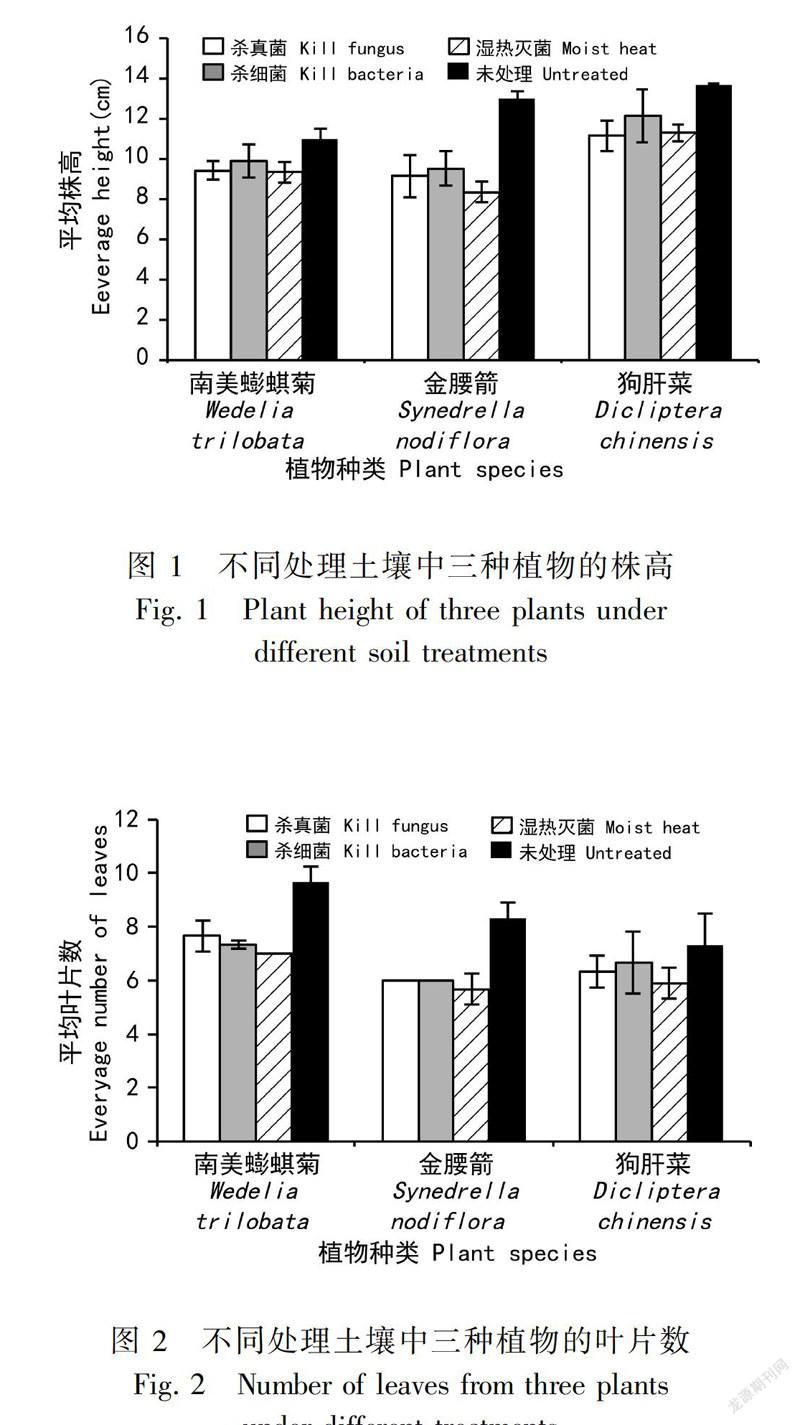
2.1 不同土壤微生物类群对入侵植物及其伴生种株高的影响
由图1可知,与未处理土壤中的植物株高相比,南美蟛蜞菊和狗肝菜在杀细菌土壤中的株高均无显著差异,而其他处理土壤中的植物株高存在一定的差异性,尤其是金腰箭在杀真菌土壤和高温高压湿热灭菌土壤中的株高与对照组差异性极显著。数据显示,与未灭菌的对照组相比较,南美蟛蜞菊在杀真菌土壤中的株高降低了16.56%(P<0.05),杀细菌土壤中的株高降低了10.95%(P>0.05),高温高压湿热灭菌土壤中的株高降低了17.59% ( P<0.05);金腰箭在杀真菌土壤中的株高降低了42.28%(P<0.05),杀细菌土壤中的株高降低了36.64%(P<0.05),高温高压湿热灭菌土壤中的株高降低了42.21%(P<0.05);狗肝菜在杀真菌土壤中的株高降低了22.81%(P<0.05),杀细菌土壤中的株高降低了12.90% (P>0.05),高溫高压湿热灭菌土壤中的株高降低了21.21%(P<0.05)。
由此可见,三种植物表现出的变化趋势基本相同,采用高温高压湿热灭菌处理的植株相比于对照组株高降低最多,其次为采用杀真菌和杀细菌处理的植株。南美蟛蜞菊重度入侵土壤经过高温高压湿热灭菌、杀真菌和杀细菌处理后,都会抑制南美蟛蜞菊及其伴生种植物株高的生长。
2.2 不同土壤微生物类群对入侵植物及其伴生种叶片生长的影响
由图2可知,三种植物在不同土壤处理方式中的叶片数目均有变化。数据显示,与未灭菌的对照组相比,南美蟛蜞菊在杀真菌土壤中的叶片数目减少了26.09%(P<0.05),杀细菌土壤中的叶片数目减少了31.82%(P<0.05),高温高压湿热灭菌土壤中的叶片数目减少了38.10%(P<0.05);金腰箭在杀真菌土壤中的叶片数目减少了38.89%(P<0.05),杀细菌土壤中的叶片数目减少了38.89%(P<0.05),高温高压湿热灭菌土壤中的叶片数目减少了47.06%(P<0.05);狗肝菜在杀真菌土壤中的叶片数目减少了15.79% (P>0.05),杀细菌土壤中的叶片数目减少了10% (P>0.05),高温高压湿热灭菌土壤中的叶片数目减少了24.53% (P>0.05)。
由此可见,南美蟛蜞菊重度入侵土壤经过杀真菌和杀细菌处理后,都会抑制南美蟛蜞菊及其伴生种叶片的生长。与对照组土壤中植物的叶片数相比,南美蟛蜞菊和金腰箭在经过这三种方式处理后,叶片数目均有所减少,差异性较大。然而,狗肝菜在经过这三种处理方式后均无明显变化。
2.3 不同微生物类群土壤中入侵植物及其伴生种的地上、地下生物量
从表1可以看出, 三种植物在不同土壤处理下
生物量均有变化。入侵植物南美蟛蜞菊与未灭菌(地上0.318 0 g,地下0.157 0 g)的对照组相比:在杀真菌土壤中的总生物量(地上0.347 1 g,地下0.165 4 g)降低了21.48%,无差异性(P>0.05);在杀细菌土壤中的总生物量(地上0.166 8 g,地下0.061 9 g)降低了51.85%,差异性极显著(P<0.05),在高温高压湿热灭菌土壤中的总生物量(地上0.147 9 g,地下0.061 1 g)降低了56.00%,差异性极显著(P<0.05)。金腰箭与未灭菌(地上0.384 7 g,地下0.153 7 g)的对照组相比:在杀真菌土壤中的总生物量(地上0.340 4 g,地下0.106 5 g)降低了33.67%,差异性较显著(P<0.05);在杀细菌土壤中的总生物量(地上0.250 9 g,地下0.106 2 g)降低了49.24%,差异性显著(P<0.05),在高温高压湿热灭菌土壤中的总生物量(地上0.201 5 g,地下0.071 8 g)降低了49.24%,差异性极显著(P<0.05)。狗肝菜在杀真菌、杀细菌和湿热灭菌土壤中的生物量与未灭菌的对照组相比分别降低了19.4%、11.21%和19.11%,差异均不显著。
由此可见, 与对照组土壤中植物的生物量相比,南美蟛蜞菊和金腰箭在三种处理后土壤中的植株生物量均有显著的减少,尤其是土壤经高温高压湿热灭菌以及灭真菌和灭细菌处理后,植株与对照组相比总生物量减少最显著,而狗肝菜在三种处理方式中的各生物量差异均不显著。
2.4 土壤不同微生物类群对入侵植物和本地植物电子传递速率的反馈
由表2可知,与未灭菌的对照组相比,南美蟛蜞菊和金腰箭的电子传递速率变化均不显著(P>0.05);狗肝菜在杀真菌土壤中的电子传递速率降低了37.5% (P<0.05),在杀细菌土壤中的电子传递速率升高了25% (P<0.05),在高温高压湿热灭菌土壤中的电子传递速率降低了6.25% (P>0.05)。总之,土壤不同微生物类群对植物叶片中的电子传递速率也有一定的影响。
3讨论
该实验结果表明:含有不同类型微生物群落的土壤对三种植物的各生长指标均有一定的影响,说明土壤中的微生物是植物生长必不可少的。这主要是因为土壤微生物是土壤生态系统的分解者和调节者,也是土壤有机质的活性部分,不仅在养分转化中起重要作用,其本身也是土壤养分的供应源和贮存库(肖博等,2014)。一方面,土壤微生物可提高土壤营养物质和水的利用率,参与生态系统的物质循环和能量流动,对入侵植物的生长繁殖等有不同影响(Marler et al, 1999;Callaway et al,2010;Bray et al,2003);另一方面,外来物种通过改变入侵地土壤微生物群落来破坏当地植物与土壤微生物间经过长时间形成的平衡共生关系,进而影响当地物种的生长和种群更新,使其自身获得便利(于兴军等,2005)。Hawkes et al(2006)在研究美国加州和犹他州草地时就发现,入侵该地的裂稃燕麦(Avena barbata)和大麦状雀麦(Bromus hordeaceus)能明显改变当地植物根部微生物群落组成,使其由菌根菌转变为非菌根菌,进而导致当地植物竞争力的降低,进而使该外来种得以成功入侵。
由于不同植物土壤微生物群落存在差异,入侵植物及其伴生种在不同的土壤环境中也会有不同的生长状态,入侵植物在其自身重度入侵土壤中生长时,由于植物长期定植,土壤中的营养条件已经更加适宜于其自身的生长,因此,其长势可能会更加旺盛,而在其他本地植物长期生存的土壤环境或缺少某些功能性微生物群落的土壤环境中生长时,长势可能会受到一定的抑制。该实验中入侵植物南美蟛蜞菊在自身重度入侵土壤中生长旺盛,而在灭真菌,灭细菌和高温高压湿热灭菌土壤环境中的生长受到一定的抑制。与未处理土壤中植株的生长情况相比,南美蟛蜞菊株高、叶片数和生物量都有所降低,南美蟛蜞菊在灭真菌、灭细菌和高温高压湿热灭菌土壤中生物量分别降低了21.48%,51.85%和56.00%;其次为金腰箭和狗肝菜的生物量。可见,与对照组相比,南美蟛蜞菊和金腰箭在缺少细菌的土壤中生物量减少最显著,说明土壤中部分细菌类群与入侵植物南美蟛蜞菊保持着密切的关系,对植物的生长和发育有一定的促进作用。牛红榜等(2007)研究发现,紫茎泽兰(Eupatorium adenophorum)入侵后,引起土壤中自生固氮菌(Azotobacter)、氨氧化细菌(Ammonia oxidizing bacteria)和真菌数量升高,微生物群落的变化使得土壤中的营养成分更有利于紫茎泽兰生长、竞争与扩张, 进而促进其入侵过程。除此之外,狗肝菜在缺少真菌的土壤中生物量减少比在其他处理土壤中的减少量更显著,为19.4%,说明狗肝菜的生长对土壤中部分真菌类群有一定的依赖性,土壤中如果缺少了这些类群的微生物,可能会影响到植株正常的生长发育。Stinson et al(2006)和Wolfe et al(2008)在研究北美森林生态系统中外来植物时发现,植物的入侵降低了入侵地AM真菌的丰富度,从而使那些强烈依赖AM真菌的当地植物种在与入侵植物竞争过程中受到排挤,最终实现外来种的入侵。可见,不同土壤微生物群落对植物生长有一定的影响,尤其是对株高和生物量影响差异性十分显著。部分细菌和真菌对南美蟛蜞菊的生长起着至关重要的作用,缺少真菌和细菌的土壤对植物生长的抑制作用较强,高温高压湿热灭菌后即不含微生物的土壤对植物生长的抑制作用最强,说明植物的生长与土壤中的微生物密切相关,任何一种类群的微生物的缺少都会使植株无法正常生长。
绿色植物的光合作用是绿色细胞利用太阳光能,将二氧化碳和水转化成有机物。光合作用中,光合色素吸收光能后,把能量聚集到反应中心—一种特殊状态的叶绿素a分子,引起电荷分离和光化学反应。一方面将水氧化,放出氧气;另一方面把电子传递给辅酶Ⅱ(NADP+),将它还原成NADPH,其间会经过一系列中间载体(也称递体)(Belnap et al,2008;Biswas et al,2008;Borghi et al,2008)。该实验通过对植物叶片中相对电子传递速率的研究发现,在不同处理土壤中,电子传递速率 (ETR)受微生物的影响均很显著,真菌对狗肝菜电子传递速率的影响最大,其次是金腰箭,南美蟛蜞菊影响最小,但細菌群落对三种植物叶片电子传递速率均表现为抑制作用,原因还需要进一步探索。由此推测可能是由于植物根部分泌的一些化学物质或某些特殊功能的微生物菌群对其有所影响。
外来植物侵入到新栖息环境后,在适宜条件下扩散蔓延,导致当地生物多样性丧失。在整个过程中,土壤微生物起到了桥梁作用, 本研究通过改变土壤微生物群落探讨了土壤中不同类群微生物对入侵植物及其伴生种生长的影响,旨在通过认识入侵植物入侵过程中的生态作用及其与土壤微生物的互作来进一步揭示外来种的入侵机制。
参考文献:
BRAY SR, KITAJIMA K, SYLVIA DM, 2003. Mycorrhizae differentially alter growth physiology and competitive ability of an invasive shrub [J]. Ecol Appl, 13: 565-574.
BECKMANN M, BRUELHEIDNH, ERFMEIERA, 2011. Germination responses of three grassland species differ between native and invasive origins [J]. Ecol Res, 26(4): 763-771.
BISWAS DK, XU H, LI YG, et al, 2008. Assessing the genetic relatedness of higher ozone sensitivity of modern wheat to its wild and cultivated progenitors/relatives [J]. J Exp Bot, 59(4): 951-963.
BELNAP J, PHILLIPS SL, FLINT S, et al, 2008. Global change and biological soil crusts: effects of ultraviolet augmentation under altered precipitation regimes and nitrogen additions [J]. Glob Chang Biol, 14(3): 670-686 .
BORGHI M, TOGNETTI R, MONTEFORTI G, et al, 2008. Responses of two poplar species(Populus alba and Populus × canadensis) to high copper concentrations [J]. Environ Exp Bot, 62(3):290-299.
BUSCH F, HUNER NPA, ENSMINGER I, 2008. Increased air temperature during simulated autumn conditions impairs photosynthetic electron transport between photosystem Ⅱ and photosystem Ⅰ [J]. Plant Physiol, 147(1): 402-414.
CALLAWAY RM, NEWINGHAM B, ZABINSKI CA, 2010. Compensatory growth and competitive ability of an invasive weed are enhanced by soil fungi and native neighbors [J]. Ecol Lett, 4(5): 429-433.
HAWKES CV, BELNAP J, ANTONIO CD, et al, 2006. Arbuscular mycorrhizal assemblages in native plant roots change in the presence of invasive exotic grasses [J]. Plant Soil, 281, 369-380.
MA XX, WANG LL, LI QH, et al, 2012. Effects of longterm fertilization on soil microbial biomass carbon and nitrogen and enzyme activities during maize growing season[J]. Acta Ecol Sin, 32(17): 5502-5511. [马晓霞, 王莲莲, 黎青慧, 等, 2012. 长期施肥对玉米生育期土壤微生物量碳氮及酶活性的影响[J].生态学报, 32(17):5502-5511.]
MARLER MJ, ZABINSKI CA, CALLAWAY RM, et al, 1999. Mycorrhizae indirectly enhance competitive effects of an invasive forb on a native bunchgrass [J]. Ecology, 80: 1180-1186.
NIU HB, LIU WX, WAN FH, 2007. Invasive effects of Ageratina adenophora Sprengel (Asteraceae) on soil microbial community and physical and chemical properties [J]. Acta Ecol Sin, 27: 3051-3060. [牛红榜, 刘万学, 万方浩, 2007. 紫茎泽兰(Ageratina adenophora)入侵对土壤微生物群落和理化性质的影响 [J]. 生態学报, 27: 3051-3060.]
PHILIP LJ, POSLUSZNY U, KLIRONOMOS JN, 2001. The influence of mycorrhizal colonization on the vegetative growth and sexual reproductive potential of Lythrum salicaria L [J]. Can J Bot, 9(4): 381-388.
PRENTIS PJ, WILSON JRU, DORMONTT EE, et al, 2008. Adaptive evolution in invasivespecies [J]. Trends Plant Sci, 13(6): 288-294.
STINSON KA, CAMPBELL SA, Powell JR, et al, 2006. Invasive plant suppresses the growth of native tree seedlings by disrupting belowground mutualisms [J]. Plos Biol, 4: 727-731.
WOLFE BE, RODGERS VL, STINSON KA, et al , 2008. The invasive plant Alliariapetiolata (garlicmustard) inhibits ectomycorrhizal fungi in its introduced range [J]. J Ecol, 96: 777-783.
WU ZY, LIN WX, CHEN ZF, et al, 2013a. Variations of soil microbial community diversity along an elevational gradient in midsubtropical forest [J]. Chin J Plant Ecol, 37 (5): 397-406. [吴则焰, 林文雄, 陈志芳, 等, 2013a. 中亚热带森林土壤微生物群落多样性随海拔梯度的变化 [J]. 植物生态学报, 37 (5): 397-406.]
WU ZY, LIN WX, CHEN ZF, et al, 2013b. Characteristics of soil microbial community under different vegetation types in Wuyishan National Nature Reserve[J]. Chin J Appl Ecol, 24(8):2301-2309. [吴则焰, 林文雄, 陈志芳, 等, 2013b. 武夷山国家自然保护区不同植被类型土壤微生物群落特征[J]. 应用生态学报, 24(8): 2301-2309.]
XIAO B, ZHOU W, LIU WX, et al, 2014. Freeback of Ageratina adenophora soil microbe on A. adenophora and ative plants [J]. J Agric Sci Technol Chin, 16(4): 151-158. [肖博, 周文, 刘万学, 等, 2014. 紫茎泽兰入侵地土壤微生物对紫茎泽兰和本地植物的反馈 [J]. 中国农业科技导报, 16(4): 151-158.]
YU XJ, YU D, LU ZJ, et al, 2005. A possible plant invasion mechanism: Invasive species effect the native species by changing the soil microbial community [J]. Sci Bull, 50(9): 896-903. [于兴军, 于丹, 卢志军, 等, 2005. 一个可能的植物入侵机制: 入侵种通过改变入侵地土壤微生物群落影响本地种的生长 [J]. 科学通报, 50(9): 896-903.]
ZHANG SR, 1999. A discussion on chlorophyll fluorescence kinetics parameters and their significance [J]. Bull Bot, 16(4): 444-448.
WANG CY, XIANG JG, DU DL, 2012. The eological effects of two invasive plants on soil microorganism community in rhizosphere [J]. Ecol Environ, 21(7): 1247-1251. [王從彦, 向继刚, 杜道林, 2012. 2种入侵植物对根际土壤微生物种群及代谢的影响 [J]. 生态环境学报, 21(7): 1247-1251.]
ZHENG X, LI XH, YANG XX, 2016. Allelopathy of wheat straw aqueous extract on five kinds of plants [J]. Guihaia, 36(3): 329-334. [郑曦, 杨茜茜, 李小花, 2016. 小麦秸秆水浸提液对5种植物化感作用的研究 [J]. 广西植物, 36(3): 329-334.]

