姜黄素纳米粒对高脂诱导的心肌细胞损伤的作用
周 宇,李 晶,鲍翠玉
(湖北科技学院 1. 药学院、2. 糖尿病心脑血管病变湖北省重点实验室,湖北 咸宁 437100)
随着人们生活水平的不断提高,糖尿病(diabetes mellitus,DM)的发病率呈现逐年上升的趋势[1]。糖尿病心肌病(diabetes cardiomyopathy,DCM)是一种相对于先天性心脏病、高血压心脏病、冠状动脉粥样硬化、心脏瓣膜性病变和其他心脏病来说独立发生的疾病,会改变心脏正常功能,导致心肌缺血和心力衰竭[2]。各种因素都有可能参与DCM的发生与发展,比如炎症、氧化应激、线粒体损伤、心肌细胞中的糖脂代谢紊乱、心肌纤维化和心肌细胞凋亡都被认为是DCM的发病机制[3]。棕榈酸(palmitic acid,PA)是血浆中含量最丰富的游离脂肪酸,持续高脂的刺激会造成心肌细胞的功能损伤,激活凋亡信号通路中的信号分子caspase、Bax、Bcl-2以及内质网应激(endoplasmic reticulum stress,ERS)信号通路,诱导细胞凋亡[4]。
姜黄素具有降血脂、抗肿瘤、抗炎、利胆、抗氧化等作用,治疗代谢相关性疾病,但由于姜黄素本身双苯环结构所致,其水溶性很低,生物体内摄取率低,血液清除率高,进而生物利用率低下,限制了姜黄素在临床治疗中的应用。纳米药物递送系统,尤其是纳米高分子药物递送系统能明显改善姜黄素水溶性差、生物利用率低等缺陷[5],在姜黄素药物制剂制备领域表现出良好前景。基于此,本研究建立高脂诱导的心肌细胞损伤模型,研究姜黄素纳米粒(curcumin nanoparticles,Cur-NPs)对高脂诱导的心肌细胞损伤的保护作用及机制,为Cur-NPs在心血管疾病方面的治疗提供理论依据。
1 材料与方法
1.1材料
1.1.1细胞系 H9c2心肌细胞购于上海通派生物有限公司。
1.1.2试剂 Cur-NPs由中国科学研究院长春应用化学研究所高分子物理与化学研究课题组提供。高糖DMEM培养基(美国Hyclone公司);胎牛血清、MTT(美国Gibco公司);棕榈酸(美国Sigma公司);DAPI染液(武汉谷歌生物有限公司);细胞活性氧(reactive oxygen species,ROS)试剂盒、ECL试剂盒(美国Thermo Scientific公司);TUNEL试剂盒(美国Roche公司);BCA试剂盒(上海碧云天生物技术公司);抗Bcl-2、Bax、GRP78、CHOP抗体(美国Cell Signaling Technology公司);β-actin抗体(美国Santa Cruz公司)。
1.1.3仪器 超净工作台(苏州安泰公司);CO2细胞培养箱(德国Heraeus公司);HVE-50高压灭菌器(日本Hirayama公司);倒置荧光显微镜(日本Olympus公司);酶标仪(美国Bio-Tek公司);自动发光凝胶成像系统(英国SYNGENE公司);垂直式电泳仪(美国Bio-Rad公司)。
1.2方法
1.2.1细胞培养 H9c2心肌细胞培养在含10%胎牛血清和100 kU·L-1双抗的高糖DMEM中,置于37℃、5% CO2的细胞培养箱中孵育24 h,细胞充分贴壁生长融合至80%时,用含0.25% EDTA胰酶消化传代培养,取对数生长期的细胞进行实验。
1.2.2PA的配制 准备EP管装有1 mL无水乙醇,用分析天平精准称取PA粉末25.642 mg,把称好的PA粉末倒入无水乙醇中,将EP管放入37℃水浴锅中轻摇震荡至完全溶解。然后使用孔径为0.22 μm的滤膜过滤,过滤后的储存液浓度为100 mmol·L-1,使用前37℃水浴锅将PA储存液完全溶解至无沉淀物。给药时,用含5% BSA的DMEM稀释使用。
1.2.3Cur-NPs的配制 用分析天平精准称取Cur-NPs粉末85 mg,溶于1 mL 1×PBS中,超声至完全溶解,无需过滤。
1.2.4实验分组 (1)PA浓度梯度:设为0、0.025、0.05、0.1、0.2、0.4、0.8 mmol·L-1,进行MTT检测;(2)PA时间梯度:设为12、24、48 h,进行MTT检测;(3)PA浓度设为0.4 mmol·L-1,Cur-NPs浓度梯度设为0、20、40、80、160、200 μmol·L-1,进行MTT检测;(4)Cur-NPs药物疗效检测:设为正常对照组、PA 0.2 mmol·L-1、PA 0.2 mmol·L-1+Cur-NPs 200 μmol·L-1、PA 0.4 mmol·L-1、PA 0.4 mmol·L-1+Cur-NPs 200 μmol·L-1,进行ROS、TUNEL及免疫印迹检测。
1.3检测指标
1.3.1MTT法检H9c2心肌细胞增殖率 在96孔板中接种H9c2心肌细胞悬液(每孔1×106细胞,每孔100 μL),每组设置6个复孔。将96孔板放入细胞培养箱中培养24 h,待细胞完全贴壁,向每孔加入不同浓度含PA的培养基继续培养相应时间。弃去孔内上清液,每孔加入20 μL的5 g·L-1MTT溶液,继续培养4 h,用酶标仪读取在570 nm处的吸光度值,按照以下公式计算细胞增殖率:细胞增殖率/%=实验组吸光度值/正常对照组吸光度值×100%。
1.3.2细胞ROS检测 在24孔板中接种H9c2心肌细胞,向每孔分别加入不同浓度含PA的高糖DMEM培养基,继续培养24 h,弃去孔内培养基,用不含胎牛血清的DMEM清洗2遍,按1 ∶500的比例用不含胎牛血清的DMEM配制ROS试剂盒试剂,每孔加入500 μL配制好的试剂,细胞培养箱中培养20 min,弃去孔内培养基,用1×PBS清洗2遍,向每孔滴加1滴DAPI染液,避光室温静置10 min,1×PBS清洗2遍后收集细胞爬片,用抗荧光淬灭封片剂封片。在倒置荧光显微镜20倍镜下观察,拍照。
1.3.3TUNEL检测 在24孔板中接种H9c2心肌细胞,每孔分别加入不同浓度含PA的高糖DMEM培养基继续培养24 h,弃去孔内培养基,1×PBS清洗2遍,4%多聚甲醛室温固定1 h,3%过氧化氢封闭10 min,0.1% Triton X-100渗透孵育2 min,1×PBS清洗2遍后,每孔加入50 μL TUNEL检测试剂,放回细胞培养箱培养1 h。用1×PBS清洗2遍,向每孔滴加1滴DAPI染液,避光室温静置10 min,1×PBS清洗2遍后收集细胞爬片,用抗荧光淬灭封片剂封片。在倒置荧光显微镜20倍镜下观察,拍照。
1.3.4蛋白免疫印迹法检测 H9c2心肌细胞培养在37℃、5% CO2的细胞培养箱中孵育24 h,弃去培养皿中培养基,用1×PBS清洗2遍,加入裂解液,收集裂解液,离心取上清液, BCA法测定蛋白浓度。取合适量的总蛋白在12%的SDS-PAGE凝胶中电泳分离,转膜后,在5%脱脂牛奶中封闭2 h。PVDF膜一抗4℃孵育过夜,1×TBST洗膜后,二抗室温孵育1 h。将PVDF膜与ECL显影液充分接触后,在化学发光凝胶成像系统中检测凋亡信号通路蛋白caspase-3、Bax、Bcl-2,以及ERS信号通路蛋白GRP78、CHOP蛋白表达情况。
1.4统计学方法数据均使用SPSS 17.0与GraphPad Prism7软件分析处理,两组数据间差异采用t检验进行计算。
2 结果
2.1高脂刺激对H9c2心肌细胞增殖率的影响Fig 1A结果显示,不同浓度PA(0.025、0.05、0.1、0.2、0.4、0.8 mmol·L-1)刺激H9c2心肌细胞24 h时,增殖率分别为101.4%、106.6%、102.2%、106.6%、71.7%和54.0%。与正常对照组相比,PA 0.4 mmol·L-1刺激心肌细胞24 h时,细胞增殖率开始出现明显下降(P<0.01)。Fig 1B结果表明,0.4 mmol·L-1PA刺激H9c2心肌细胞0、12、24、48 h时,高脂所致的心肌细胞增殖率出现时间依赖性降低现象,PA 0.4 mmol·L-1刺激心肌细胞24 h时,细胞增殖率出现50%以上下降(P<0.01)。因此,在MTT实验中,我们将PA浓度设为0.4 mmol·L-1,刺激时间设为24 h[6]。
2.2Cur-NPs改善高脂诱导的心肌细胞增殖能力低下如Fig 2A所示,小分子姜黄素不溶于水,溶 于DMSO,而纳米化的姜黄素溶解于水溶液,提示Cur-NPs在溶解度方面优于小分子姜黄素,而溶解度的提高将有助于提高药物的稳定性及生物利用度,大大改善其疗效,降低毒性。Fig 2B结果表明,当0.4 mmol·L-1PA刺激24 h时,H9c2心肌细胞的增殖能力明显降低,而不同浓度Cur-NPs预处理,可以不同程度改善高脂诱导的心肌细胞增殖能力的损伤,与PA组的29.4%比较,Cur-NPs(20、40、80、160、200 μmol·L-1)预处理组,细胞增殖率分别为45.9%、64.0%、70.8%、80.4%、84.4%。随着Cur-NPs的浓度的升高,细胞增殖率呈现浓度依赖性升高趋势,提示Cur-NPs对高脂诱导的心肌细胞增殖率的损伤有明显的改善作用,在后续实验中选择Cur-NPs为200 μmol·L-1。
2.3Cur-NPs对高脂诱导的细胞氧化损伤的影响如Fig 3所示,与正常对照组比较,PA浓度为0.2 mmol·L-1时,细胞中ROS水平有所增加,细胞数目有所减少,另外,细胞出现轻微形态学改变,如细胞体积缩小、连接减少、细胞质密度增加、核质浓缩、核膜核仁破碎。当PA浓度为0.4 mmol·L-1时,细胞数量急剧减少,细胞质与细胞核均发生不同程度的改变,表现为细胞胀大、胞膜破裂、细胞内容物外溢等现象。Cur-NPs对高脂诱导的心肌细胞氧化损伤有明显改善作用,PA 0.2 mmol·L-1+Cur-NPs 200 μmol·L-1与PA 0.2 mmol·L-1相比,细胞形态更加完整,细胞膜破裂情况消失。PA 0.4 mmol·L-1+Cur-NPs 200 μmol·L-1与PA 0.4 mmol·L-1组相比,细胞数目接近于正常对照组,细胞质与细胞核的形态也接近于正常对照组。

Fig 1 Effect of high fat on proliferation of H9c2
**P<0.01vscontrol group

Fig 2 Solubility and anti-cell damage efficacy of curcumin nanoparticles
2.4Cur-NPs对高脂诱导的细胞凋亡的影响Fig 4A结果表明,与正常对照组比较,PA浓度为0.2 mmol·L-1时,细胞数目有所减少,细胞质与细胞核均发生轻微形态学改变。PA 0.4 mmol·L-1与正常对照组相比,TUNEL标记的红色荧光明显增强,但细胞数目出现明显减少,细胞质与细胞核均发生明显的细胞凋亡相关形态学改变,如核固缩、核碎裂、胞膜破裂、细胞内容物外溢等。Cur-NPs对高脂诱导的心肌细胞凋亡有明显改善作用, PA+Cur-NPs组与PA组相比,TUNEL标记的红色荧光明显降低,细胞数目与细胞形态基本恢复正常,接近于正常对照组。
如Fig 4B所示,PA 0.2 mmol·L-1与PA 0.4 mmol·L-1组caspase-3蛋白的表达水平与正常对照组相比明显增高(P<0.01),当PA浓度为0.2 mmol·L-1时,Bax/Bcl-2比值与正常对照组相比明显增高(P<0.05);PA 0.2 mmol·L-1+Cur-NPs 200 μmol·L-1与PA 0.4 mmol·L-1+Cur-NPs 200 μmol·L-1组caspase-3蛋白的表达水平相对于PA0.2 mmol·L-1与PA 0.4 mmol·L-1组明显降低(P<0.01),PA 0.2 mmol·L-1+Cur-NPs 200 μmol·L-1组Bax/Bcl-2比值相对于PA 0.2 mmol·L-1组明显降低(P<0.05)。
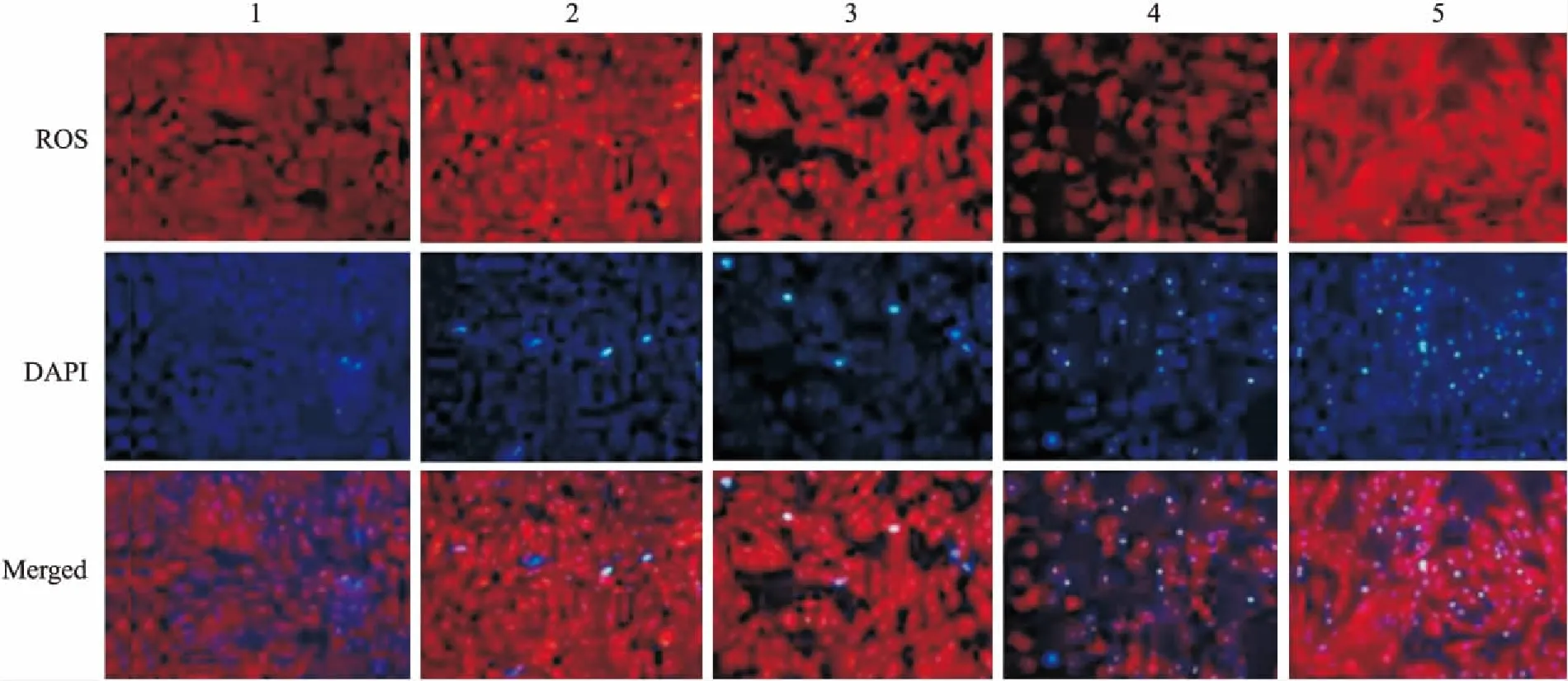
Fig 3 Effect of Cur-NPs on PA-induced cardiomyocyte oxidative damage(×20)
1:Control; 2:PA 0.2 mmol·L-1; 3:PA 0.2 mmol·L-1+Cur-NPs 200 μmol·L-1; 4:PA 0.4 mmol·L-1; 5:PA 0.4 mmol·L-1+Cur-NPs 200 μmol·L-1.

Fig 4 Effect of Cur-NPs on apoptosis of cardiomyocytes induced by PA

2.5Cur-NPs对高脂诱导的心肌细胞ERS信号通路激活的影响如Fig 5所示,PA 0.4 mmol·L-1组GRP78和CHOP蛋白的表达水平与正常对照组相比明显增高(P<0.05),PA 0.4 mmol·L-1+Cur-NPs 200 μmol·L-1组GRP78和CHOP蛋白的表达水平相对于PA 0.4 mmol·L-1组明显降低(P<0.05)。

Fig 5 Effect of Cur-NPs on expression of GRP78 and CHOP protein in cardiomyocytes induced by high n=3)
1:Control; 2:PA 0.2 mmol·L-1; 3:PA 0.2 mmol·L-1+Cur-NPs 200 μmol·L-1; 4:PA 0.4 mmol·L-1; 5:PA 0.4 mmol·L-1+Cur-NPs 200 μmol·L-1.*P<0.05vscontrol group;#P<0.05vsPA.
3 讨论
糖尿病会导致一系列器官或者系统的病理性改变,包括血管、心脏、肾脏、眼睛、足部、神经等部位的并发症[7]。DCM病理表现为心肌的代谢紊乱、微小血管病变导致的心肌肥大、细胞的坏死与凋亡和间质纤维化[8]。DCM会改变心脏正常功能,导致心肌缺血和心力衰竭。持续高脂的刺激会造成心肌细胞的功能损伤,引起心肌细胞的氧化应激和凋亡。PA被广泛用于细胞或动物实验中脂毒性损伤模型的建立,在体外实验中发现,PA能诱导心肌细胞、肝细胞、胰岛细胞、视网膜神经节细胞、肾小球足细胞等出现损伤[9]。本研究中,我们采取不同刺激浓度、不同刺激时间来检测PA对H9c2心肌细胞增殖能力的影响,发现PA浓度为0.4 mmol·L-1,刺激时间为24 h时细胞增殖率开始出现明显下降。
姜黄素通过多种途径保护细胞,能够减轻细胞的凋亡[10]。但由于姜黄素水溶性低、生物利用度低、血液清除快,使姜黄素在临床治疗中的应用受到了限制。纳米药物递送系统能明显改善这些缺陷,本研究检测了Cur-NPs对高脂诱导的心肌细胞损伤的保护作用。MTT结果显示,PA 0.4 mmol·L-1刺激细胞24 h后,细胞增殖率明显下降,给予不同浓度的Cur-NPs预处理后,细胞的增殖水平逐渐恢复。根据MTT实验结果,我们选择200 μmol·L-1为后续实验的Cur-NPs给药浓度。
高脂环境持续刺激机体时,机体ROS产生越来越多,且不能及时有效地清除,会使细胞氧化与抗氧化功能打破正常工作状态,产生氧化应激损伤。本研究中,当PA浓度为0.2 mmol·L-1时,与正常对照组相比,细胞ROS明显增加,而且细胞开始出现凋亡相关形态学改变,当PA浓度为0.4 mmol·L-1时,细胞数量急剧减少,细胞发生明显的凋亡。说明长时间暴露于高脂环境下,可使心肌细胞发生氧化应激损伤,导致细胞的形态和数目发生改变,最终导致心肌细胞出现凋亡,影响心脏的正常功能。同时,我们通过TUNEL检测试剂盒发现,随着PA浓度的增加,H9c2心肌细胞逐渐出现凋亡相关改变。当PA浓度增加为0.4 mmol·L-1时, TUNEL标记的红色荧光明显增强,同时细胞数量明显减少,细胞失去正常形态,呈现明显的凋亡相关形态学变化。给予Cur-NPs预处理后,细胞的氧化损伤和凋亡均出现明显改善,细胞的数目和形态也逐渐恢复正常。
目前凋亡通路研究较多,细胞内氧化应激[11]、DNA损伤、钙离子超负荷等都可以引起细胞色素C和细胞凋亡蛋白酶激活因子1形成了凋亡复合体,使caspase-3和caspase-9的激活,引起caspase级联反应[12]。大量结果表明,Bax和Bcl-2在凋亡通路中有重要作用[13]。本研究证实,H9c2心肌细胞给予0.4 mmol·L-1PA刺激24 h时,细胞内caspase-3的水平明显增高,给予0.2 mmol·L-1PA刺激时,Bax/Bcl-2比值明显增高;Cur-NPs预处理后,与PA组相比,PA+Cur-NPs组的caspase-3表达水平及Bax/Bcl-2比值明显降低,证实Cur-NPs可以明显降低由高脂诱导的心肌细胞的凋亡水平。进一步观察了ERS相关蛋白GRP78和CHOP的表达,发现高脂环境下心肌细胞中ERS相关蛋白表达明显升高,Cur-NPs预处理可以明显降低由高脂引起的ERS蛋白的表达升高。
综上所述,心肌细胞给予高脂刺激能够抑制细胞的增殖,并且会导致细胞内ROS的增加,激活心肌细胞内ERS通路,从而促进细胞凋亡。Cur-NPs可以有效恢复细胞增殖率,降低氧化损伤,抑制ERS通路的激活,最终减少细胞凋亡,起到保护心肌细胞的作用。说明Cur-NPs能成功逆转高脂诱导的心肌细胞损伤,其作用机制与ERS通路密切相关。