慢性不可预见性温和应激对大鼠海马星形胶质细胞凋亡的影响
金齐颖,吴红芳,张园园,马原源,邓春颖,刘 昊
目前,全球抑郁症患者约有三亿五千万,是导致自杀、残疾和疾病负担的重要原因[1],其发病机制尚未完全明确。海马是参与学习、记忆及情绪调节的重要边缘系统脑区,其改变在各种应激疾病中起到关键作用。研究[2-3]显示,抑郁症大鼠和抑郁症患者海马部位均存在明显的萎缩。在中枢神经系统中,星形胶质细胞数量最多,人们认识到其作用不仅仅是营养、支持等辅助作用,还参与脑的高级功能活动,是中枢神经系统必不可少的组成部分[4]。胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)能够用来特异性标记成熟的星形胶质细胞,被广泛应用于抑郁症发病机制的研究中[5]。研究[6]表明抑郁大鼠海马神经元存在凋亡,然而,海马星形胶质细胞是否存在凋亡现象,目前尚未见报道。该实验建立慢性不可预见性温和应激(chronic unpredicted mild stress,CUMS)模型,检测海马星形胶质细胞是否存在凋亡,探究抑郁症发病过程中海马体积异常的原因。
1 材料
1.1实验动物成年雄性SD大鼠90只,清洁级,体质量180~200 g,华北理工大学实验动物中心提供。适应性饲养1周后用于实验。饲养条件:22~25 ℃,3~5只每笼,昼夜节律(12 h/12 h),自由饮水进食。
1.2主要试剂GFAP、小鼠抗大鼠β-actin单克隆抗体、驴抗羊荧光二抗、驴抗兔荧光二抗、兔抗小鼠单克隆抗体均购自美国Santa Cruz公司;兔抗半胱氨酸天冬氨酸蛋白酶-3(cysteine-containing aspartate-specific proteases-3,Caspase-3)多克隆抗体、兔抗Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax)多克隆抗体、兔抗B细胞淋巴瘤/白血病-2(B-cell lymmpoma/leukemia-2,Bcl-2)多克隆抗体、羊抗兔单克隆抗体购自美国ProteinTech公司;Western blot和免疫荧光相关试剂购自武汉博士德生物有限公司。
1.3方法
1.3.1动物分组及模型建立 按照随机数字表法将90只SD大鼠随机分为对照组(45只)和模型组(45只),模型制备成功后又随机分为1、7、14 d 3个亚组(每组15只)。模型组给予CUMS。应激包括11种:4 ℃冰水游泳5 min,鼠笼45°倾斜24 h,禁食24 h,42 ℃热水游泳5 min,束缚2 h,潮湿垫料24 h,夹尾90 s,禁水24 h,双耳电击5 s两次(0.8 mA),鼠笼摇动15 min,持续光照24 h。在28 d内每天随机给予一种刺激,同种刺激不连续出现。对照组大鼠除每天抓取一次外,不做任何特殊处理。在应激结束后,分别于1、7、14 d处死大鼠。
1.3.2行为学检测
1.3.2.1糖水偏好实验 实验前大鼠进行禁食水24 h,每个鼠笼放置两个完全相同的水瓶,纯净水和1%的蔗糖水各200 ml,双瓶共饮,实验前确保饮水瓶不滴漏。测量1 h内纯净水和蔗糖水的消耗量。计算糖水偏好率:糖水偏好率(%)=糖水消耗量/总液体消耗量×100%。
1.3.2.2旷场实验 造模结束后,在每天相同的时间段将大鼠放在长120 cm、宽120 cm、高35 cm的场所的中心方格中,运用鼠博士视频分析系统记录,包括5 min内大鼠行走总路程,中央活动时间,站立次数,修饰行为等。
1.3.2.3Morris水迷宫实验 连续3 d记录大鼠在120 s内找到水下平台需要的时间,即逃避潜伏期(escape latent,EL),最后用Morris水迷宫软件对结果进行分析。
1.3.3Western blot法检测海马Bax、Bcl-2和Caspase-3蛋白的表达 将大鼠麻醉后断头取脑,冰上快速分离海马,提取组织总蛋白。BCA定量后按照30 μg蛋白量上样,进行12%SDS-PAGE电泳,PVDF膜电转印,脱脂奶粉封闭,一抗兔抗Caspase-3多克隆抗体(1 ∶500)、兔抗Bax多克隆抗体(1 ∶500),兔抗Bcl-2多克隆抗体(1 ∶500)及小鼠抗大鼠β-actin单克隆抗体(1 ∶5 000),4 ℃孵育过夜,二抗羊抗兔IgG(1 ∶5 000)室温孵育1 h,ECL显色。同样的方法进行内参β-actin的Western blot分析。以目的条带与内参的光密度比值表示目的蛋白的相对表达量。
1.3.4免疫荧光双标 大鼠麻醉后,进行灌流固定,取脑组织,常规制作石蜡切片。切片脱蜡至水,抗原修复后,免疫组化笔划圈,0.4% PBS-Triton室温孵育15 min,驴血清封闭1 h,加入一抗(兔抗Caspase-3多克隆抗体与羊抗GFAP混合液、或兔抗Bax多克隆抗体与羊抗GFAP一抗混合液、或兔抗Bcl-2多克隆抗体与羊抗GFAP一抗混合液),4 ℃孵育过夜,阴性对照用PBS代替一抗,次日室温孵育45 min,加入Alexa Fluor594标记的驴抗兔二抗和Alexa Fluor488标记的驴抗羊二抗混合液,封片剂封片,放置于避光盒内,激光共聚焦显微镜观察摄片。

2 结果
2.1糖水偏好实验对照组与模型组的普通水消耗量两组差异无统计学意义(P>0.05)。对照组和模型组大鼠糖水偏好率两组差异有统计学意义(P<0.01)。模型组大鼠糖水消耗量和糖水偏好率低于对照组。见表1。

表1 两组大鼠糖水偏好结果
与对照组比较:**P<0.01
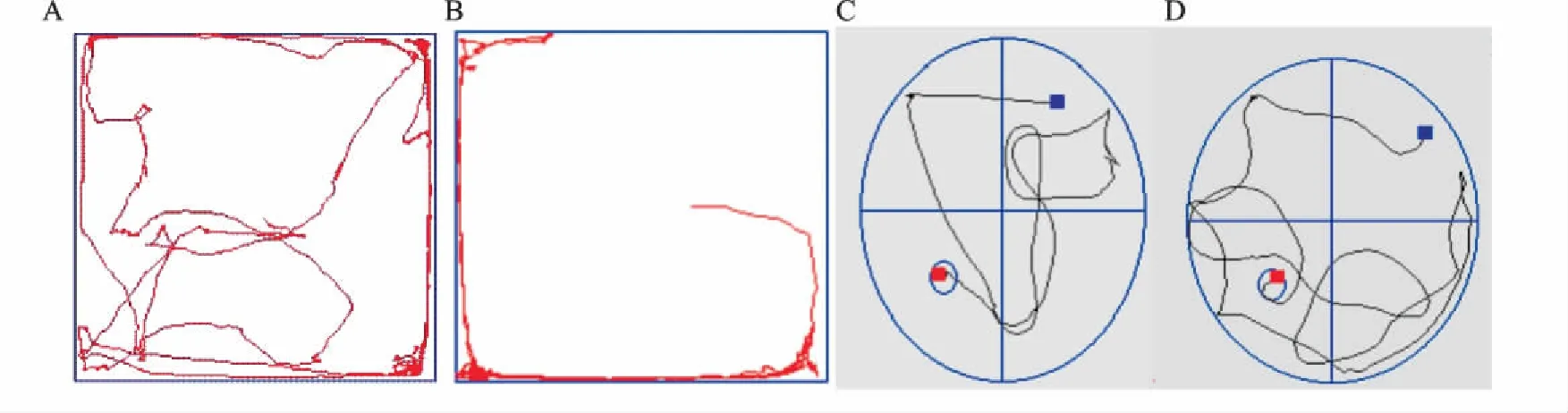
图1 两组大鼠旷场实验和Morris水迷宫实验轨迹图
A:对照组旷场实验轨迹图;B:模型组旷场实验轨迹图;C:对照组Morris水迷宫实验轨迹图;D:模型组Morris水迷宫实验轨迹图

表2 两组大鼠旷场实验和 Morris 水迷宫实验结果
与对照组比较:**P<0.01
2.2旷场实验和水迷宫实验模型组大鼠行走总路程、中央活动时间、直立次数、和修饰行为次数均低于对照组,差异有统计学意义(P<0.01)。模型组大鼠平均逃避潜伏期较对照组明显延长,差异有统计学意义(P<0.01)。见表2、图1。
2.3各组大鼠海马Bax、Bcl-2和Caspase-3蛋白表达情况根据条带分析显示,与对照组比较,CUMS后1、7、14 d大鼠海马Caspase-3、Bax蛋白表达水平均升高(P<0.05),7 d时升高最明显。与对照组比较,CUMS后1、7、14 d大鼠海马Bcl-2蛋白表达水平降低(P<0.05)。模型组大鼠Bax/Bcl-2较对照组升高(P<0.05)。结果见图2、表3。

图2 Western blot法检测海马Bax、Bcl-2和Caspase-3蛋白表达

组别BaxBcl-2Caspase-3Bax/Bcl-2对照0.63±0.121.05±0.150.55±0.120.60±0.04CUMS 1 d0.95±0.17∗1.02±0.16∗0.99±0.22∗0.93±0.03∗ 7 d1.38±0.30∗0.89±0.16∗1.59±0.40∗1.54±0.99∗ 14 d0.92±0.25∗0.45±0.07∗0.86±0.15∗2.07±0.42∗F值13.6927.3822.1965.01
与对照组比较:*P<0.05
2.4免疫荧光双标GFAP为Alexa Fluor488激发的绿色荧光,Bax、Bcl-2和Caspase-3均为Alexa Fluor594激发的红色荧光,图像融合后可见黄色荧光,表明GFAP 和Bax、GFAP和Bcl-2、GFAP和 Caspase-3均有共定位表达。CUMS后7 d模型组大鼠海马Bax阳性细胞及荧光融合均多于对照组,见图3。CUMS后7 d模型组大鼠海马Bcl-2阳性细胞及荧光融合均少于对照组,见图4。CUMS后7 d模型组大鼠海马Caspase-3阳性细胞及荧光融合均多于对照组,见图5。
3 讨论
抑郁症是一种常见的神经精神疾病,主要表现为持续的情绪低落、无价值感、认知功能的改变等,严重时常伴有自杀倾向[7],目前病因及发病机制尚未完全明确。建立正确的抑郁症动物模型是抑郁症实验研究成功的关键。相关资料表明,大鼠的寿命约为2~3年,大鼠经历7 d约为人类的1年[8],通过给予模型组大鼠CUMS刺激,可以模拟人们现实生活中经受的慢性、间断性、低强度的刺激后出现的症状[9]。本实验行为学检测结果表明,模型组大鼠糖水消耗量和糖水偏好百分比明显降低,旷场实验得分明显减低,逃避潜伏期明显延长,提示经过CUMS刺激后,大鼠表现出明显的快感缺失、自主探究行为减少、探索能力下降、空间学习记忆能力减退,成功地模拟了抑郁症患者的主要症状。本实验选取CUMS后1、7、14 d模拟人类患抑郁症后1、2、3年后凋亡相关因子的变化,为抑郁症的治疗提供新的理论依据。
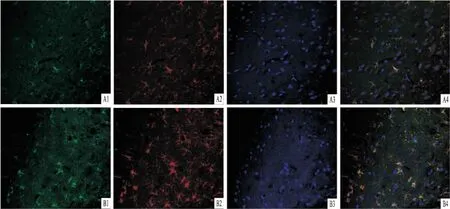
图3 免疫荧光双标法检测大鼠海马组织中Bax的表达 ×400

图4 免疫荧光双标法检测大鼠海马组织中Bcl-2的表达 ×400

图5 免疫荧光双标法检测大鼠海马组织中Caspase-3的表达 ×400
本课题组前期对抑郁症大鼠海马体积缩小的原因进行研究[10-12]显示,海马神经元存在明显的凋亡、自噬及神经可塑性等改变。星形胶质细胞广泛分布于中枢神经系统中,在神经元营养支持、神经组织的修复及再生、血脑屏障的形成及维持内环境的稳定、神经递质的摄取、突触的传递、神经免疫等方面起着十分重要的作用[13-14]。GFAP是特异性表达于星形胶质细胞的一种III型中间丝蛋白,分子量为50~52 ku,GFAP基因位于17号染色体上(17q21),其表达水平与星形胶质细胞活化呈正比,是星形胶质细胞公认的标志性蛋白,可能与其特异性的末端氨基酸序列有关[15-16],因此本实验采用免疫荧光标记的方法检测星形胶质细胞的表达情况。
细胞凋亡是指为维持内环境稳定,细胞在多种因素作用下发生的自主性、程序性的细胞死亡方式,受到凋亡调控蛋白调控。Bax为Bcl-2家族的促凋亡基因,Bax为胞浆蛋白,自身可形成同源二聚体,当细胞受到刺激时破坏线粒体外膜,使其通透性增大,帮助细胞色素C穿过线粒体膜,激活Caspase-9,进而激活Caspase-3,加速细胞凋亡。Bcl-2为Bcl-2家族的抑凋亡基因,Bcl-2通过抑制促凋亡蛋白的释放、抑制Caspase激活,稳定细胞内Ga2+、抗氧化、抑制Bax的细胞毒性等机制发挥作用。Bax/Bcl-2的比值决定了细胞的生存和死亡。Caspase-3是细胞凋亡最关键的效应蛋白酶,是多种凋亡刺激信号的最终汇集点,被称为“细胞凋亡的执行者”[17-18]。本实验结果表明,模型组大鼠海马中Bax表达上升,Bcl-2表达下降,Bax/Bcl-2比值上升,说明CUMS能够上调促凋亡蛋白Bax水平,下调抑凋亡蛋白Bcl-2水平,提高Bax/Bcl-2比值,能够有效促进神经细胞凋亡,从而导致海马体积萎缩,促使大鼠表现出抑郁状态。
本研究显示,对照组和模型组GFAP和Bax、GFAP和Caspase-3均可见共定位表达,模型组较对照组二者融合更广泛。同样,对照组和模型组GFAP和Bcl-2也可见共定位表达,但模型组二者融合明显少于对照组。表明抑郁大鼠海马星形胶质细胞的凋亡增加,可能参与了抑郁症大鼠海马体积的萎缩。然而细胞凋亡存在3种信号转导途径,受多种基因调控,本实验仅探讨了凋亡相关蛋白Bax、Bcl-2和Caspase-3的表达变化情况,更多的凋亡机制及抑郁症患者海马体积异常的原因有待更深入的研究。

