沙冬青种子总黄酮对免疫抑制小鼠免疫功能及胸腺和脾超微结构的影响
黄伟宽,刘瑞菊,贾 宁*,方 梅,陶 波,3,张嘉男,梁鹏飞,邓 康
(1.甘肃农业大学动物医学院,兰州 730070;2.山东省寿光市营里镇畜牧兽医管理站,寿光 262700;3.临夏现代职业学院,临夏 731100)
黄酮类化合物(flavonoids)是指两苯环(A环与B环)通过 C3 联接而成的一系列化合物,其广泛分布于芸香科、菊科、玄参科等科属的植物中。已有研究表明[1-3],黄酮类化合物具有抗病毒、免疫调节、抗肿瘤、抗氧化、抗炎等多种生物学活性,已成为天然药物中重要的生物活性成分之一。
沙冬青(Ammopiptanthus)为豆科旱生植物,是亚洲荒漠区所特有的常绿灌木,有蒙古沙冬青(A.mongolicus)和新疆沙冬青(A.nanus)2个物种[4]。在我国,沙冬青主要分布于内蒙古、宁夏、甘肃等地[4-5]。已有研究证明,沙冬青种子中含有较丰富的黄酮类化合物,沙冬青种子总黄酮是从沙冬青种子中分离、提取的总酮。陈慧等、周建胜等[4-5]分别报道了沙冬青种子总黄酮的抗病毒活性。陶波等[6]初步报道了沙冬青种子总黄酮具有重要的免疫活性。但到目前为止,有关沙冬青种子总黄酮对免疫抑制动物的免疫功能调节和免疫器官超微结构的影响尚未见报道。本研究旨在深入探索沙冬青种子总黄酮对免疫抑制小鼠免疫功能的调节作用和对其胸腺、脾超微结构的影响,从而为充分有效地利用和开发沙冬青资源,寻找安全、可靠、纯天然新型兽用免疫增强和调节剂,提供十分重要的基础资料和形态学依据。
1 材料与方法
1.1 材料
沙冬青种子:购自甘肃省民勤县种子公司,经洗净、晒干、粉碎备用。沙冬青种子总黄酮:由中国农业科学院兰州畜牧与兽药研究所分离、提取与纯化,结合陈慧等[4]及陶波等[6]的纯化方案,经反复纯化,最终纯化物中总黄酮含量为86.87%。
1.2 主要仪器与试剂
JA2003N型电子天平(北京北科恒信科学器材有限公司);Multiskan MK3型酶标仪(美国);MSP-1S型数字化扫描电子显微镜(日本);FD-1B-50真空冷冻干燥机(北京博医康实验仪器有限公司);KQ-300DE型数据超声波清洗器(昆山市超声仪器有限公司);DFT-250手提式高速万能粉碎机(温岭市林大机械有限公司);IL-2、IL-4检测试剂盒(北京安迪华泰科技有限公司);环磷酰胺(CTX)(试剂级,大连美仑生物技术有限公司)。戊二醛、羧甲基纤维素钠、叔丁醇等试剂均为国产分析纯。
1.3 试验动物分组与试验
100只20日龄清洁级昆明种小鼠购自中国农业科学院兰州兽医研究所实验动物中心,体重18~21 g。 饲养于清洁的动物房,自由采食和饮水,自然光照,室温在22 ℃左右。进行3 d适应观察后分组。
将100只小鼠随机分成5组(雌雄各半):空白对照组、免疫抑制组、试验Ⅰ组、试验Ⅱ组和试验Ⅲ组,每组20只(雌雄各半)。动物分组后,分2步进行动物试验:
全部动物试验共计28 d。前7 d,空白对照组小鼠灌胃0.6 mL·d-1生理盐水,免疫抑制组、试验Ⅰ组、试验Ⅱ组与试验Ⅲ组小鼠均灌胃0.6 mL CTX溶液[剂量40 mg·(kg·d)-1]。后21 d,除空白对照组小鼠继续灌胃生理盐水外,免疫抑制组小鼠改灌胃0.6 mL·d-1生理盐水,试验Ⅰ组小鼠改灌胃0.6 mL总黄酮溶液[剂量50 mg·(kg·d)-1], 试验Ⅱ组小鼠改灌胃0.6 mL总黄酮溶液[剂量150 mg·(kg·d)-1],试验Ⅲ组小鼠改灌胃0.6 mL总黄酮溶液[剂量250 mg·(kg·d)-1]。试验期间所有小鼠自由采食和饮水,仔细观察小鼠状况(活动、精神、采食、饮水等),每天称小鼠体重。末次给药24 h后,分别进行碳粒廓清试验、脏器指数测定、血清IL-2和IL-4含量测定。同时,采集小鼠胸腺和脾,2.5%戊二醛固定,待制备扫描电镜样品。
1.4 碳粒廓清指数和胸腺、脾指数测定
末次给药24 h后,对小鼠空腹称重,然后给小鼠尾静脉注射印度墨汁(0.01 mL·g-1),分别在2(T1)、12 min(T2)后摘眼球采血,然后迅速加入4 mL 0.1%Na2CO3充分摇匀后,以0.1% Na2CO3溶液作为空白对照,在630 nm波长下测定吸光值(OD),用以下公式分别计算碳粒廓清指数(K)、吞噬指数(α)的值:
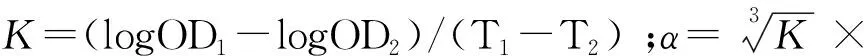
采血后,剖检小鼠,取肝、胸腺和脾,除去多余结缔组织和脂肪,称重计算胸腺(A)和脾(B)指数:
A=小鼠胸腺质量/小鼠空腹体重;B=小鼠脾质量/小鼠空腹体重。
1.5 血清IL-2、IL-4测定
末次给药24 h后,摘眼球采血置于2 mL无抗凝剂EP管中,室温静置15 min使其凝固,2 000 r·min-1离心 20 min。收集上层血清,将其分装后置-20 ℃冰箱冻存,待测血清样本中细胞因子。IL-2和IL-4测定,严格按照检测试剂盒说明进行操作,在450 nm 波长下测定吸光度值(OD),将测定数据进行统计分析。
1.6 扫描电镜样本制备与观察
小鼠剖检后,采集胸腺和脾,用锋利刀片将胸腺和脾切成0.3 cm×0.5 cm大小的方块,采用生理盐水清洗组织块表面的血污,再放入盛有2.5%戊二醛小瓶内固定12 h。然后,倒掉戊二醛,用生理盐水清洗瓶内的组织2~3次(将遗留在组织上的戊二醛洗净)。洗净组织后,用30%、50%、70%、80%、90%、100%的乙醇依次梯度脱水,各乙醇浓度脱水时间均为1 h。脱水后,将乙醇倒出,向瓶内加入叔丁醇,放置于-20 ℃的冰箱内冷冻2 h,再进行冷冻真空干燥24 h。采用数字扫描电子显微镜观察、拍照,同时,每个扫描电镜样本在放大1 000倍下,随机选择5个视野,计数淋巴细胞数,计算平均值。
1.7 数据处理
2 结 果
2.1 沙冬青种子总黄酮对免疫抑制小鼠胸腺和脾指数的影响
根据测定结果显示(表1),免疫抑制组小鼠胸腺指数、脾指数平均数分别为(2.13±0.17)和(3.24±0.36) mg·g-1,其数值显著低于对应空白对照组,差异极显著(P<0.01)。证明CTX对小鼠脾、胸腺的生长发育产生了明显抑制作用,免疫抑制模型的复制是成功的。与免疫抑制组比较,沙冬青种子总黄酮试验Ⅰ组、试验Ⅱ组和试验Ⅲ组小鼠胸腺指数、脾指数平均数均明显增高,增高程度不尽相同。尤其试验Ⅱ组[总黄酮灌胃剂量150 mg·(kg·d)-1]小鼠胸腺指数、脾指数平均数增高最显著,分别达到(3.26±0.22)和(4.63±0.57) mg·g-1,与免疫抑制组比较差异极显著(P<0.01)。
2.2 沙冬青种子总黄酮对免疫抑制小鼠碳粒廓清指数和吞噬指数的影响
测定结果显示(表2),免疫抑制组小鼠碳粒廓清指数和吞噬指数平均数分别为0.01±0.00和3.98±0.16,其数值显著低于对应空白对照组,差异也极显著(P<0.01)。证明CTX对小鼠巨噬细胞的产生及其吞噬功能产生了明显抑制作用,也表明免疫抑制模型复制成功。沙冬青种子总黄酮试验Ⅰ组、试验Ⅱ组和试验Ⅲ组小鼠的碳粒廓清指数和吞噬指数平均数与免疫抑制组小鼠比较则有不同程度提高。尤其试验Ⅱ组[总黄酮灌胃剂量150 mg·(kg·d)-1]小鼠碳粒廓清指数和吞噬指数平均数提高最显著,分别达到0.02±0.01和4.69±0.33,与免疫抑制组比较差异极显著(P<0.01)。
2.3 沙冬青种子总黄酮对免疫抑制小鼠血清IL-2、IL-4含量的影响
测定结果显示(表3),免疫抑制组小鼠血清IL-2、IL-4含量分别为(466.50±52.32)和(35.68±2.10) pg·mL-1,其含量显著低于对应空白对照组,差异极显著(P<0.01)。证明CTX对小鼠免疫功能产生明显抑制,导致血清IL-2、IL-4含量大大降低。沙冬青种子总黄酮试验Ⅰ组、试验Ⅱ组和试验Ⅲ组小鼠血清IL-2、IL-4含量与免疫抑制组小鼠比较也有不同程度升高。尤其试验Ⅱ组[总黄酮灌胃剂量150 mg·(kg·d)-1]小鼠血清IL-2、IL-4含量升高最突出,分别达到(541.30±33.41)和(44.82±2.26)pg·mL-1,与免疫抑制组比较差异极显著(P<0.01)。
表1 沙冬青种子总黄酮对免疫抑制小鼠脾和胸腺指数的影响
与空白对照组比较,ΔΔ.P<0.01;与免疫抑制组比较,*.P<0.05,**.P<0.01
Compared with normal control group,ΔΔ.P<0.01; Compared with immunosuppression group,*.P<0.05,**.P<0.01
表2 沙冬青种子总黄酮对免疫抑制小鼠巨噬细胞及其吞噬功能的影响
与空白对照组比较,ΔΔ.P<0.01;与免疫抑制组比较,*.P<0.05,**.P<0.01
Compared with normal control group,ΔΔ.P<0.01; Compared with immunosuppression group,*.P<0.05,**.P<0.01
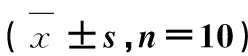
表3 沙冬青种子总黄酮对免疫抑制小鼠血清IL-2、IL-4含量的影响
与空白对照组比较,ΔΔ.P<0.01;与免疫抑制组比较,*.P<0.05,**.P<0.01
Compared with normal control group,ΔΔ.P<0.01; Compared with immunosuppression group,*.P<0.05,**.P<0.01
2.4 沙冬青种子总黄酮对免疫抑制小鼠胸腺超微结构的影响
小鼠胸腺髓质扫描电镜观察(表4,图1)显示,胸腺淋巴细胞呈圆形或不正圆形。免疫抑制组小鼠胸腺淋巴细胞数量与对应空白对照组比较明显减少(P<0.01),且淋巴细胞排列明显稀疏、散乱,许多淋巴细胞与周围间质脱离,使局部间质形成许多凹陷或空洞。同时,与空白对照组比较,免疫抑制模型组小鼠胸腺小叶体积明显缩小,小叶间隔内纤维结缔组织增多。因此,从形态学上证明CTX对小鼠胸腺的发育和淋巴细胞的成熟产生明显抑制。
沙冬青种子总黄酮试验Ⅰ组、试验Ⅱ组和试验Ⅲ组小鼠胸腺淋巴细胞数量与免疫抑制模型组小鼠胸腺比较都有不同程度增加。尤其试验Ⅱ组[总黄酮灌胃剂量150 mg·(kg·d)-1]小鼠胸腺淋巴细胞的数量显著增加,与免疫抑制组比较差异极显著(P<0.01)。同时,与免疫抑制模型组小鼠比较,试验Ⅱ组小鼠胸腺组织发育最好,小叶明显增大、清晰,淋巴细胞排列紧密,与周围组织之间间隙明显减少,很少出现淋巴细胞从周围组织脱落现象,在同样放大倍数下,淋巴细胞体积相对较大,成熟较好。
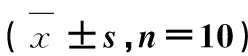
表4 沙冬青种子总黄酮对免疫抑制小鼠胸腺、脾淋巴细胞增殖的影响
与空白对照组比较,ΔΔ.P<0.01;与免疫抑制组比较,*.P<0.05,**.P<0.01.电镜观察倍数1 000×
Compared with normal control group,ΔΔ.P<0.01; Compared with immunosuppression group,*.P<0.05,**.P<0.01.Magnification ti mes, 1 000×
2.5 沙冬青种子总黄酮对免疫抑制小鼠脾超微结构的影响
小鼠脾扫描电镜观察(表4,图2)显示,小鼠脾脾索与脾窦相间排列。脾索内,网状细胞凸起相互连接呈网状支架,其上有不同发育阶段淋巴细胞、红细胞和巨噬细胞等贴附于网状支架上。脾窦由棱形或短杆状内皮细胞平行排列构成。与胸腺扫描电镜相似,免疫抑制组小鼠脾淋巴细胞数量与空白对照组比较明显减少(P<0.01),且淋巴细胞排列稀疏、散乱、体积相对较小,许多淋巴细胞从网状支架脱落,使局部间质网状支架裸露,形成许多孔洞或只有红细胞附着,甚至间质网状支架内纤维结缔组织增生。观察结果也从形态学上证明CTX对小鼠脾的发育和淋巴细胞的成熟产生明显抑制作用。
沙冬青种子总黄酮试验Ⅰ组、试验Ⅱ组和试验Ⅲ组小鼠脾淋巴细胞和巨噬细胞数量与免疫抑制组小鼠脾比较均有不同程度增加。尤其试验Ⅱ组[总黄酮灌胃剂量150 mg·(kg·d)-1]小鼠脾淋巴细胞数量的增加最为显著,与免疫抑制组比较差异极显著(P<0.01),且淋巴细胞排列紧密,与周围间质网状支架间隙明显减少,也很少出现淋巴细胞脱落现象,淋巴细胞体积相对较大,成熟良好。
3 讨 论
3.1 免疫抑制及环磷酰胺诱导小鼠免疫抑制
动物机体的免疫系统是由非特异性免疫、体液免疫和细胞免疫共同构成的防御体系。正常机体免疫系统可通过识别、吞噬、抗原呈递、激活淋巴细胞、分泌细胞因子、产生相应抗体等多种方式对入侵机体的病原微生物和体内产生的异常细胞等进行清除和杀灭[7-9]。因此,机体免疫系统的状况在维持机体内环境稳定和各器官功能正常发挥中具有十分重大的意义。免疫抑制是机体非特异免疫功能异常的一种现象,表现为机体免疫系统对抗原信息的刺激应答反应迟缓、滞后,甚至不产生应答反应。免疫抑制动物从免疫器官的发育,到体内各种免疫功能指标均大大低于正常动物[10-13]。已有研究表明[9-11,14-15],动物机体免疫器官质量的降低是免疫器官被抑制,功能降低的重要表现。Corbin等[14]研究认为,采用脾等免疫器官的质量能可靠判定免疫系统活力和强度。此外,单核巨噬细胞系统对外来病原和异物的吞噬和清除功能则是机体非特异性免疫反应的重要特征。IL-2和IL-4是重要的淋巴细胞因子,其在血清中含量的多少反映出机体淋巴细胞活性和细胞免疫功能的强弱[15-21]。

a1、a2、a3. 空白对照组(1 000×、2 500×和5 000×);b1、b2、b3. 免疫抑制组(1 000×、2 500×和5 000×);c1、c2、c3. 试验Ⅱ组[总黄酮灌胃剂量150 mg·(kg·d)-1](1 000×、2 500×和5 000×)。与空白对照组比较,免疫抑制组脾淋巴细胞明显减少,间质网状支架裸露;试验Ⅱ组与免疫抑制组比较,脾淋巴细胞则明显增多、成熟,且排列紧密a1, a2, a3. Normal control group (1 000×, 2 500× and 5 000×);b1, b2, b3. Immunosuppression group (1 000×, 2 500× and 5 000×);c1, c2, c3. Test groupⅡ (1 000×, 2 500× and 5 000×). Compared with the normal control group,the lymphocytes are reduced greatly in immunosuppressed mice spleen of the immunosuppression group,and the interstitial reticular scaffold are exposed. Compared with the immunosuppression group,the number of mature lymphocytes in mice spleen increased significantly in the test groupⅡ图2 沙冬青种子总黄酮对免疫抑制小鼠脾超微结构的影响Fig.2 Effect of total flavonoids from Ammopiptanthus mongolicus on the ultrastructure of spleen in immunosuppressed mice
环磷酰胺(CTX)是已知的化学免疫抑制剂,采用CTX可建立免疫抑制动物模型[15]。本试验研究中,给小鼠灌胃 CTX[40 mg·(kg·d)-1]一周后,也建立起了良好的小鼠免疫抑制模型。与空白对照组比较,免疫抑制组小鼠从脾和胸腺指数、碳粒廓清指数和吞噬指数到血清IL-2和IL-4含量均极显著低于空白对照组(P<0.01)。试验再次证明,采用CTX灌胃给药后,导致小鼠免疫器官发育受阻和免疫功能严重低下,建立起了良好的小鼠免疫抑制模型。
3.2 沙冬青种子总黄酮对免疫抑制小鼠免疫功能的影响
已有研究表明[1-11,14-17],黄酮类化合物具有免疫增强和调节作用。黄酮类化合物可以通过促进巨噬细胞和淋巴细胞的成熟与活化来提高机体的免疫功能。淫羊藿总黄酮(TFE)可明显增强氢化可的松和羟基脲所致免疫抑制模型小鼠体内巨噬细胞的活性和吞噬功能[1-2]。槲皮素(黄酮)可以促进氢化可的松免疫抑制模型小鼠体内淋巴细胞增殖,显著提高小鼠体内IL-2的产生和活性,对免疫抑制具有明显改善[1-2,9,11,19]。本研究发现,沙冬青种子总黄酮能显著提高CTX诱导的免疫抑制小鼠的胸腺指数、脾指数、碳粒廓清指数、吞噬指数以及血清IL-2和IL-4含量,尤其在总黄酮灌胃剂量150 mg·(kg·d)-1时,免疫抑制小鼠的上述测定指标均得到了显著改善和提高,与免疫抑制组小鼠差异极显著(P<0.01)。研究结果证实,沙冬青种子总黄酮可明显促进和改善免疫抑制小鼠免疫功能的恢复。其中,试验Ⅱ组[总黄酮灌胃剂量150 mg·(kg·d)-1]的改善和促进作用最突出。同时,在一定灌胃剂量范围内,沙冬青种子总黄酮促进和改善免疫抑制小鼠免疫功能的作用效果随总黄酮灌胃剂量的增加而升高,呈正相关性,如从试验Ⅰ组[总黄酮灌胃剂量50 mg·(kg·d)-1]到试验Ⅱ组[总黄酮灌胃剂量150 mg·(kg·d)-1]各项免疫功能检测指标均随总黄酮作用剂量的增加而升高。当沙冬青种子总黄酮灌胃剂量超出一定范围后,如试验Ⅲ组[总黄酮灌胃剂量250 mg·(kg·d)-1],各项免疫功能检测指标并不随灌胃剂量的增加而进一步升高,表明沙冬青种子总黄酮对免疫抑制小鼠免疫功能的改善作用有其最适作用剂量。
3.3 沙冬青种子总黄酮对免疫抑制小鼠免疫器官结构的影响
胸腺(thymus)是动物机体重要的中枢淋巴器官,而脾(spleen)是动物机体内最大的淋巴器官。大量资料显示[8-11,14-19],胸腺和脾在动物机体正常免疫功能的建立和免疫功能受损之后的修复和改善中起着十分重要的作用。胸腺实质主要由上皮性网状细胞构成支架,其内含大量不同分化阶段的淋巴细胞(胸腺细胞)[11,16]。脾是血液循环中的重要滤过器官,脾索内网状细胞凸起呈丝状连接,其上有不同发育阶段的血细胞;内皮细胞围成的脾窦内也有大量不同发育阶段的血细胞[11,15-16]。已有研究表明[11,16],CTX可使免疫抑制小鼠免疫器官淋巴细胞数目明显减少。本研究也观察到,免疫抑制组小鼠胸腺和脾实质中淋巴细胞数量与对应空白对照组比较都极显著减少(P<0.01),且淋巴细胞排列稀疏、散乱,甚至与周围间质脱离致局部形成凹陷或孔洞等,后期间质结缔组织增生。因此,从超微结构证实胸腺和脾成熟淋巴细胞数量的大大减少是免疫抑制小鼠免疫功能低下的形态学基础之一。
王洪武等[8]研究表明,淫羊藿总黄酮是通过大量增加脾中淋巴细胞和巨噬细胞等免疫相关细胞的数量来改善和提高免疫抑制小鼠的免疫功能。本试验研究也表明,沙冬青种子总黄酮对免疫抑制小鼠胸腺、脾的发育具有明显改善和促进作用,可显著促进胸腺、脾淋巴细胞的显著增殖和成熟。其中,在试验Ⅱ组[总黄酮灌胃剂量150 mg·(kg·d)-1],小鼠胸腺与脾成熟淋巴细胞的数量显著增多,与免疫抑制组比较差异极显著(P<0.01),且组织结构也得到极大的恢复和改善,淋巴细胞排列紧密,与周围间质间隙明显减少,淋巴细胞脱落现象明显减少等。
因此,综合分析以上结果,沙冬青种子总黄酮对免疫抑制小鼠免疫功能具有明显改善、恢复和促进作用,这种作用是通过促进免疫器官淋巴细胞的增殖和成熟,修复受损免疫器官组织结构来实现。同时,沙冬青种子总黄酮的上述作用效果在一定范围内呈剂量依赖效应。而关于沙冬青种子总黄酮如何诱导免疫抑制小鼠胸腺、脾淋巴细胞增殖和成熟的机制还有待深入研究。
4 结 论
沙冬青种子总黄酮可通过促进免疫器官淋巴细胞的增殖和成熟,修复受损免疫器官组织结构来改善和促进免疫抑制小鼠免疫功能的恢复。沙冬青种子总黄酮的免疫增强作用在一定范围内具有剂量依赖效应。
——致坚守奋斗的你

