内镜黏膜下剥离术辅助诊治原发性胃淋巴瘤的效果研究
黄神安,钱霞,张丽华,尚红卫,熊萍,方念
本研究意义:
消化系统肿瘤严重危害健康,原发性胃淋巴瘤(PGL)诊断较为困难,但治疗、预后与结内非霍奇金淋巴瘤、胃癌不同。内镜黏膜下剥离术(ESD)可以切到黏膜下层,得到所需要的完整大块的标本行组织学和免疫病理学检查,从而提高诊断正确率,目前关于使用微创技术ESD来辅助诊断及治疗PGL的研究尚未见报道。应用ESD切除标本行病理检查对PGL的准确诊断及卫生防治工作意义重大,对患者的健康及有限的医疗资源均有重要的意义。
原发性胃淋巴瘤(primary gastric lymphoma,PGL)是结外非霍奇金淋巴瘤最常发生的部位[1],在胃肿瘤中的发生率仅次于胃癌[2],其源于黏膜下层,发病率近年呈上升趋势。PGL临床表现及胃镜下形态无特异性[3],早期及时诊断较困难,容易误诊,但其治疗方法和疾病转归与一般胃癌完全不同。一般胃镜下诊断正确率仅为23.8%,胃镜联合常规活组织检查免疫组化(IHC)染色诊断正确率为64.3%[4]。因为PGL浸润较深,常规活组织检查难度较大,一般只能取到黏膜层,很难取到黏膜下层。但内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)切除深度可达到黏膜下层甚至固有肌层。为避免误诊,本研究使用ESD辅助诊治PGL,以期为患者的精准治疗提供依据。
1 资料与方法
1.1 一般资料 纳入标准:(1)临床及胃镜检查诊断为可疑PGL;(2)符合DAWSON等[5]提出的诊断标准,要求患者无浅表淋巴结肿大,血常规、胸部X线片、上腹部CT未见明显异常。选取2014年10月—2017年7月在南昌大学第三附属医院诊治的可疑PGL患者16例,其中,男11例,女5例;年龄28~75岁,平均年龄为49岁。研究对象均知情同意,本研究经南昌大学第三附属医院伦理委员会批准。
1.2 诊疗方法 采用奥林巴斯GIF-XQ260电子胃镜对所有患者病灶进行观察,并行多点深挖掘式活组织检查,活组织检查后行病理诊断。与患者及家属沟通,告知多点深挖掘式活组织检查阳性者追加行ESD挖除标本后行病理诊断PGL的重要性,告知阴性者PGL诊断明确的重要性以及ESD切除标本行病理检查的先进性。
患者及家属同意行ESD后,选择易于行ESD的部位及病变部位行ESD,PGL病变分布具有多灶性,一般选择易行ESD的部位—胃窦;术后标本进行病理诊断。ESD过程:(1)标记:用氩气刀在病灶周围进行电凝标记,距黏膜病灶边缘0.5~1.0 cm;(2)黏膜下注射:将注射液(由5 ml靛胭脂、1 ml肾上腺素和100 ml 0.9%氯化钠溶液配制而成)于病灶边缘标记点外侧进行多点黏膜下注射,2 ml/点,可重复注射直至病灶明显抬起;(3)切开病变外侧缘黏膜:用海博刀或勾刀沿病灶边缘标记点外侧缘切开病灶黏膜;(4)剥离病变:借助透明帽,应用海博刀或勾刀于病灶下方对黏膜下层进行剥离,剥离中反复黏膜下注射,始终保持剥离层次在黏膜下层,剥离中通过拉镜或旋镜沿病变基底切线方向进行剥离;(5)创面处理:包括创面血管处理与边缘检查,通常采用ERBE高频电氩气发生器氩离子血浆凝固术、热活组织检查钳、微创金属钛夹等技术处理创面;(6)标本处理:切除病灶标本应用大头针固定四周,测量病灶最大长径和与之垂直的短径,4%甲醛溶液固定后送病理检查(见图1)。ESD术后处理:一般禁食1~2 d,给予抑酸、补液等支持治疗;如有迟发性出血,则行胃镜下止血,必要时输血治疗;如有穿孔,则行胃镜下夹闭创面及胃肠减压。对ESD切除标本病理诊断排外PGL的患者追踪随访,此类患者一般为胃癌或非肿瘤的良性疾病(一般为胃溃疡或慢性胃炎)。
患者及家属不同意行ESD后,对常规活组织检查诊断为胃癌或非肿瘤的良性疾病患者进行随访,于治疗后1、3、6个月行胃镜随访。
1.3 病理诊断 PGL诊断依据2016版世界卫生组织(WHO)淋巴造血组织肿瘤分类标准[6],病理标本(包括常规多点深挖掘式活组织检查标本、ESD切除标本、外科手术切除标本)采用组织形态学及IHC检测轻链,观察其形态学特点。将厚度为3~5 μm的石蜡切片裱于载玻片上,常规脱蜡后行IHC。组织经胰酶或高压处理后,检测抗体CD3、CD20、免疫球蛋白κ轻链和λ轻链。
1.4 幽门螺杆菌(helicobacterpylori,HP)检测 患者均行HP检测,包括13C或14C呼气试验、病理组织HE染色检查,阳性结果即判定为HP感染。
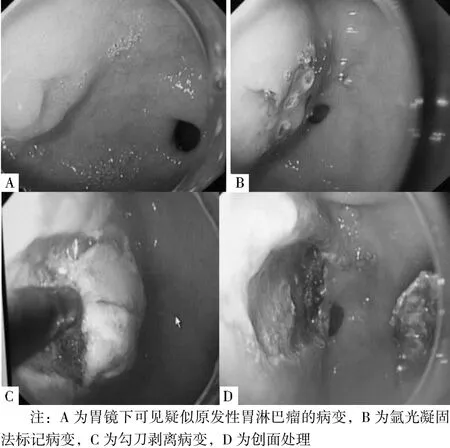
图1 ESD过程Figure 1 The process of ESD resection
1.5 统计学方法 采用SPSS 17.0软件进行统计学分析。诊断正确率的比较采用χ2检验。以p<0.05为差异有统计学意义。
2 结果
2.1 一般资料 16例患者中,14例行ESD,2例拒绝行ESD后失访。14例行ESD患者中,11例诊断为PGL,1例诊断为胃癌(经外科手术病理确诊为胃癌),2例诊断为胃溃疡(按胃溃疡治疗8周,治疗结束后1、4个月行胃镜下随访,其中,1例因溃疡长期不愈合经外科手术病理确诊为PGL;1例半年后复查胃镜,病变愈合)。12例PGL患者中,男8例,女4例;平均年龄为48岁。
2.2 胃镜下病变部位及形态特点 12例确诊为PGL患者中,病变部位≥2个者6例(6/12),仅局限于胃体者3例(3/12),仅局限于胃窦者2例(2/12),仅局限于胃底者1例(1/12)。胃镜下胃体多发浅表糜烂者4例(4/12),多发溃疡、表面附有白色薄苔、有时可见渗血者4例(4/12),胃皱襞增大、增粗者2例(2/12),黏膜蕈状突出、多孤立存在、隆起表面有糜烂或溃疡者2例(2/12,见图2)。
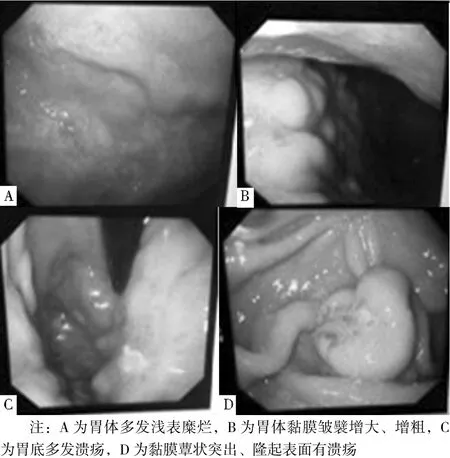
图2 胃镜下PGL表现分型Figure 2 The types of PGL during gastroscopy
2.3 病理诊断 16例患者的病理标本行组织形态学及IHC检测,结果均显示CD3为阴性,CD20为阳性,有免疫球蛋白κ或λ轻链限制性。
2.4 HP感染情况 12例确诊PGL患者均行HP检测,其中11例(11/12)结果为阳性。
2.5 胃镜下获取标本诊断正确率 12例确诊PGL患者中,根据胃镜下表现,2例确诊为PGL,10例误诊为胃溃疡、胃癌、胃息肉、胃炎等,诊断正确2例;行胃镜联合多点深挖掘式活组织检查,5例确诊为PGL,4例误诊为胃溃疡,3例胃镜下高度怀疑胃癌但活组织检查报告未见癌细胞,诊断正确5例;行ESD切除后,11例确诊为PGL,1例误诊为胃溃疡,诊断正确11例。同时胃镜联合多点深挖掘式活组织检查确诊为PGL的5例患者行ESD切除后均诊断为PGL。ESD诊断正确率高于胃镜联合多点深挖掘式活组织检查,差异有统计学意义(χ2=6.750,p<0.05)。
2.6 PGL治疗 12例PGL患者均按照PGL正规治疗。目前临床上常用治疗方法以化疗或放疗为主,而外科手术治疗适应证为出现严重并发症(如大出血、穿孔或梗阻等)。治疗低度恶性PGL,先根除HP感染获得缓解,若无效再考虑其他治疗手段。
2.7 ESD情况 14例患者行ESD切除后病理检查,ESD切除病变直径为0.7~1.8 cm,平均直径为1.1 cm;手术时间(指自病变周边标记开始至创面处理完毕的时间)为25~45 min,平均手术时间为30 min。术中1例患者出血较多,行黏膜下注射肾上腺素及钛夹夹闭,止血成功,未接受输血治疗;术后均未发生迟发性出血;术中及术后均未发生穿孔。
3 讨论
PGL是原发于胃壁内淋巴小结的恶性肿瘤,沿黏膜下生长逐步浸润到胃壁,临床主要表现为腹痛、腹胀等消化道症状,与一般胃癌、消化性溃疡等比较,缺乏特异性;胃镜下表现多样性,无特异性;病变部位部分患者局限在某一部位,部分患者可累及几个部位,亦无特异性,均增加了胃镜下识别及早期诊断的难度。晚期与癌极为相似,主要病理变化不位于胃黏膜表面,所以影响各种检查的阳性率。本研究的12例确诊为PGL的患者中,仅2例根据胃镜形态表现诊断为PGL。PGL病程长,进展缓慢,可数年保持局限性,预后相对较好,但首次胃镜诊断的正确率低。早期准确诊断是该病的重点及难点,也是临床上造成该病易误诊、误治的原因,所以需要找到一种提高PGL诊断正确率的方法。
PGL发病率近年逐渐增长,但术前误诊率高,常被认为是胃癌或胃溃疡、胃息肉等。国内大部分医院主要是依赖胃镜活组织检查病理和IHC技术来诊断该病,但常规胃镜活组织病理检查阳性率不高。目前PGL胃镜下诊断正确率仅为23.8%,术前误诊率可达53%[4],术后经病理检查才能明确诊断。PGL虽有恶性肿瘤的生物学特性,但其治疗和预后明显优于胃癌,主要表现在以下3个方面:(1)PGL患者对化疗敏感,通过术前化疗,可使肿块明显缩小,提高手术切除率,减少术中播散及术后残留,进而提高生存率;(2)采取抗HP治疗[7],部分PGL患者可以治愈,或化疗联合局部放疗的保胃疗法,避免了外科手术治疗及并发症的发生,节省了社会医疗资源,本研究12例确诊PGL患者中,11例被证实伴有HP感染,说明PGL与HP感染有密切联系,根除HP可改善PGL的治疗效果;(3)多数PGL患者不需行手术治疗,由于PGL可累及多个部位,手术效果欠佳,一般外科手术治疗适应证为出现严重并发症(如大出血、穿孔或梗阻等)。以上充分说明了PGL正确诊断的重要性,诊断明确才可以选择合适的治疗方案,避免不必要的手术以及提高患者的生存质量。
PGL浸润较深,常规活组织检查难度较大,很难取到黏膜下层。PGL易误诊的原因有3点:(1)PGL缺乏典型的临床及胃镜表现,与一般的胃癌、胃息肉及胃溃疡等胃部疾病难以鉴别;(2)PGL病变主要来源于黏膜下层,一般胃镜下活组织检查只能取到黏膜层,无法取到黏膜下层,常规活组织检查深度不够;(3)PGL无特异性的肿瘤标志物筛查指标。以上3点原因决定了常规方法诊断PGL的正确率较低。
胃镜结合病理组织学检查是诊断胃内病变的确诊手段。胃镜可以观察病变的形态及位置,还可以通过活组织检查孔道钳取病变检测[8]。但一般活组织检查只能取到黏膜层,深挖掘式活组织检查亦难取到黏膜下层。本研究结果显示,胃镜联合多点深挖掘式活组织检查诊断正确率为41.7%(5/12),常规深挖掘式活组织检查阳性率低的原因:(1)活组织检查钳达到的深度不够,未能有效达到黏膜下层;(2)活组织检查钳夹取的组织一般较小,未取到有效病变组织;(3)活组织检查钳夹取的组织过少,淋巴瘤组织与其他胃癌组织无法有效区分。
PGL虽为胃部恶性肿瘤,但恶性程度低于胃癌,治疗方法也与胃癌不同。已有学者研究报道,胃镜下大块切除病变可有效提高PGL诊断正确率[9]。因此,本研究对高度怀疑PGL而常规胃镜活组织检查不支持诊断者,采用ESD辅助诊断PGL。ESD技术在我国近10年来高速发展,具有可完整切除较大病灶、提供完整病理诊断材料等优点[10]。ESD可以切到黏膜下层甚至更深的层次,可以切除完整大块的标本,从理论上可明显提高诊断正确率,提高PGL的早期确诊水平,可能为PGL的早期诊疗开辟新的途径。
ESD技术已经广泛应用,是我国消化科3大技术〔经内镜逆行性胰胆管造影术(ERCP)、ESD、超声内镜(EUS)〕之一[11]。ESD切除病变的深度可以到黏膜下层甚至固有肌层,可提供准确的病理分期。ESD切除的病变部位可用来明确诊断巨大广基息肉、消化道早癌及类癌等。ESD技术免除了患者外科手术之苦,节约了医疗成本及提高了患者的生存质量,为患者提供更多治疗选择,提高医疗资源的利用率。
ZHOU等[12]研究证实胃镜超声引导下内镜下黏膜切除术(endoscopic mucosal resection,EMR)可提高PGL诊断正确率,但仍有一定的误诊率。笔者分析EMR误诊PGL可能的原因:(1)PGL可累及多个部位,选取行EMR的部位不恰当;(2)EMR切除病变不够完整,可能有残留及未切到有效组织;(3)EMR切除深度未有效达到黏膜下层。ESD是在EMR基础上发展的一种胃镜下微创治疗新技术,可以切到更深的层次,而且可以完整切除病变,是PGL诊断的一种有效的新方法。
PGL进展较慢,部分PGL病灶仅局限在一个部位。有学者指出应用化疗联合ESD治疗PGL合并胃癌已取得了满意的效果,可替代传统外科手术治疗的方法[13]。KUDO等[14]研究结果表明,ESD对于原发性食管淋巴瘤是一种疗效确切的方法。以上均说明ESD有可能成为治疗PGL的一种新微创手段。
本研究结果显示,ESD的诊断正确率为91.7%(11/12),明显提高了PGL的诊断正确率,其中1例患者误诊的原因可能与取材部位不恰当有关。本研究14例行ESD患者中,只有1例患者术中出血,未发生术后迟发性出血、术中及术后穿孔,说明了ESD是一项安全的辅助诊治手段。
综上所述,采用ESD辅助诊断PGL,可提高诊断正确率,降低误诊率。ESD将成为诊断PGL的一种新微创手段,减少患者不必要的手术治疗,给予患者行之有效的靶向治疗。为了更好地选择ESD切除部位及深度,可以术前使用EUS评估。ESD可以作为PGL的一种新的有效辅助诊断手段,值得进一步研究。
作者贡献:黄神安进行文章的构思与设计,结果的分析与解释,撰写论文,论文的修订;黄神安、钱霞进行研究的实施与可行性分析;张丽华、尚红卫进行数据收集;熊萍进行数据整理;钱霞进行统计学处理;黄神安、方念负责文章的质量控制及审校,对文章整体负责,监督管理。
本文无利益冲突。

